Podjela i svojstva složenih anorganskih tvari. Odnos. Klasifikacija anorganskih spojeva i njihova svojstva Klasifikacija anorganskih spojeva oksidi kiseline baze soli
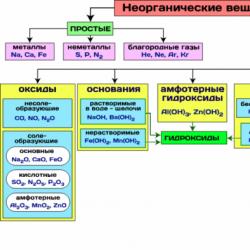
Oksidi– spojevi elemenata s kisikom, oksidacijsko stanje kisika u oksidima je uvijek -2.
Bazični oksidi tvore tipične metale s C.O. +1,+2 (Li 2 O, MgO, CaO, CuO, itd.).
Kiseli oksidi tvore nemetale sa S.O. više od +2 i metali sa S.O. od +5 do +7 (SO 2, SeO 2, P 2 O 5, As 2 O 3, CO 2, SiO 2, CrO 3 i Mn 2 O 7). Iznimka: oksidi NO 2 i ClO 2 nemaju odgovarajuće kisele hidrokside, ali se smatraju kiselima.
Amfoterni oksidi tvore amfoterni metali s C.O. +2,+3,+4 (BeO, Cr 2 O 3, ZnO, Al 2 O 3, GeO 2, SnO 2 i PbO).
Oksidi koji ne stvaraju soli– oksidi nemetala s CO+1,+2 (CO, NO, N 2 O, SiO).
Razlozi (glavni hidroksidi ) - složene tvari koje se sastoje od metalnog iona (ili amonijevog iona) i hidroksilne skupine (-OH).
Kiseli hidroksidi (kiseline)- složene tvari koje se sastoje od atoma vodika i kiselinskog ostatka.
Amfoterni hidroksidi koju čine elementi s amfoternim svojstvima.
Soli- složene tvari sastavljene od metalnih atoma u kombinaciji s kiselim ostacima.
Srednje (normalne) soli- svi atomi vodika u molekulama kiselina zamijenjeni su atomima metala.
Kisele soli- atomi vodika u kiselini su djelomično zamijenjeni atomima metala. Dobivaju se neutralizacijom baze s viškom kiseline. Pravilno imenovati kisela sol, Nazivu normalne soli potrebno je dodati prefiks hidro- ili dihidro-, ovisno o broju vodikovih atoma uključenih u kiselu sol.
Na primjer, KHCO 3 - kalijev bikarbonat, KH 2 PO 4 - kalijev dihidrogenortofosfat
Mora se zapamtiti da kisele soli mogu tvoriti samo dvije ili više bazičnih kiselina.
Bazične soli- hidrokso skupine baze (OH −) su djelomično zamijenjene kiselim ostacima. Imenovati bazična sol, nazivu normalne soli potrebno je dodati prefiks hidrokso- ili dihidrokso-, ovisno o broju OH skupina koje sol sadrži.
Na primjer, (CuOH) 2 CO 3 je bakrov (II) hidroksikarbonat.
Mora se imati na umu da bazične soli mogu tvoriti samo baze koje sadrže dvije ili više hidrokso skupina.
Dvostruke soli- sadrže dva različita kationa, dobiveni su kristalizacijom iz miješane otopine soli s različitim kationima, ali istim anionima. Na primjer, KAl(SO 4) 2, KNaSO 4.
Miješane soli- sadrže dva različita aniona. Na primjer, Ca(OCl)Cl.
Hidratne soli (kristalni hidrati) - sadrže molekule kristalizacijske vode. Primjer: Na 2 SO 4 10H 2 O.
Trivijalni nazivi često korištenih anorganskih tvari:
| Formula | Trivijalno ime |
| NaCl | halit, kamena sol, kuhinjska sol |
| Na2SO4 * 10H20 | Glauberova sol |
| NaNO3 | Natrij, čileanski nitrat |
| NaOH | kaustična soda, kaustična soda, kaustična soda |
| Na2CO3 * 10H20 | kristalna soda |
| Na2CO3 | Soda Ash |
| NaHCO3 | soda bikarbona (piće). |
| K2CO3 | potaša |
| CON | kaustični kalij |
| KCl | kalijeva sol, silvit |
| KClO3 | Bertholletova sol |
| KNO 3 | Kalij, indijska salitra |
| K 3 | crvena krvna sol |
| K 4 | žuta krvna sol |
| KFe 3+ | prusko plava |
| KFe 2+ | Turnbull plava |
| NH4Cl | Amonijak |
| NH3*H20 | amonijak, amonijačna voda |
| (NH 4) 2 Fe(SO 4) 2 | Mohrova sol |
| CaO | živo vapno (paljeno) vapno |
| Ca(OH) 2 | gašeno vapno, vapnena voda, vapneno mlijeko, vapneno tijesto |
| SaSO 4 * 2H 2 O | Gips |
| CaCO3 | mramor, vapnenac, kreda, kalcit |
| CaHPO 4 × 2H2O | Talog |
| Ca(H 2 PO 4) 2 | dvostruki superfosfat |
| Ca(H2PO4)2+2CaSO4 | jednostavni superfosfat |
| CaOCl 2 (Ca(OCl) 2 + CaCl 2) | prašak za izbjeljivanje |
| MgO | magnezijev oksid |
| MgSO4*7H20 | Epsom (gorka) sol |
| Al2O3 | korund, boksit, glinica, rubin, safir |
| C | dijamant, grafit, čađa, ugljen, koks |
| AgNO3 | lapis |
| (CuOH) 2 CO 3 | malahit |
| Cu2S | bakreni sjaj, halkozit |
| CuSO4*5H20 | bakreni sulfat |
| FeSO4*7H20 | inkstone |
| FeS 2 | pirit, željezni pirit, sumporni pirit |
| FeCO 3 | siderit |
| Fe 2 O 3 | crvena željezna ruda, hematit |
| Fe 3 O 4 | magnetska željezna ruda, magnetit |
| FeO × nH2O | smeđa željezna ruda, limonit |
| H2SO4 × nSO 3 | oleumska otopina SO 3 u H 2 SO 4 |
| N2O | plin za smijanje |
| NE 2 | smeđi plin, lisičji rep |
| SO 3 | sumporni plin, sumporni anhidrid |
| SO 2 | sumporni dioksid, sumporov dioksid |
| CO | ugljični monoksid |
| CO2 | ugljični dioksid, suhi led, ugljični dioksid |
| SiO2 | silicij, kvarc, riječni pijesak |
| CO+H2 | vodeni plin, sintezni plin |
| Pb(CH3COO)2 | olovni šećer |
| PbS | olovni sjaj, galenit |
| ZnS | cinkova mješavina, sfalerit |
| HgCl2 | korozivni sublimat |
| HgS | cinobar |
Klasifikacija anorganskih tvari temelji se na njihovoj sposobnosti razgradnje. Jednostavne tvari, koje se sastoje od atoma samo jednog kemijskog elementa (O 2, H 2, Mg), ne raspadaju se. Složene tvari koje se sastoje od atoma dvaju ili više elemenata (CO 2, H 2 SO 4, NaOH, KCl) lako se razlažu.
Jednostavan
Klasifikacija klasa anorganskih tvari uključuje:
- metali - elementi toplinske i električne vodljivosti, visoke duktilnosti, savitljivosti i metalnog sjaja;
- nemetali - elementi koji su lomljiviji od metala, nemaju električnu vodljivost i pokazuju oksidacijska svojstva.

Riža. 1. Shema klasifikacije anorganskih tvari.
Metali se nalaze u donjem lijevom kutu periodnog sustava, nemetali se nalaze u gornjem desnom kutu i uključuju plemenite plinove.

Riža. 2. Položaj metala i nemetala u periodnom sustavu.
Mnogi jednostavni kemijski elementi imaju alotropiju - svojstvo stvaranja nekoliko jednostavnih tvari. Na primjer, kada se kisiku doda još jedan atom, nastaje jednostavna tvar ozon (O 3), a ugljik, ovisno o broju atoma, tvori grafit, ugljen ili dijamant.
Kompleks
Složene tvari se razvrstavaju u sljedeće klase:
- oksidi - sastoje se od dva elementa od kojih je jedan kisik;
- kiseline - sastoje se od atoma vodika i kiselinskog ostatka;
- osnove - sastoji se od metala i jedne ili više hidroksilnih skupina;
- sol - sastoje se od metala i kiselinskog ostatka.
Zasebno su izolirani amfoterni hidroksidi koji pokazuju svojstva kiselina i baza. To su krutine koje su slabi elektroliti. Tu spadaju metalni hidroksidi s oksidacijskim stupnjem +3 i +4. Iznimke su Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2.
Detaljnija klasifikacija složenih tvari prikazana je u tablici s primjerima.
|
Pogled |
Nomenklatura |
Kemijska svojstva |
Primjer |
|
Oksidi - E x O y |
Element oksid (oksidacijsko stanje) |
Postoje bazični oksidi, koji u interakciji s kiselinama tvore soli, i kiseli oksidi, koji u interakciji s bazama tvore kiseline. Zasebno se izoliraju amfoterni oksidi koji stupaju u interakciju s kiselinama i bazama (nastaje sol) |
Na 2 O - natrijev oksid, Fe 2 O 3 - željezov (III) oksid, N 2 O 5 - dušikov oksid (V) |
|
Baze - Me(OH) x |
Metalni hidroksid (oksidacijsko stanje) |
Prema topljivosti razlikuju se lužine i baze netopljive u vodi. Lužine reagiraju s nemetalima i kiselim oksidima. Netopljive baze reagiraju s kiselinama i mogu se razgraditi na visokim temperaturama |
Fe(OH) 2 - željezo (II) hidroksid, Cu(OH) 2 - bakar (II) hidroksid, NaOH - natrijev hidroksid |
|
Kiseline - H n Ac |
Čitati ovisno o kiselinskom ostatku |
Oni stupaju u interakciju s metalima lijevo od vodika u seriji aktivnosti, s oksidima i solima. Sposoban raspadanja na visokim temperaturama |
H 2 SO 4 - sumporna kiselina, HCl - klorovodična kiselina, HNO 3 - dušična kiselina |
|
Soli - krzno x (Ac) y |
Kiselinski ostatak metala (oksidacijsko stanje) |
Reagira s kiselinama, alkalijama, metalima i solima |
Na 2 SO 4 - natrijev sulfat, CaCO 3 - kalcijev karbonat, KCl - kalijev klorid |

Riža. 3. Popis naziva kiselina.
Genetske veze među klasama temelje se na međusobnoj transformaciji tvari. Tijekom kemijskih reakcija atomi prelaze iz jedne tvari u drugu, tvoreći genetske nizove (nizove transformacija). Kada se metal doda kisiku, on tvori oksid, koji se u reakciji s vodom pretvara u bazu. Kiselinski oksid nastaje iz nemetala, koji reagira s vodom i stvara kiselinu. Svaki genetski niz završava sa soli.
Što smo naučili?
Anorganske tvari uključuju jednostavne i složene spojeve. Jednostavne tvari sastoje se od atoma istog elementa. Tu spadaju metali i nemetali. Složeni spojevi uključuju tvari koje se sastoje od nekoliko elemenata. To uključuje okside, kiseline, baze, soli i amfoterne hidrokside. Sve su tvari genetski povezane jedna s drugom. Od jednostavne tvari možete dobiti složeniju tvar. Soli se smatraju najsloženijim tvarima.
Test na temu
Ocjena izvješća
Prosječna ocjena: 4.6. Ukupno primljenih ocjena: 102.
Jednostavne tvari. Molekule se sastoje od atoma iste vrste (atoma istog elementa). U kemijskim reakcijama ne mogu se razgraditi u druge tvari.
Složene tvari (ili kemijski spojevi). Molekule se sastoje od različitih vrsta atoma (atoma različitih kemijskih elemenata). U kemijskim reakcijama razgrađuju se na nekoliko drugih tvari.
Između metala i nemetala nema oštre granice jer Postoje jednostavne tvari koje pokazuju dvojaka svojstva.
Alotropija
Alotropija- sposobnost nekih kemijskih elemenata da tvore nekoliko jednostavnih tvari koje se razlikuju po strukturi i svojstvima.
C - dijamant, grafit, karabin.
O - kisik, ozon.
S - rombični, monoklinski, plastični.
P - bijela, crvena, crna.
Fenomen alotropije uzrokovan je dvama razlozima:
1) različiti brojevi atoma u molekuli, na primjer kisik O 2 i ozon O 3
2) stvaranje raznih kristalnih oblika, na primjer dijamanta i grafita.
BAZE
Razlozi- složene tvari u kojima su atomi metala povezani s jednom ili više hidroksilnih skupina (sa stajališta teorije elektrolitičke disocijacije, baze su složene tvari, pri čijoj disocijaciji u vodenoj otopini nastaju metalni kationi (ili NH4+) a nastaju hidroksid – anioni OH –) .
Klasifikacija. Topljiv u vodi (lužine) i netopljiv. Amfoterne baze također pokazuju svojstva slabih kiselina.
Priznanica
1. Reakcije aktivnih metala (alkalijski i zemnoalkalijski metali) s vodom:
2Na + 2H 2 O ® 2NaOH + H 2 -
Ca + 2H 2 O ® Ca(OH) 2 + H 2 -
2. Interakcija aktivnih metalnih oksida s vodom:
BaO + H 2 O ® Ba(OH) 2
3. Elektroliza vodenih otopina soli
2NaCl + 2H 2 O ® 2NaOH + H 2 - + Cl 2 -
Kemijska svojstva
| Alkalije | Netopljive baze |
| 1. Djelovanje na indikatore. | |
| lakmus – plavo metiloranž – žuta fenolftalein – malina |
-- |
| 2. Interakcija s kiselim oksidima. | |
| 2KOH + CO 2 ® K 2 CO 3 + H 2 O KOH + CO 2 ® KHCO 3 |
-- |
| 3. Interakcija s kiselinama (reakcija neutralizacije) | |
| NaOH + HNO 3 ® NaNO 3 + H 2 O | Cu(OH) 2 + 2HCl® CuCl 2 + 2H 2 O |
| 4. Reakcija izmjene sa solima | |
| Ba(OH) 2 + K 2 SO 4 ® 2KOH + BaSO 4 ¯ 3KOH+Fe(NO 3) 3 ® Fe(OH) 3 ¯ + 3KNO 3 |
-- |
| 5. Toplinska razgradnja. | |
| -- | Cu(OH) 2 - t ° ® CuO + H 2 O |
OKSIDI
Klasifikacija
Oksidi- to su složene tvari koje se sastoje od dva elementa, od kojih je jedan kisik.
| OKSIDI | |
| Ne stvara sol | CO, N2O, NO |
| Tvorbe soli | Osnovni, temeljni - to su metalni oksidi u kojima potonji pokazuju malo oksidacijsko stanje +1, +2 Na20; MgO; CuO |
| |
Amfoteran (obično za metale s oksidacijskim stupnjem +3, +4). Amfoterni hidroksidi im odgovaraju kao hidrati ZnO; Al203; Cr203; SnO2 |
| |
kiselo - to su oksidi nemetala i metala sa stupnjem oksidacije od +5 do +7 SO2; SO 3; P2O5; Mn207; CrO3 |
| |
Bazični oksidi baze odgovaraju kiselo- kiseline, amfoteran- i oni i drugi |
Priznanica
1. Međudjelovanje jednostavnih i složenih tvari s kisikom:
2Mg + O 2 ® 2MgO
4P + 5O 2 ® 2P 2 O 5
S + O 2 ® SO 2
2CO + O 2 ® 2CO 2
2CuS + 3O 2 ® 2CuO + 2SO 2
CH 4 + 2O 2 ® CO 2 + 2H 2 O
4NH 3 + 5O 2 - kat. ® 4NO + 6H20
2. Razgradnja nekih tvari koje sadrže kisik (baze, kiseline, soli) kada se zagrijava:
Cu(OH) 2 - t ° ® CuO + H 2 O
(CuOH) 2 CO 3 - t ° ® 2CuO + CO 2 + H 2 O
2Pb(NO 3) 2 - t ° ® 2PbO + 4NO 2 + O 2
2HMnO 4 - t °; H 2 SO 4 (konc.) ® Mn 2 O 7 + H 2 O
Kemijska svojstva
| Bazični oksidi | Kiseli oksidi |
| 1. Interakcija s vodom | |
| Baza se formira: Na 2 O + H 2 O® 2NaOH CaO + H 2 O ® Ca(OH) 2 |
Kiselina nastaje: SO 3 + H 2 O ® H 2 SO 4 P 2 O 5 + 3H 2 O® 2H 3 PO 4 |
| 2. Interakcija s kiselinom ili bazom: | |
| Pri reakciji s kiselinom nastaju sol i voda MgO + H 2 SO 4 - t ° ® MgSO 4 + H 2 O CuO + 2HCl - t ° ® CuCl 2 + H 2 O |
Pri reakciji s bazom nastaju sol i voda CO 2 + Ba(OH) 2 ® BaCO 3 + H 2 O SO 2 + 2NaOH® Na 2 SO 3 + H 2 O |
| Amfoterni oksidi međusobno djeluju | |
| s kiselinama kao bazama: ZnO + H 2 SO 4 ® ZnSO 4 + H 2 O |
s bazama kao kiselima: ZnO + 2NaOH ® Na 2 ZnO 2 + H 2 O (ZnO + 2NaOH + H 2 O ® Na 2) |
| 3. Međusobnim djelovanjem bazičnih i kiselih oksida nastaju soli. | |
| Na 2 O + CO 2 ® Na 2 CO 3 | |
| 4. Redukcija na jednostavne tvari: | |
| 3CuO + 2NH 3 ® 3Cu + N 2 + 3H 2 O P 2 O 5 + 5C ® 2P + 5CO |
|
I njihove izvedenice. Sve ostale tvari su anorganske.
Klasifikacija anorganskih tvari
Anorganske tvari se prema sastavu dijele na jednostavne i složene.
Jednostavne tvari sastoje se od atoma jednog kemijskog elementa i dijele se na metale, nemetale i plemenite plinove. Složene tvari sastoje se od atoma različitih elemenata međusobno kemijski povezanih.
Složene anorganske tvari, prema svom sastavu i svojstvima, dijele se u sljedeće važne klase: oksidi, baze, kiseline, amfoterni hidroksidi, soli.
Sadržaj lekcije bilješke lekcije prateći okvir lekcija prezentacija metode ubrzanja interaktivne tehnologije Praksa zadaci i vježbe radionice za samotestiranje, treninzi, slučajevi, potrage domaća zadaća pitanja za raspravu retorička pitanja učenika Ilustracije audio, video isječci i multimedija fotografije, slike, grafike, tablice, dijagrami, humor, anegdote, vicevi, stripovi, parabole, izreke, križaljke, citati Dodaci sažetakačlanci trikovi za znatiželjne jaslice udžbenici osnovni i dodatni rječnik pojmova ostalo Poboljšanje udžbenika i nastaveispravljanje grešaka u udžbeniku ažuriranje ulomka u udžbeniku, elementi inovacije u nastavi, zamjena zastarjelih znanja novima Samo za učitelje savršene lekcije kalendarski plan za godinu, metodološke preporuke, program rasprave Integrirane lekcijeKlasifikacija tvari
Sve tvari se dijele na jednostavne (elementarne) i složene. Jednostavne tvari sastoje se od jednog elementa, složene tvari - od dva ili više elemenata. Jednostavne tvari dijelimo na metale i nemetale.
Metali imaju karakterističan "metalni" sjaj, savitljivi su, savitljivi, mogu se smotati u listove ili izvlačiti u žicu i imaju dobru toplinsku i električnu vodljivost. Na sobnoj temperaturi svi su metali (osim žive) u čvrstom stanju.
Nemetali nemaju sjaj karakterističan za metale, krti su i vrlo slabo provode toplinu i elektricitet. Neki od njih su u normalnim uvjetima plinoviti.
Složene tvari dijelimo na organske i anorganske (mineralne). Organske spojeve obično nazivamo spojevima ugljika, s izuzetkom najjednostavnijih spojeva ugljika (CO, CO 2, H 2 CO 3, HCN i njihove soli itd.); sve ostale tvari nazivamo anorganskima.
Složeni anorganski spojevi klasificiraju se i prema sastavu i prema kemijskim svojstvima (funkcionalnim karakteristikama). Prema sastavu prvenstveno se dijele na dvoelementne ili binarne spojeve (oksidi, sulfidi, halogenidi, nitridi, karbidi, hidridi) i višeelementne spojeve; koji sadrže kisik, koji sadrže dušik itd.
Na temelju svojih kemijskih svojstava, anorganski spojevi se dijele u četiri glavne klase: oksidi, kiseline, baze i soli.
Oksidi
Oksidi su složene tvari koje se sastoje od dva elementa od kojih je jedan kisik(Cr 2 O 3, K 2 O, CO 2, itd.). Kisik u oksidima je uvijek dvovalentan i ima oksidacijsko stanje -2.
Na temelju kemijskih svojstava oksidi se dijele na soli koje tvore i one koje ne tvore soli.(indiferentno: CO, NO, N 2 O). Okside koji stvaraju soli dijelimo na bazične, kisele i amfoterne.
Bazični su oksidi koji reagiraju s kiselinama ili kiselim oksidima stvarajući soli:
CuO + 2HCl=CuCl 2 + H 2 O,
MgO + CO 2 = MgCO 3.
Stvaranje bazičnih oksida tipično je za metale s niskim oksidacijskim stupnjem (+1, +2).
Oksidi alkalnih (Li, Na, K, Rb, Cs) i zemnoalkalijskih metala (Ca, Sr, Ba, Ra) reagiraju s vodom, tvoreći baze. Na primjer:
Na 2 O + H 2 O = 2NaOH,
CaO + H 2 O = Ca(OH) 2.
Većina bazičnih oksida ne stupa u interakciju s vodom. Baze takvih oksida dobivaju se neizravno:
a) CuO + 2HCl=CuCl2 + H2O;
b) CuCl 2 + 2KOH = Cu(OH) 2 + 2KCl.
Oksidi koji reagiraju s bazama ili bazičnim oksidima i tvore soli nazivaju se kiseli. Na primjer:
SO3 + 2KOH = K2SO4 + H2O,
CaO + CO 2 = CaCO 3.
Kiseli oksidi uključuju okside tipičnih nemetala-SO 2, N 2 O 5, SiO 2, CO 2 itd., kao i metalni oksidi s visokim stupnjem oksidacije (+5, +6, +7, +8)-V 2 O 5, CrO 3, Mn 2 O 7 itd.
Niz kiselih oksida (SO 3, SO 2, N 2 O 3, N 2 O 5, CO 2, itd.) u interakciji s vodom stvara kiseline:
SO3 + H2O = H2SO4,
N2O5 + H2O = 2HNO3.
Odgovarajuće kiseline drugih kiselih oksida (SiO 2, TeO 2, TeO 3, MoO 3, WO 3 itd.) dobivaju se posredno. Na primjer:
a) SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O
b) Na 2 SiO 3 + 2HCl = H 2 SiO 3 + 2NaCl
Jedan od načina dobivanja kiselinskih oksida je uklanjanje vode iz odgovarajućih kiselina. Stoga se kiselinski oksidi ponekad nazivaju kiselinski anhidridi.
Amfoterni su oksidi koji tvore soli u interakciji s kiselinama i bazama, tj. imaju dvojna svojstva - svojstva bazičnih i kiselih oksida. Na primjer:
SnO + H 2 SO 4 = SnSO 4 + H 2 O,
SnO + 2KOH + H 2 O = K 2,
ZnO + 2KOH = K 2 ZnO 2 + H 2 O.
Amfoterni oksidi uključuju: ZnO, BeO, SnO, PbO, Al 2 O 3, Cr 2 O 3, Fe 2 O 3, Sb 2 O 3, MnO 2 i tako dalje.
Treba napomenuti da se u skladu s promjenom kemijske prirode elemenata u periodnom sustavu elemenata (od metala do nemetala) prirodno mijenjaju kemijska svojstva spojeva, posebice kiselinsko-bazna aktivnost njihovih spojeva. oksidi. Dakle, u slučaju viših oksida elemenata 3. perioda u nizu: Na 2 O, MgO, Al 2 O 3, SiO 2, P 2 O 5, SO 3, Cl 2 O 7 - kao stupanj polariteta veze E-O se smanjuje (smanjuje se DEO; smanjuje se negativni efektivni naboj atoma kisika) slabe bazični oksidi i povećavaju kisela svojstva: Na 2 O, MgO - bazični oksidi; Al 2 O 3 – amfoteran; SiO 2 , P 2 O 5 , SO 3 , Cl 2 O 7 su kiseli oksidi (s lijeva na desno, kiselost oksida raste).
Metode dobivanja oksida:
1. Interakcija jednostavnih tvari s kisikom (oksidacija):
4Fe + 3O 2 = 2Fe 2 O 3,
S + O 2 = SO 2.
2. Izgaranje složenih tvari:
CH 4 + 2O 2 = CO 2 + 2H 2 O,
2SO 2 + O 2 = 2SO 3.
3. Toplinska razgradnja soli, baza, kiselina:
CaCO 3 ® CaO + CO 2,
Cd(OH) 2 ® CdO + H 2 O,
H 2 SO 4 ® SO 3 + H 2 O.
Nomenklatura oksida. Imena oksida grade se od riječi oksid i naziva elementa u genitivu koji je vezan za atome kisika. Ako element tvori više oksida, tada se njegovo oksidacijsko stanje (s.o.) označava u zagradama rimskim brojevima, sa znakom c. O. nije specificirano. Na primjer, MnO 2 je mangan (IV) oksid, MnO je mangan (II) oksid. Ako element tvori jedan oksid, tada je njegov s. O. nije dano: Na 2 O – natrijev oksid.
Ponekad nazivi oksida sadrže prefikse di-, tri-, tetra- itd. Oni pokazuju da u molekuli ovog oksida ima 2,3,4, itd. po atomu elementa. atom kisika, na primjer, CO 2 - ugljikov dioksid itd.
Hidroksidi
Među višeelementnim spojevima važnu skupinu čine hidroksidi su složene tvari koje sadrže OH hidroksilne skupine. Neki od njih (bazični hidroksidi) pokazuju svojstva baza - NaOH, Ba(OH) 2 itd.; drugi (kiselinski hidroksidi) pokazuju svojstva kiselina - HNO 3, H 3 PO 4 itd.; Postoje i amfoterni hidroksidi koji, ovisno o uvjetima, mogu pokazivati i bazična i kisela svojstva - Zn(OH) 2, Al(OH) 3 itd.
Svojstva i karakter hidroksida također ovise o naboju jezgre središnjeg atoma (simbol E) i njegovom polumjeru, t.j. o jakosti i polarnosti E–O i O–N veza.
Ako je energija vezanja E O - H<< E Э - О, то диссоциация гидроксида протекает по кислотному типу, т. е. разрушается связь О – Н.
EON Û EO - + H +
Ako je E O-H >> E E – O, tada se disocijacija hidroksida odvija prema glavnom tipu, tj. E – O veza se uništava
EOH Û E + + OH -
Ako su energije O – H i E – O veza bliske ili jednake, tada se disocijacija hidroksida može dogoditi istovremeno u oba smjera. U ovom slučaju govorimo o amfoternim hidroksidima:
E n+ + nOH - Û E(OH) n = H n EO n Û nH + + EO n n-
U skladu s promjenom kemijske prirode elemenata u periodnom sustavu elemenata prirodno se mijenja i kiselinsko-bazna aktivnost njihovih hidroksida: od bazičnih hidroksida preko amfoternih do kiselih. Na primjer, za više hidrokside elemenata postoje 3 razdoblja:
NaOH, Mg(OH) 2 – baze (s lijeva na desno glavna svojstva slabe);
Al(OH) 3 – amfoterni hidroksid;
H 2 SiO 3 , H 3 PO 4 , H 2 SO 4 , HClO 4 – kiseline (s lijeva na desno, jačina kiselina raste).
Metalni hidroksidi se klasificiraju kao baze. Što su metalna svojstva nekog elementa jasnije izražena, to su osnovna svojstva odgovarajućeg metalnog hidroksida u najvećoj mjeri izraženija. Hidroksidi nemetala pokazuju kisela svojstva. Što su nemetalna svojstva nekog elementa izraženija, to su kiselinska svojstva odgovarajućeg hidroksida jača.
kiseline
Kiseline su tvari koje disociraju u otopinama pri čemu nastaju vodikovi kationi i anioni kiselinskog ostatka (sa stajališta teorije elektrolitičke disocijacije).
Kiseline se dijele prema jakosti (prema sposobnosti elektrolitičke disociacije - na jake i slabe), prema bazičnosti (prema broju atoma vodika u molekuli kiseline koji se mogu zamijeniti atomima metala u sol - na jednobazične, dvobazične , trobazična), prisutnošću ili odsutnošću kisika u sastavu kiseline (s kisikom i bez kisika). Na primjer, dušična kiselina HNO 3 je jaka, jednobazna kiselina koja sadržava kisik; Sumporovodikova kiselina H 2 S je slaba dvobazna kiselina bez kisika.
Kemijska svojstva kiselina:
1. Interakcija s bazama pri čemu nastaju sol i voda (reakcija neutralizacije):
H 2 SO 4 + Cu (OH) 2 = CuSO 4 + 2H 2 O.
2. Interakcija s bazičnim i amfoternim oksidima uz stvaranje soli i vode:
2HNO3 + MgO = Mg(NO3)2 + H2O,
H 2 SO 4 + ZnO = ZnSO 4 + H 2 O.
3. Interakcija s metalima. Metali koji su u "Seriji naprezanja" prije vodika istiskuju vodik iz kiselih otopina (osim dušične i koncentrirane sumporne kiseline); ovo proizvodi sol:
Zn + 2HCl = ZnCl2 + H2.
Metali smješteni u "Seriji naprezanja" nakon vodika ne istiskuju vodik iz kiselih otopina
Za interakciju metala s dušičnom i koncentriranom sumpornom kiselinom, vidi odjeljak 11.
4. Neke kiseline se zagrijavanjem razgrađuju:
H 2 SiO 3 H 2 O + SiO 2 .
5. Manje hlapljive kiseline istiskuju hlapljivije kiseline iz njihovih soli:
H 2 SO 4 konc + NaCl tv = NaHSO 4 + HCl.
6. Jače kiseline istiskuju manje jake kiseline iz otopina svojih soli:
2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2
Nomenklatura kiselina. Imena kiselina bez kisika sastavljaju se dodavanjem sufiksa - korijenu ruskog naziva elementa koji tvori kiselinu (ili nazivu grupe atoma, na primjer, CN - cijan, CNS - rodan). O-, završetak vodik i riječ "kiselina". Na primjer, HCl je klorovodična kiselina, H 2 S je hidrosulfidna kiselina, HCN je cijanovodična kiselina.
Nazivi kiselina koje sadrže kisik također se formiraju od ruskog naziva elementa koji stvara kiselinu uz dodatak odgovarajućih sufiksa, završetaka i riječi "kiselina". U ovom slučaju naziv kiseline u kojoj je element u najvišem oksidacijskom stanju završava na - Naya ili - novi; na primjer, H 2 SO 4 je sumporna kiselina, HClO 4 je perklorna kiselina, H 3 AsO 4 je arsenska kiselina. Sa smanjenjem oksidacijskog stanja elementa koji stvara kiselinu, završeci se mijenjaju u sljedećem nizu: - ovalan(HClO 3 - perklorna kiselina), iscrpljen(HClO 2 - klornata kiselina), - ovalan(HClO - hipoklorna kiselina). Ako element tvori kiseline dok je u samo dva oksidacijska stanja, tada naziv kiseline koji odgovara nižem oksidacijskom stupnju elementa ima završetak iscrpljen(HNO 3 – nitratna kiselina, HNO 2 – nitratna kiselina).
U nekim slučajevima, različiti broj molekula vode može se pridružiti jednoj molekuli oksida (tj. element u istom oksidacijskom stanju tvori nekoliko kiselina koje sadrže jedan atom danog elementa). Tada se kiselina s visokim sadržajem vode označava prefiksom orto- , a kiselina s manjim brojem molekula vode označava se prefiksom meta- . Na primjer:
P 2 O 5 + H 2 O = 2HPO 3 - metafosforna kiselina;
P 2 O 5 + 3H 2 O = 2H 3 PO 4 - ortofosforna kiselina.
Razlozi
Osnova sa stajališta teorije elektrolitičke disocijacije su tvari koje disociraju u otopinama uz stvaranje hidroksidnih iona OH ‾ i metalnih iona (s izuzetkom NH 4 OH).
Baze se klasificiraju prema njihovoj snazi(prema sposobnosti elektrolitičke disocijacije - na jaku i slabu), po kiselosti(po broju hidrokso skupina u molekuli koje se mogu zamijeniti kiselim ostacima - monokiselina, dikiselina itd.), po topljivosti(za topljive baze - lužine i netopljive). Na primjer: NaOH – jaka, jednokiselinska baza, topiva (lužina); Cu(OH) 2 je slaba dikiselina, netopljiva baza. Topljive baze (alkalije) uključuju hidrokside alkalnih i zemnoalkalijskih metala. Sve lužine su jake baze.
Kemijska svojstva baza:
1. Interakcija s kiselinama:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 ¯ + H 2 O.
2. Interakcija s kiselim oksidima:
3. Interakcija s amfoternim oksidima:
2KOH + Al 2 O 3 = 2KAlO 2 + H 2 O 1,
2KOH + SnO + H2O = K2 [Sn(OH)4].
4. Interakcija s amfoternim bazama:
2NaOH + Zn(OH) 2 = Na 2 ZnO 2 + 2H 2 O2,
2NaOH + Zn(OH) 2 = Na 2 [Zn(OH) 4 ]3.
5. Toplinska razgradnja baza uz nastajanje oksida i vode:
Ca(OH) 2 = CaO + H 2 O.
Hidroksidi alkalijskih metala ne raspadaju se zagrijavanjem.
6. Interakcija s amfoternim metalima (Zn, Al, Pb, Sn, Be):
Zn + 2NaOH + 2H2O = Na2 + H2
Amfoterni hidroksidi. Amfoterni hidroksidi (hidrati amfoternih oksida) sposobni su disocirati u vodenim otopinama i kao kiseline i kao baze. Na primjer:
ZnO 2 2- + 2H + Û Zn(OH) 2 Û Zn 2+ + 2OH.
Zbog toga imaju amfoterna svojstva, tj. može djelovati i s kiselinama i s bazama:
Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O,
Sn(OH) 2 + 2NaOH = Na 2 [Sn(OH) 4 ].
Nomenklatura osnova. Nazivi baza grade se od riječi “ hidroksid” i naziv metala u genitivnom padežu, s naznakom njegovog oksidacijskog stanja u zagradama rimskim brojevima, ako se radi o promjenljivoj vrijednosti. Ponekad se riječi hidroksid dodaje prefiks iz grčkog broja, koji označava broj hidroksilnih skupina u baznoj molekuli. Na primjer: KOH - kalijev hidroksid; Al(OH) 3 - aluminijev hidroksid (aluminijev trihidroksid); Cr(OH) 2 – kromov (II) hidroksid (kromov dihidroksid).
Soli
Sa stajališta teorije elektrolitičke disocijacije soli su tvari koje disociraju u otopinama ili talinama i stvaraju pozitivno nabijene ione osim vodikovih iona i negativno nabijene ione osim hidroksidnih iona.
Soli se obično smatraju produktima potpune ili djelomične zamjene atoma vodika u molekuli kiseline metalnim atomima ili produktima potpune ili djelomične zamjene hidroksilnih skupina u molekuli baze kiselim ostacima. Uz potpunu supstituciju dobivaju se srednje (ili normalne) soli koje disociraju u otopinama ili talinama i tvore metalne katione i anione kiselih ostataka (s izuzetkom amonijevih soli). Kada je vodik kiseline nepotpuno zamijenjen, nastaju kisele soli, a kada su hidroksilne skupine baze nepotpuno zamijenjene, nastaju bazične soli. O disocijaciji kiselih i bazičnih soli govori se u odjeljku 8. Kisele soli mogu nastati samo od polibazičnih kiselina (H 2 SO 4, H 2 SO 3, H 2 S, H 3 PO 4 itd.), a bazične soli mogu tvore polikisele baze (Mg (OH) 2, Ca (OH) 2, Al (OH) 3 itd.).
Primjeri stvaranja soli:
Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O,
CaSO 4 (kalcijev sulfat) – normalna (prosječna) sol;
H 2 SO 4 + NaOH = NaHSO 4 + H 2 O,
NaHSO 4 (natrijev hidrogen sulfat) je kisela sol dobivena kao rezultat nedostatka određene baze;
Cu (OH) 2 + HCl = CuOHCl + H 2 O,
CuOHCl (hidroksibakar(II) klorid) je bazična sol koja se dobiva kao rezultat nedostatka uzete kiseline.
Kemijska svojstva soli:
I. Soli stupaju u reakcije ionske izmjene ako nastane talog, slabi elektrolit ili se oslobodi plin:
Soli čiji metalni kationi odgovaraju netopljivim bazama reagiraju s alkalijama:
CuSO 4 + 2NaOH = Na 2 SO 4 + Cu (OH) 2 ↓;
Soli u interakciji s kiselinama:
a) čiji kationi tvore netopljivu sol s anionom nove kiseline:
BaCl 2 + H 2 SO 4 = BaSO 4 ↓ + 2HCl;
b) čiji anioni odgovaraju nestabilnoj ugljičnoj ili bilo kojoj hlapljivoj kiselini (u potonjem slučaju reakcija se odvija između krute soli i koncentrirane kiseline):
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2,
Krutine NaCl + H 2 SO 4 konc = NaHSO 4 + HCl;
c) čiji anioni odgovaraju slabo topljivoj kiselini:
Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl;
d) čiji anioni odgovaraju slaboj kiselini:
2CH3COONa + H2SO4 = Na2SO4 + 2CH3COOH;
soli međusobno djeluju ako je jedna od novonastalih soli netopljiva ili se raspada (potpuno hidrolizira) uz oslobađanje plina ili taloga:
AgNO 3 + NaCl = NaNO 3 + AgCl↓,
2AlCl 3 + 3Na 2 CO 3 + 3H 2 O = 2Al (OH) 3 ↓ + 6NaCl + 3CO 2.
II. Soli mogu djelovati s metalima ako se metal kojemu odgovara kation soli nalazi u "Voltage Series" desno od slobodnog metala koji reagira (aktivniji metal istiskuje manje aktivni metal iz otopine njegove soli):
Zn + CuSO 4 = ZnSO 4 + Cu.
III. Neke soli se zagrijavanjem razgrađuju:
CaCO 3 = CaO + CO 2.
IV. Neke soli mogu reagirati s vodom i formirati kristalne hidrate:
CuSO 4 + 5H 2 O = CuSO 4 ٭ 5H 2 O ΔH<0
bijelo plavo-plavo
Oslobađanje topline i promjene boje znakovi su kemijskih reakcija.
V. Soli se hidrolizuju. Ovaj proces će biti detaljno opisan u odjeljku 8.10.
VI. Kemijska svojstva kiselih i bazičnih soli razlikuju se od svojstava prosječnih soli po tome što i kisele soli stupaju u sve reakcije karakteristične za kiseline, a bazične soli stupaju u sve reakcije karakteristične za baze. Na primjer:
NaHSO 4 + NaOH = Na 2 SO 4 + H 2 O,
MgOHCl + HCl = MgCl2 + H2O.
Dobivanje soli:
1. Interakcija glavnog oksida s kiselinom:
CuO + H 2 SO 4 = CuSO 4 + H 2 O.
2. Interakcija metala sa soli drugog metala:
Mg + ZnCl 2 = MgCl 2 + Zn.
3. Interakcija metala s kiselinom:
Mg + 2HCl = MgCl2 + H2.
4. Interakcija baze s kiselinskim oksidom:
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
5. Interakcija baze s kiselinom:
Fe(OH)3 + 3HCl= FeCl3 + 3H2O.
6. Interakcija soli s bazom:
FeCl 2 + 2KOH = Fe(OH) 2 ¯ + 2KCl.
7. Interakcija dviju soli:
Ba(NO 3) 2 + K 2 SO 4 = BaSO 4 ¯ + 2KNO 3.
8. Međudjelovanje metala s nemetalom:
9. Interakcija kiseline sa soli:
CaCO3 + 2HCl = CaCl2 + H2O + CO2.
10. Međudjelovanje kiselih i bazičnih oksida:
CaO + CO 2 = CaCO 3.
Nomenklatura soli. Prema pravilima međunarodne nomenklature, Nazivi srednjih soli tvore se od naziva kiselinskog ostatka u nominativnom slučaju i naziva metala u genitivnom slučaju, označavajući njegov stupanj oksidacije u zagradama rimskim brojevima (ako je to promjenjiva vrijednost). Naziv kiselinskog ostatka sastoji se od korijena latinskog naziva elementa koji stvara kiselinu, odgovarajućeg završetka i, u nekim slučajevima, prefiksa.
Kiselinski ostaci kiselina bez kisika dobivaju završetak bajram. Na primjer: SnS – kositar (II) sulfid, Na 2 Se – natrijev selenid. Završeci naziva kiselinskih ostataka kiselina koje sadrže kisik ovise o stupnju oksidacije elementa koji tvori kiselinu. Za najviši stupanj oksidacije ("-th" ili "-ic" kiselina), koristi se završetak -na. Na primjer, soli dušične kiseline HNO 3 nazivaju se nitrati, sumporne kiseline H 2 SO 4 - sulfati, kromne kiseline H 2 CrO 4 - kromati. Za niži stupanj oksidacije elementa koji tvori kiselinu ("...čista kiselina") koristi se završetak to. Tako se soli dušikaste kiseline HNO2 nazivaju nitriti, a soli sumporne kiseline H2SO3 nazivaju se sulfiti. Ako postoji kiselina s još nižim oksidacijskim stupnjem elementa koji tvori kiselinu ("jajasta kiselina"), njezin anion dobiva prefiks hipo- i kraj - to. Na primjer, soli hipokloričaste kiseline HClO nazivaju se hipokloriti.
Soli nekih kiselina, u skladu s povijesnom tradicijom, zadržale su nazive koji se razlikuju od sustavnih. Tako se soli manganske kiseline HMnO 4 nazivaju permanganati, perklorne kiseline HClO 4 - perklorati, a periodne kiseline HIO 4 - periodati. Soli manganove kiseline H 2 MnO 4 , klorovodične kiseline HClO 3 i jodne kiseline HIO 3 nazivaju se manganati, klorati i jodati.
Nazivi kiselih i bazičnih soli tvore se prema istim općim pravilima kao i nazivi intermedijarnih soli. U ovom slučaju, ime aniona kisele soli ima prefiks hidro-, koji ukazuje na prisutnost nesupstituiranih atoma vodika; Broj nesupstituiranih atoma vodika označen je prefiksima grčkih brojeva. Na primjer, Na 2 HPO 4 je natrijev hidrogen ortofosfat, NaH 2 PO 4 je natrijev dihidrogen ortofosfat.
Slično tome, bazni kation soli dobiva prefiks hidrokso-, što ukazuje na prisutnost nesupstituiranih hidrokso skupina. Broj hidroksilnih skupina označen je grčkim brojevima. Na primjer, Cr(OH) 2 NO 3 je dihidroksikrom (III) nitrat.
Nazivi najvažnijih kiselina i njihovi kiselinski ostaci dati su u tablici. 4.1.
Tablica 4.1
Imena i formule kiselina i njihovih kiselinskih ostataka
Nastavak tablice. 4.1