Energetski nivoi atoma. Borovi postulati i kvantizacija orbite
Za elektron pod djelovanjem sila privlačenja na jezgro, Schrödingerova jednadžba ima rješenja ne za bilo koje, već samo za određene vrijednosti energije. Stoga se ispostavlja da je kvantizacija energetskih stanja elektrona u atomu (tj. Bohrov prvi postulat) posljedica valnih svojstava inherentnih elektronu i ne zahtijeva uvođenje posebnih postulata.
A kada vam nešto nije dobro, mišić zapravo pokazuje slabost, ali samo zato što je energija koja prolazi kroz njega oslabljena. Vaša energija je oslabljena kada imate negativne misli o sebi ili drugima, ali i kada supstanca, hrana ili lijek, namjera ili odluka nije ispravna za vas ili jednostavno nije u vašem najboljem interesu.
Šta je energetski test?
Ovo je iskrena reakcija vaše energije, "povoljnija" na reakciju mišića u vašem tijelu. Podignite ruku gore-dole kao što je prikazano na slici, ispružite ruku, ali nemojte se previše naprezati i izgovorite svoje ime. Vjerovatno neće moći pomjeriti ruku jer će mišić ostati jak jer je vaša energija u skladu s tvrdnjom i zna da je to istina za vas.
Za bolje razumijevanje posljednje izjave, razmotrite pojednostavljeni model atoma, "jednodimenzionalni atom", u kojem elektron može samo napraviti oscilatorna kretanja između ekstremnih tačaka.
Takođe pretpostavljamo da su granice atoma neprobojne za elektron, tako da on može biti samo unutar atoma. Već znamo da stanje elektrona u atomu karakteriše određeni talas („de Broglie talas“). Ali bilo bi pogrešno zamisliti širenje ovog vala kao nešto slično kretanju vala koji nastaje na površini vode od bačenog kamena: vodeni val se kreće beskonačno od mjesta svog nastanka i postepeno se širi, nemaju stabilnost u vremenu, dok je elektron u atomu stabilan. Stoga će analogija između stanja elektrona u atomu i stanja zvučne žice na kojoj se formiraju takozvani stojeći valovi biti ispravnija.
Pustite prijatelja da isproba snagu vaše ruke i vidite kako će je lako skinuti. Vaš energetski sistem zna da to nije istina. Sada zamislite nešto ugodno i radosno, a test će pokazati snagu mišića, a ruka će vam ostati ispružena. Razmislite o negativnoj misli ili nečem lošem za drugu osobu ili zamislite da plačete i budete tužni i vaša će se ruka lako ukloniti. Vidjet ćete kako to slabi vašu energiju kada ste negativni, pod stresom ste ili nešto nije u redu ili nije dobro za vas.
Naravno, jednostavno je i opći opis energetski test. Mogao bi vam reći mnogo stvari, a ako ste jako amaterski bavite se njime. Međutim, kada se koristi kao alat u energetskoj psihologiji, postaje izuzetno pouzdano i sigurno sredstvo za otkrivanje blokada energetskih meridijana, kao i sredstvo za pronalaženje najprikladnijeg načina za balansiranje i obnavljanje protoka energije, a time i vašeg zdravlja.
Na sl. 6 shematski prikazuje stojne valove koji nastaju na oscilirajućoj struni, čije su krajnje tačke fiksirane. U tačkama označenim slovom n pojavljuju se antičvorovi - ovde je amplituda oscilovanja maksimalna, u tačkama y niz ne osciluje - to su čvorovi u kojima je amplituda oscilovanja nula; u tačkama koje se nalaze između čvorova i antičvorova, amplituda oscilovanja ima srednje vrednosti. Budući da su krajnje tačke niza fiksne, ovdje će sigurno postojati čvorovi. Za razliku od običnog "putujućeg" talasa, stajaći talas se ne kreće u prostoru i ne prenosi energiju, koja se samo prenosi sa jedne tačke žice na drugu. Lako je vidjeti (slika 6) da na žici sa fiksiranim krajevima dužina stojećeg vala možda neće biti nikakva, već samo takva da stane cijela struna. cijeli broj polutalasi: jedan (slika 6, a), dva (slika 6, b), tri (slika 6, c) itd.
Gore opisane metode energetskog testiranja rade se sa partnerom, koji može biti vaš terapeut ili prijatelj. Postoje i drugi načini da se testirate i dobijete odgovore koji su vam potrebni. Nisu složene, pristupačne i lako svarljive. Ovo je još jedan način da preuzmete brigu o svom zdravlju i naučite da "govorite" sa sopstvenom energijom.
Na taj način možete pouzdano testirati odluke u koje sumnjate, isključivo životne odluke s kojima se suočavate i mnoge druge stvari koje su važne za vaše zdravlje i život. Mogućnosti energetskog testa su praktično neograničene, jednostavno zato što je to prečica do vaše podsvijesti gdje se zaista nalaze svi odgovori.
U jednodimenzionalnom modelu atoma koji se razmatra mora postojati i de Broglieov val: to proizilazi iz činjenice da elektron ne može ići izvan granica atoma i, posljedično, valna funkcija (tj. amplituda val) mora nestati na granicama atoma. Stoga sl. 6 se može smatrati modelom jednodimenzionalnog atoma s de Broglieovim stajaćim valovima koji se mogu formirati u tom atomu.
Ako je dužina jednodimenzionalnog atoma l, tada za slučajeve a, b i c na sl. 6 de Broljeva talasna dužina će biti izražena na sledeći način:
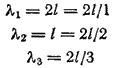
Stoga se stojni talas može formirati samo ako
gdje , tj. cijeli broj.
Rice. 6. Stojeći talasi na žici.
S druge strane, prema de Broglieovoj jednadžbi
Izjednačavajući desne dijelove posljednje dvije jednačine, dobijamo izraz za brzinu elektrona:
Sada, znajući brzinu elektrona, možemo je pronaći kinetička energija E:
Kako je n cijeli broj, posljednji izraz pokazuje da energija elektrona u jednodimenzionalnom atomu ne može imati proizvoljne vrijednosti: za n=1 jednaka je vrijednosti razlomka, za n=2 4 puta veća , za n=3 - 9 puta više, itd. Dakle, u slučaju jednodimenzionalnog atoma valna svojstva elektrona, izražene de Broljevom jednačinom, zaista imaju za posljedicu kvantizaciju energetskih stanja elektrona. U ovom slučaju, dozvoljeni energetski nivoi elektrona određeni su vrednošću celog broja n, koji se naziva kvantni broj.
Naravno, pronađeni izraz za energiju elektrona odnosi se na pojednostavljeni model atoma. Ali za pravi atom, rješenje Schrödingerove jednadžbe također dovodi do zaključka da su energetska stanja elektrona u atomu kvantizirana.
Model jednodimenzionalnog atoma omogućava razumijevanje zašto elektron u atomu u stacionarnom stanju ne zrači elektromagnetsku energiju (drugi postulat Borove teorije). Prema Bohr-Rutherfordovom modelu, elektron u atomu se neprekidno kretao s ubrzanjem, odnosno stalno je mijenjao svoje stanje; u skladu sa zahtjevima elektrodinamike, mora istovremeno zračiti energiju. U jednodimenzionalnom modelu atoma, stacionarno stanje karakterizira formiranje stojećeg de Broglieovog vala; sve dok talasna dužina ovog talasa ostaje konstantna, stanje elektrona ostaje nepromenjeno, tako da ne bi trebalo da dođe do zračenja.
Postaje jasno i pitanje stanja elektrona pri prelasku iz jednog stacionarnog stanja u drugo (Bohrovom terminologijom, iz jedne stacionarne orbite u drugu). Ako, na primjer, elektron iz stanja koje odgovara sl. 6, a, prelazi u stanje koje odgovara sl. 6b, tada će tokom ovog prelaza de Broljeva talasna dužina imati promenljivu vrednost koja ne ispunjava uslov za formiranje stojećeg talasa. Zbog toga će stanje elektrona u ovom vremenskom periodu biti nestabilno; mijenjat će se sve dok de Broglieova talasna dužina ponovo ne bude odgovarala uslovu za formiranje stojećeg talasa, odnosno dok elektron ne bude u novom stacionarnom stanju.
U pojednostavljenom jednodimenzionalnom modelu atoma, položaj elektrona u odnosu na jezgro je određen jednom koordinatom, a njegovo stanje vrijednošću jednog kvantnog broja. U dvodimenzionalnom (ravnom) modelu atoma, položaj elektrona je određen sa dvije koordinate; u skladu s tim, njegovo stanje karakteriziraju vrijednosti dva kvantna broja. Slično, u trodimenzionalnom (volumetrijskom) modelu atoma, stanje elektrona je određeno vrijednostima tri kvantna broja. Konačno, proučavanje svojstava elektrona koji čine stvarne atome pokazalo je da elektron ima još jednu kvantizovanu fizičku karakteristiku (tzv. spin, vidi § 30), koja nije povezana sa prostornim položajem elektrona. Dakle, za potpuni opis stanja elektrona u stvarnom atomu, potrebno je navesti vrijednosti četiri kvantna broja.
28. Main kvantni broj. Dakle, u jednodimenzionalnom modelu atoma, energija elektrona može poprimiti samo određene vrijednosti, drugim riječima, kvantizira se. Energija elektrona u stvarnom atomu je takođe kvantizovana veličina. Moguća energetska stanja elektrona u atomu određena su vrijednošću glavnog kvantnog broja n, koji može poprimiti pozitivne cjelobrojne vrijednosti: 1, 2, ... itd. Elektron ima najnižu energiju pri n = 1 sa povećanjem n, energija elektrona raste. Stoga se stanje elektrona, koje karakteriše određena vrijednost glavnog kvantnog broja, obično naziva energetskim nivoom elektrona u atomu: pri n=1, elektron je na prvom energetskom nivou, na n=2 - na drugom itd.
Glavni kvantni broj također određuje veličinu elektronskog oblaka. Da bi se povećala veličina elektronskog oblaka, potrebno je njegov dio pomjeriti na veću udaljenost od jezgra. To je spriječeno silama elektrostatičkog privlačenja elektrona prema jezgru, za čije prevladavanje je potreban utrošak energije. Zbog toga velike veličine Elektronski oblak odgovara višoj energiji elektrona u atomu i, posljedično, većoj vrijednosti glavnog kvantnog broja n. Elektroni, koje karakteriše ista vrednost glavnog kvantnog broja, formiraju elektronske oblake približno iste veličine u atomu; Stoga se može govoriti o postojanju elektronskih slojeva u atomu ili elektronske ljuske koji odgovaraju određenim vrijednostima glavnog kvantnog broja.
Za energetske nivoe elektrona u atomu (tj. za elektronske slojeve ili ljuske) koji odgovaraju različitim vrijednostima n, prihvaćene su sljedeće slovne oznake.
Stanje elektrona u atomu karakteriziraju četiri kvantna broja. Glavni kvantni broj n određuje energiju elektrona u atomu i veličinu AO, tj. udaljenost elektrona od jezgra. Glavni kvantni broj n poprima vrijednosti cijelih brojeva 1, 2, 3, 4... Skup elektrona sa istom vrijednošću n naziva se energetski nivo. Elektroni prvog energetskog nivoa iz jezgra (n=1) imaju najmanju energiju; kako n raste, energija elektrona i njegova udaljenost od jezgra se povećavaju. Stanje atoma, kada su njegovi elektroni na takvim energetskim nivoima da je njihova ukupna energija minimalna, naziva se glavno ili nepobuđeno stanje. Stanja s višim energetskim vrijednostima nazivaju se pobuđena stanja. Nivoi energije su označeni slovima:
Numerička vrijednost n 1 2 3 4 5 6 7
Slovna oznaka K L M N O P Q
Broj energetskih nivoa u atomu u osnovnom stanju jednak je broju perioda u kojem se element nalazi.
Na istom energetskom nivou mogu postojati atomske orbitale različitih oblika, koje se međusobno razlikuju po energiji. Stoga se energetski nivoi dijele na podnivoe. Energija elektrona na podnivou i oblik atomske orbitale karakteriziraju se orbitalnim kvantnim brojem l. Značenje l zavisi od glavnog kvantnog broja: l uzima vrijednosti od 0 do (n–1), tj. 0, 1, 2, 3… (n–1). Unutar datog energetskog nivoa, skup elektrona karakteriziranih istom vrijednošću l, naziva se energetski podnivo. Podnivoi su označeni slovima:
Orbitalni kvantni broj l 0 1 2 3
Oznaka energetskog podnivoa s p d f
Dakle, kod l = 0, 1, 2, 3 elektroni se nalaze na s-, p-, d-, f-podnivou. Elektroni različitih podnivoa nazivaju se s-, p-, d-, f-elektroni. U ovom slučaju se govori i o stanjima s-, p-, d-, f-elektrona ili s-, p-, d-, f-atomskih orbitala.
18. Glavni kvantni broj.
Glavni kvantni broj je cijeli broj koji je definicija stanja elektrona na energetskom nivou. Energetski nivo je skup stacionarnih stanja elektrona u atomu sa bliskim vrijednostima energije. Glavni kvantni broj određuje udaljenost elektrona od jezgra i karakteriše energija elektrona koji zauzimaju ovaj nivo.
19. Orbitalni kvantni broj. Oblici elektronskih oblaka
Orbitalni kvantni broj- u kvantnoj fizici kvantni broj ℓ, koji određuje oblik raspodjele amplitude valne funkcije elektrona u atomu, odnosno oblik elektronskog oblaka. Određuje podnivo energetskog nivoa određenog glavnim (radijalnim) kvantnim brojem n i može uzeti vrijednosti
Je svojstvena vrijednost operater orbitalni moment elektrona, koji se razlikuje od ugaonog momenta elektrona j samo na operateru centrifuge s:
Razlika između orbitalnog kvantnog broja i kvantnog broja ukupnog momenta ne prelazi, u apsolutnoj vrijednosti, (spin elektrona). Azimutalni kvantni broj određuje orijentaciju elektronskog oblaka u prostoru.
Prema mehaničkom modelu oblik elektronskog oblaka atom je posljedica oblika jezgra atoma. Izvori sila koje međusobno vezuju atome su zone preklapanja elektronskih oblaka. Zone preklapanja su istovremeno dio elektronskih oblaka oba atoma u kontaktu. Što je više zona preklapanja, to je jača veza između atoma. Svaki elektron elektronskog oblaka na većem dijelu svoje putanje uglavnom stupa u interakciju s jednim od protona jezgra, čineći dio elektronskog oblaka - elektronski režanj. Ali u zonama preklapanja, elektroni se mogu kretati od jednog do drugog elektronskog režnja. Elektronske latice povezane s protonima završene nuklearne ljuske ne sudjeluju u međuatomskim vezama. Oni se spajaju u neprekidni elektronski oblak, čije su granice mnogo bliže centru jezgre nego krajevi izoliranih elektronskih latica. Iz tog razloga, kontinuirani elektronski oblak ne dopire do elektronskih oblaka susjednih atoma i nije sposoban stvoriti zone preklapanja s njima. Međuatomske veze mogu stvoriti samo izolirane elektronske latice. Protežu se daleko izvan čvrstih elektronskih oblaka i privlače ih slični elektronski režnjevi drugih atoma, stvarajući zone preklapanja. Privlačenje atoma se događa sve dok se ne postigne ravnoteža između gravidinamičkih sila privlačenja i sila elastičnosti elektronske ljuske. Iz ovoga slijedi da granice elektronskog oblaka atoma nisu kruto fiksirane i mogu se mijenjati s promjenom gustoće atoma. Shodno tome, veličina atoma se također može promijeniti. Pokušajmo konstruirati teoretski moguće konfiguracije zona preklapanja između elektronskih oblaka identičnih atomskih izomera pri maksimalnom pakovanju. Tako zalijepljeni atomi istog tipa sposobni su formirati jedan kristal - glomazni divovski molekul s periodičnom strukturom.






