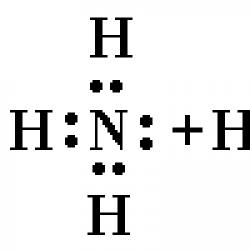Hidrojen tuzlarla reaksiyona girer mi? Hidrojen. Hidrojenin yapısı ve özellikleri. Metallerin ve metal olmayanların hidrojen bileşikleri. Elemanın elektronik yapısının özellikleri
MINSK TEKNOLOJİ VE HAFİF SANAYİ TASARIMI KOLEJİ
Makale
disiplin: Kimya
Konu: “Hidrojen ve bileşikleri”
Tarafından hazırlandı: 1. sınıf öğrencisi 343 grup
Viskup Elena
Kontrol: Alyabyeva N.V.
Minsk 2009
Periyodik tablodaki hidrojen atomunun yapısı
Oksidasyon durumları
Doğada yaygınlık
Basit bir madde olarak hidrojen
Hidrojen bileşikleri
Kaynakça
Periyodik tablodaki hidrojen atomunun yapısı
Periyodik tablonun ilk elementi (1. periyot, seri numarası 1). Diğer kimyasal elementlerle tam bir benzerliği yoktur ve herhangi bir gruba ait değildir, bu nedenle tablolarda şartlı olarak grup IA ve/veya grup VIIA'ya yerleştirilmiştir.
Hidrojen atomu, tüm elementlerin atomları arasında en küçük ve en hafif olanıdır. Atomun elektronik formülü 1s 1'dir. Bir elementin serbest haldeki olağan varoluş şekli, iki atomlu bir moleküldür.
Oksidasyon durumları
Daha elektronegatif elementlere sahip bileşiklerdeki hidrojen atomu, örneğin HF, H2O, vb. gibi +1 oksidasyon durumu sergiler. Ve metal hidritli bileşiklerde, hidrojen atomunun oksidasyon durumu -1'dir, örneğin NaH, CaH 2, vb. Tipik metaller ve metal olmayanlar arasında orta düzeyde bir elektronegatiflik değerine sahiptir. Asetik asit veya alkol gibi organik çözücülerdeki birçok organik bileşiği katalitik olarak indirgeme yeteneğine sahiptir: doymamış bileşikleri doymuş olanlara, bazı sodyum bileşiklerini amonyak veya aminlere.
Doğada yaygınlık
Doğal hidrojen iki kararlı izotoptan oluşur - protium 1 H, döteryum 2 H ve trityum 3 H. Döteryum aksi takdirde D olarak ve trityum T olarak adlandırılır. Çeşitli kombinasyonlar mümkündür, örneğin NT, HD, TD, H 2, D 2 , T2. Hidrojen doğada kükürt (H2S), oksijen (su formunda), karbon, nitrojen ve klor ile çeşitli bileşikler formunda daha yaygındır. Daha az sıklıkla fosfor, iyot, brom ve diğer elementleri içeren bileşikler şeklinde. Tüm bitki ve hayvan organizmalarının, petrolün, fosil kömürlerin, doğal gazın, bir takım minerallerin ve kayaların bir parçasıdır. Serbest durumda, çok nadiren küçük miktarlarda bulunur - volkanik gazlarda ve organik kalıntıların ayrışma ürünlerinde. Hidrojen evrende en çok bulunan elementtir (yaklaşık %75). Güneş'in ve çoğu yıldızın yanı sıra esas olarak hidrojenden oluşan Jüpiter ve Satürn gezegenlerinin bir bileşenidir. Bazı gezegenlerde hidrojen katı halde bulunabilir.
Basit bir madde olarak hidrojen
Bir hidrojen molekülü, kovalent polar olmayan bir bağla bağlanan iki atomdan oluşur. Fiziki ozellikleri- renksiz ve kokusuz gaz. Uzayda diğer gazlardan daha hızlı yayılır, küçük gözeneklerden geçer ve yüksek sıcaklıklarda çeliğe ve diğer malzemelere nispeten kolaylıkla nüfuz eder. Yüksek ısı iletkenliğine sahiptir.
Kimyasal özellikler. Düşük sıcaklıklarda normal durumunda aktif değildir; ısıtmadan (ışık varlığında) flor ve klor ile reaksiyona girer.
H 2 + F 2 2HF H 2 +Cl 2 hv 2HClMetal olmayanlarla metallere göre daha aktif etkileşime girer.
Çeşitli maddelerle etkileşime girdiğinde hem oksitleyici hem de indirgeyici özellikler sergileyebilir.
Hidrojen bileşikleri
Hidrojen bileşiklerinden biri halojenlerdir. Hidrojen Grup VIIA elementleriyle birleştiğinde oluşurlar. HF, HCl, HBr ve HI renksiz gazlardır ve suda oldukça çözünürler.
Cl2 + H2OHCIO + HC1; HClO-klorlu suHBr ve HI tipik indirgeyici ajanlar olduğundan HCl gibi bir değişim reaksiyonuyla elde edilemezler.
CaF2 + H2S04 = CaS04 + 2HF
Su, doğadaki en yaygın hidrojen bileşiğidir.
2H2 + Ö2 = 2H2Ö
Rengi yok, tadı yok, kokusu yok. Çok zayıf bir elektrolit, ancak birçok metal ve metal olmayan, bazik ve asidik oksitlerle aktif olarak reaksiyona girer.
2H20 + 2Na = 2NaOH + H2
H 2 O + BaO = Ba(OH) 2
3H 2 Ö + P 2 Ö 5 = 2H 3 PO 4
Ağır su (D 2 O), izotopik bir su çeşididir. Ağır sudaki maddelerin çözünürlüğü normal suya göre çok daha azdır. Ağır su zehirlidir çünkü canlı organizmalardaki biyolojik süreçleri yavaşlatır. Suyun tekrarlanan elektrolizi sırasında elektroliz kalıntısında birikir. Nükleer reaktörlerde soğutucu ve nötron moderatörü olarak kullanılır.
Hidritler, hidrojenin metallerle (yüksek sıcaklıklarda) veya hidrojenden daha az elektronegatif olan metal olmayanlarla etkileşimidir.
Si + 2H2 = SiH4
Hidrojenin kendisi 16. yüzyılın ilk yarısında keşfedildi. Paracelsus. İlk olarak 1776 yılında G. Cavendish özelliklerini araştırmış, 1783-1787 yıllarında ise A. Lavoisier hidrojenin suyun bir parçası olduğunu göstermiş, onu kimyasal elementler listesine dahil etmiş ve “hidrojen” adını önermiştir.
Kaynakça
1. M.B. Volovich, O.F. Kabardin, R.A. Lidin, L.Yu. Alikberova, V.S. Rokhlov, V.B. Pyatunin, Yu.A. Simagin, S.V. Simonovich/Schoolchildren’s Handbook/Moskova “AST-PRESS BOOK” 2003.
2.I.L. Knunyats / Kimya Ansiklopedisi / Moskova “Sovyet Ansiklopedisi” 1988
3. I.E. Shimanovich / Kimya 11 / Minsk “Halkın Asveta'sı” 2008
4. F. Cotton, J. Wilkinson / Modern inorganik kimya / Moskova “Mir” 1969
Hidrojen H, evrenimizde en yaygın olanlardan biri olan kimyasal bir elementtir. Maddelerin bileşimindeki bir element olarak hidrojenin kütlesi, diğer türdeki atomların toplam içeriğinin% 75'idir. Gezegendeki en önemli ve hayati bileşiğin bir parçasıdır - su. Hidrojenin ayırt edici bir özelliği de D.I. Mendeleev'in periyodik kimyasal elementler sistemindeki ilk element olmasıdır.
Keşif ve keşif
Paracelsus'un yazılarında hidrojenden ilk kez bahsedilmesi on altıncı yüzyıla kadar uzanıyor. Ancak havanın gaz karışımından izolasyonu ve yanıcı özelliklerin incelenmesi on yedinci yüzyılda bilim adamı Lemery tarafından gerçekleştirildi. Hidrojen, hidrojen kütlesinin diğer gazlarla karşılaştırıldığında en küçük olduğunu deneysel olarak kanıtlayan bir İngiliz kimyager, fizikçi ve doğa bilimci tarafından kapsamlı bir şekilde incelenmiştir. Bilimin gelişiminin sonraki aşamalarında birçok bilim adamı, özellikle de onu "suyun doğuşu" olarak adlandıran Lavoisier ile çalıştı.
PSHE'deki pozisyona göre özellikler
D.I. Mendeleev'in periyodik tablosunu açan element hidrojendir. Atomun fiziksel ve kimyasal özellikleri belirli bir ikilik gösterir, çünkü hidrojen aynı anda birinci gruba, ana alt gruba ait olarak sınıflandırılır, eğer bir metal gibi davranıyorsa ve kimyasal reaksiyon sürecinde tek bir elektronu verirse ve yedinciye - değerlik kabuğunun tamamen doldurulması durumunda, yani onu halojenlere benzer şekilde karakterize eden negatif parçacığın kabulü.

Elemanın elektronik yapısının özellikleri
İçerdiği karmaşık maddelerin ve en basit madde olan H2'nin özellikleri öncelikle hidrojenin elektronik konfigürasyonu tarafından belirlenir. Parçacık, birim kütleli bir proton ve pozitif yük (+1) içeren bir çekirdeğin etrafında yörüngesinde dönen Z= (-1) değerinde bir elektrona sahiptir. Elektronik konfigürasyonu 1s 1 olarak yazılmıştır; bu, hidrojenin ilk ve tek s-orbitalinde bir negatif parçacığın varlığı anlamına gelir.
Bir elektron çıkarıldığında veya verildiğinde ve bu elementin bir atomu metallerle akraba olacak bir özelliğe sahip olduğunda bir katyon elde edilir. Aslında hidrojen iyonu pozitif bir temel parçacıktır. Bu nedenle elektrondan yoksun hidrojene basitçe proton denir.

Fiziki ozellikleri
Hidrojeni kısaca tanımlamak gerekirse, renksiz, az çözünen, bağıl atom kütlesi 2 olan, havadan 14,5 kat daha hafif, sıvılaşma sıcaklığı -252,8 santigrat derece olan bir gazdır.
Deneyimlerinize dayanarak H2'nin en hafif olduğunu kolayca doğrulayabilirsiniz. Bunu yapmak için, üç topu çeşitli maddelerle (hidrojen, karbondioksit, sıradan hava) doldurmanız ve aynı anda elinizden bırakmanız yeterlidir. CO 2 ile dolu olan yere en hızlı ulaşacak, ardından hava karışımıyla şişirilen aşağıya inecek, H 2 içeren ise tavana yükselecektir.
Hidrojen parçacıklarının küçük kütlesi ve boyutu, çeşitli maddelere nüfuz etme yeteneğini haklı çıkarır. Aynı top örneğini kullanarak bunu doğrulamak kolaydır; gaz kauçuğun içinden geçeceğinden birkaç gün sonra kendi kendine sönecektir. Hidrojen ayrıca bazı metallerin (paladyum veya platin) yapısında da birikebilir ve sıcaklık yükseldiğinde buharlaşabilir.
Hidrojenin düşük çözünürlük özelliği, laboratuvar uygulamalarında, uygulama kapsamını ve üretim yöntemlerini belirlemek için hidrojenin yerini alarak (aşağıda gösterilen tablo ana parametreleri içerir) onu izole etmek için kullanılır.
| Basit bir maddenin atomunun veya molekülünün parametresi | Anlam |
| Atom kütlesi (molar kütle) | 1.008 gr/mol |
| Elektronik konfigürasyon | 1s 1 |
| Kristal hücre | Altıgen |
| Termal iletkenlik | (300 K) 0,1815 W/(m·K) |
| N'de yoğunluk. sen. | 0,08987 gr/l |
| Kaynama sıcaklığı | -252,76 °C |
| Özgül yanma ısısı | 120,9 10 6 J/kg |
| Erime sıcaklığı | -259,2 °C |
| sudaki çözünürlük | 18,8 ml/l |
İzotopik bileşim
Periyodik kimyasal elementler sisteminin diğer birçok temsilcisi gibi, hidrojenin de birkaç doğal izotopu vardır, yani çekirdekte aynı sayıda protona sahip atomlar, ancak farklı sayıda nötron - sıfır yüke ve birim kütleye sahip parçacıklar. Benzer özelliğe sahip atomların örnekleri oksijen, karbon, klor, brom ve radyoaktif olanlar dahil diğerleridir.
Bu grubun temsilcileri arasında en yaygın olanı olan hidrojen 1H'nin fiziksel özellikleri, benzerlerinin aynı özelliklerinden önemli ölçüde farklıdır. Özellikle içerdikleri maddelerin özellikleri farklılık göstermektedir. Bu nedenle, tek protonlu bir hidrojen atomu yerine döteryum 2 H - iki temel parçacık içeren izotopu içeren sıradan ve döteryumlu su vardır: pozitif ve yüksüz. Bu izotop sıradan hidrojenden iki kat daha ağırdır ve bu da oluşturdukları bileşiklerin özelliklerindeki dramatik farkı açıklar. Doğada döteryum hidrojenden 3200 kat daha az bulunur. Üçüncü temsilci trityum 3H'dir; çekirdeğinde iki nötron ve bir proton vardır.

Üretim ve izolasyon yöntemleri
Laboratuvar ve endüstriyel yöntemler oldukça farklıdır. Bu nedenle gaz, esas olarak mineral maddeleri içeren reaksiyonlar yoluyla küçük miktarlarda üretilirken, büyük ölçekli üretimde daha büyük ölçüde organik sentez kullanılır.
Laboratuvarda aşağıdaki kimyasal etkileşimler kullanılmaktadır:

Endüstriyel amaçlar için gaz aşağıdaki yöntemlerle üretilir:
- Metanın, bir katalizör varlığında, kendisini oluşturan basit maddelere (sıcaklık gibi bir göstergenin değeri 350 dereceye ulaşır) - hidrojen H2 ve karbon C'ye termal ayrışması.
- Karbon dioksit CO2 ve H2 oluşturmak için buharlı suyun 1000 santigrat derecede koktan geçirilmesi (en yaygın yöntem).
- Metan gazının 800 dereceye ulaşan sıcaklıklarda nikel katalizör üzerinde dönüşümü.
- Hidrojen, potasyum veya sodyum klorürlerin sulu çözeltilerinin elektrolizinden elde edilen bir yan üründür.
Kimyasal etkileşimler: genel hükümler
Hidrojenin fiziksel özellikleri, belirli bir bileşikle reaksiyon süreçlerindeki davranışını büyük ölçüde açıklamaktadır. Periyodik tabloda birinci grupta yer aldığından hidrojenin değerliği 1'dir ve oksidasyon derecesi farklılık gösterir. Hidriditler hariç tüm bileşiklerde, do.o. = (1+) cinsinden hidrojen, CN, CN2, CN3 - (1-) tipi moleküllerde.
Genelleştirilmiş bir elektron çifti oluşturularak oluşturulan hidrojen gazı molekülü iki atomdan oluşur ve enerji açısından oldukça kararlıdır, bu nedenle normal koşullar altında bir miktar inerttir ve normal koşullar değiştiğinde tepki verir. Diğer maddelerin bileşimindeki hidrojenin oksidasyon derecesine bağlı olarak hem oksitleyici madde hem de indirgeyici madde olarak işlev görebilir.

Hidrojenin reaksiyona girip oluşturduğu maddeler
Karmaşık maddeler oluşturmak için elementel etkileşimler (genellikle yüksek sıcaklıklarda):
- Alkali ve alkalin toprak metali + hidrojen = hidrit.
- Halojen + H2 = hidrojen halojenür.
- Kükürt + hidrojen = hidrojen sülfür.
- Oksijen + H2 = su.
- Karbon + hidrojen = metan.
- Azot + H2 = amonyak.
Karmaşık maddelerle etkileşim:
- Karbon monoksit ve hidrojenden sentez gazı üretimi.
- H2 kullanılarak metallerin oksitlerinden indirgenmesi.
- Doymamış alifatik hidrokarbonların hidrojenle doyması.
Hidrojen bağı
Hidrojenin fiziksel özellikleri, elektronegatif bir elementle birleştiğinde, yalnız elektron çiftlerine sahip komşu moleküllerden (örneğin oksijen, nitrojen ve flor) aynı atomla özel bir tür bağ oluşturmasına izin verecek şekildedir. Bu fenomeni dikkate almanın daha iyi olduğu en açık örnek sudur. Kovalent veya iyonik olanlardan daha zayıf olan hidrojen bağlarıyla dikildiği söylenebilir ancak bunların çok sayıda olması nedeniyle maddenin özellikleri üzerinde önemli bir etkisi vardır. Esasen hidrojen bağı, su moleküllerini dimerlere ve polimerlere bağlayan ve yüksek kaynama noktasına yol açan elektrostatik bir etkileşimdir.
Mineral bileşiklerinde hidrojen
Hepsi bir proton, hidrojen gibi bir atomun katyonu içerir. Asidik kalıntısı (-1)'den büyük bir oksidasyon durumuna sahip olan bir maddeye polibazik bileşik denir. Sulu çözeltilerde çok aşamalı ayrışmayı sağlayan birkaç hidrojen atomu içerir. Sonraki her protonun asit kalıntısından uzaklaştırılması giderek daha zor hale gelir. Ortamın asitliği, ortamdaki hidrojenin niceliksel içeriğine göre belirlenir.

İnsan faaliyetlerinde uygulama
Madde içeren silindirlerin yanı sıra oksijen gibi diğer sıvılaştırılmış gazların bulunduğu kaplar da belirli bir görünüme sahiptir. Koyu yeşil renkte ve parlak kırmızıyla yazılmış "Hidrojen" kelimesiyle boyanmıştır. Gaz, yaklaşık 150 atmosfer basınç altında bir silindire pompalanır. Hidrojenin fiziksel özellikleri, özellikle de gaz halindeki toplanma durumunun hafifliği, helyumla karıştırılmış balonları, balonları vb. doldurmak için kullanılır.
İnsanların fiziksel ve kimyasal özelliklerini yıllar önce kullanmayı öğrendiği hidrojen, günümüzde birçok endüstride kullanılmaktadır. Büyük kısmı amonyak üretimine gidiyor. Hidrojen aynı zamanda (hafniyum, germanyum, galyum, silikon, molibden, tungsten, zirkonyum ve diğerleri) oksitlere de katılır ve reaksiyonda indirgeyici bir madde, hidrosiyanik ve hidroklorik asitlerin yanı sıra yapay sıvı yakıt olarak görev yapar. Gıda endüstrisi bunu bitkisel yağları katı yağlara dönüştürmek için kullanır.
Hidrojenin kimyasal özellikleri ve katı yağların, kömürlerin, hidrokarbonların, sıvı yağların ve akaryakıtın çeşitli hidrojenasyon ve hidrojenasyon proseslerinde kullanımı belirlendi. Değerli taşlar, akkor lambalar üretmek ve oksijen-hidrojen alevinin etkisi altında metal ürünleri dövmek ve kaynaklamak için kullanılır.
Basit maddelerin üretimine yönelik endüstriyel yöntemler, karşılık gelen elementin doğada bulunduğu forma, yani üretimi için hammaddenin ne olabileceğine bağlıdır. Böylece serbest halde bulunan oksijen, fiziksel olarak sıvı havadan ayrıştırılarak elde edilir. Hidrojenin neredeyse tamamı bileşik halinde olduğundan elde edilmesi için kimyasal yöntemler kullanılır. Özellikle ayrışma reaksiyonları kullanılabilir. Hidrojen üretmenin bir yolu, suyun elektrik akımıyla ayrıştırılmasıdır.
Hidrojen üretiminin ana endüstriyel yöntemi, doğal gazın bir parçası olan metanın suyla reaksiyonudur. Yüksek sıcaklıkta gerçekleştirilir (metan kaynar sudan geçirildiğinde bile herhangi bir reaksiyonun oluşmadığını doğrulamak kolaydır):
CH4 + 2H20 = CO2 + 4H2 - 165 kJ
Laboratuvarda basit maddeler elde etmek için mutlaka doğal hammaddeler kullanılmaz, ancak gerekli maddeyi izole etmenin daha kolay olduğu başlangıç materyalleri seçilir. Örneğin laboratuvarda havadan oksijen elde edilmez. Aynı durum hidrojen üretimi için de geçerlidir. Bazen endüstride kullanılan hidrojen üretimine yönelik laboratuvar yöntemlerinden biri, suyun elektrik akımıyla ayrıştırılmasıdır.
Tipik olarak hidrojen, çinkonun hidroklorik asitle reaksiyona sokulmasıyla laboratuvarda üretilir.
Endüstride
1.Sulu tuz çözeltilerinin elektrolizi:
2NaCl + 2H20 → H2 + 2NaOH + Cl2
2.Sıcak kok üzerinden su buharının geçmesi 1000°C civarındaki sıcaklıklarda:
H 2 Ö + C ⇄ H 2 + CO
3.Doğal gazdan.
Buhar dönüşümü: CH 4 + H 2 O ⇄ CO + 3H 2 (1000 °C) Oksijenle katalitik oksidasyon: 2CH 4 + O 2 ⇄ 2CO + 4H 2
4. Petrol rafinasyonu sırasında hidrokarbonların kırılması ve yeniden şekillendirilmesi.
Laboratuvarda
1.Seyreltik asitlerin metaller üzerindeki etkisi. Bu reaksiyonu gerçekleştirmek için çoğunlukla çinko ve hidroklorik asit kullanılır:
Zn + 2HCl → ZnCl2 + H2
2.Kalsiyumun su ile etkileşimi:
Ca + 2H20 → Ca(OH)2 + H2
3.Hidridlerin hidrolizi:
NaH + H20 → NaOH + H2
4.Alkalilerin çinko veya alüminyum üzerindeki etkisi:
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2 Zn + 2KOH + 2H 2 O → K 2 + H 2
5.Elektroliz kullanma. Alkalilerin veya asitlerin sulu çözeltilerinin elektrolizi sırasında katotta hidrojen açığa çıkar, örneğin:
2H 3 Ö + + 2e - → H 2 + 2H 2 Ö
- Hidrojen üretimi için biyoreaktör
Fiziki ozellikleri
Hidrojen gazı orto ve para-hidrojen şeklinde iki formda (modifikasyonlarda) mevcut olabilir.
Bir ortohidrojen molekülünde (en. -259.10 °C, kaynama noktası -252.56 °C) nükleer dönüşler aynı şekilde (paralel) yönlendirilir ve parahidrojende (en. -259.32 °C, kaynama noktası -252.89 °C) - birbirine zıt (antiparalel).
Hidrojenin allotropik formları, sıvı nitrojen sıcaklığında aktif karbon üzerinde adsorpsiyonla ayrılabilir. Çok düşük sıcaklıklarda ortohidrojen ve parahidrojen arasındaki denge neredeyse tamamen parahidrojene doğru kayar. 80 K'de formların oranı yaklaşık 1:1'dir. Isıtıldığında desorbe edilen parahidrojen, oda sıcaklığında dengede olan bir karışım oluşana kadar ortohidrojene dönüştürülür (orto-para: 75:25). Katalizör olmadan dönüşüm yavaş gerçekleşir ve bu da bireysel allotropik formların özelliklerinin incelenmesini mümkün kılar. Hidrojen molekülü diatomiktir - H₂. Normal şartlarda renksiz, kokusuz ve tatsız bir gazdır. Hidrojen en hafif gazdır, yoğunluğu havanın yoğunluğundan kat kat azdır. Açıkçası, moleküllerin kütlesi ne kadar küçükse, aynı sıcaklıkta hızları da o kadar yüksek olur. En hafif moleküller olan hidrojen molekülleri, diğer gazların moleküllerinden daha hızlı hareket eder ve böylece ısıyı bir cisimden diğerine daha hızlı aktarabilir. Buradan hidrojenin gaz halindeki maddeler arasında en yüksek termal iletkenliğe sahip olduğu sonucu çıkar. Isıl iletkenliği havanın ısıl iletkenliğinden yaklaşık yedi kat daha yüksektir.
Kimyasal özellikler
Hidrojen molekülleri H₂ oldukça güçlüdür ve hidrojenin reaksiyona girmesi için çok fazla enerji harcanması gerekir: H2 = 2H - 432 kJ Bu nedenle, normal sıcaklıklarda hidrojen yalnızca çok aktif metallerle, örneğin kalsiyumla reaksiyona girerek kalsiyum oluşturur hidrit: Ca + H2 = CaH2 ve hidrojen florür oluşturan tek metal olmayan florür ile: F2 + H2 = 2HF Çoğu metal ve metal olmayan ile hidrojen, örneğin yüksek sıcaklıklarda veya diğer etkiler altında reaksiyona girer. , aydınlatma. Bazı oksitlerden oksijeni “çıkarabilir”, örneğin: CuO + H 2 = Cu + H 2 0 Yazılı denklem indirgeme reaksiyonunu yansıtır. İndirgeme reaksiyonları, bir bileşikten oksijenin uzaklaştırıldığı işlemlerdir; Oksijeni uzaklaştıran maddelere indirgeyici maddeler denir (kendileri oksitlenir). Ayrıca “yükseltgenme” ve “indirgenme” kavramlarının başka bir tanımı verilecektir. Ve tarihsel olarak ilk olan bu tanım günümüzde de özellikle organik kimyada önemini korumaktadır. İndirgeme reaksiyonu oksidasyon reaksiyonunun tersidir. Bu reaksiyonların her ikisi de her zaman aynı anda tek bir işlem olarak gerçekleşir: Bir madde oksitlendiğinde (indirgendiğinde), diğerinin indirgenmesi (oksidasyonu) zorunlu olarak aynı anda gerçekleşir.
N 2 + 3H 2 → 2 NH 3
Halojenli formlar hidrojen halojenürler:
F2 + H2 → 2 HF, reaksiyon karanlıkta ve herhangi bir sıcaklıkta patlayıcı bir şekilde meydana gelir, Cl2 + H2 → 2 HCl, reaksiyon yalnızca ışıkta patlayıcı bir şekilde gerçekleşir.
Yüksek ısı altında kurumla etkileşime girer:
C + 2H 2 → CH 4
Alkali ve alkalin toprak metallerle etkileşim
Aktif metallerle hidrojen formları hidritler:
Na + H 2 → 2 NaH Ca + H 2 → CaH 2 Mg + H 2 → MgH 2
Hidritler- kolayca hidrolize edilen tuz benzeri katı maddeler:
CaH2 + 2H20 → Ca(OH)2 + 2H2
Metal oksitlerle etkileşim (genellikle d-elementler)
Oksitler metallere indirgenir:
CuO + H 2 → Cu + H 2 O Fe 2 O 3 + 3H 2 → 2 Fe + 3H 2 O WO 3 + 3H 2 → W + 3H 2 O
Organik bileşiklerin hidrojenasyonu
Hidrojen, nikel katalizörü varlığında ve yüksek sıcaklıklarda doymamış hidrokarbonlara etki ettiğinde bir reaksiyon meydana gelir. hidrojenasyon:
CH2 =CH2 + H2 → CH3-CH3
Hidrojen aldehitleri alkollere indirger:
CH3CHO + H2 → C2H5OH.
Hidrojenin jeokimyası
Hidrojen evrenin ana yapı malzemesidir. En yaygın elementtir ve termonükleer ve nükleer reaksiyonlar sonucunda tüm elementler ondan oluşur.
Serbest hidrojen H2, karasal gazlarda nispeten nadir bulunur, ancak su formunda jeokimyasal süreçlerde son derece önemli bir rol alır.
Hidrojen minerallerde amonyum iyonu, hidroksil iyonu ve kristal su formunda bulunabilir.
Atmosferde suyun güneş ışınımıyla ayrışması sonucu sürekli olarak hidrojen üretilir. Üst atmosfere göç eder ve uzaya kaçar.
Başvuru
- Hidrojen enerjisi
Atomik hidrojen, atomik hidrojen kaynağı için kullanılır.
Gıda endüstrisinde hidrojen, gıda katkı maddesi olarak kayıtlıdır E949 ambalaj gazı gibi.
Tedavinin özellikleri
Hidrojen, havayla karıştırıldığında patlayıcı bir karışım oluşturur; buna patlayıcı gaz denir. Bu gaz, hidrojen ve oksijenin hacim oranı 2:1 olduğunda veya hava yaklaşık %21 oksijen içerdiğinden hidrojen ve hava yaklaşık 2:5 olduğunda en patlayıcıdır. Hidrojen aynı zamanda bir yangın tehlikesidir. Sıvı hidrojen ciltle temas ederse ciddi donmalara neden olabilir.
Hidrojen ve oksijenin patlayıcı konsantrasyonları hacimce %4 ila %96 arasında meydana gelir. Hava ile karıştırıldığında hacimce %4'ten %75(74)'e kadar.
Hidrojen kullanımı
Kimya endüstrisinde amonyak, sabun ve plastik üretiminde hidrojen kullanılmaktadır. Gıda endüstrisinde margarin, hidrojen kullanılarak sıvı bitkisel yağlardan yapılır. Hidrojen çok hafiftir ve daima havada yükselir. Bir zamanlar hava gemileri ve balonlar hidrojenle dolduruluyordu. Ama 30'lu yıllarda. XX yüzyıl Hava gemileri patlayıp yandığında birçok korkunç felaket meydana geldi. Günümüzde hava gemileri helyum gazı ile doldurulmaktadır. Hidrojen aynı zamanda roket yakıtı olarak da kullanılıyor. Bir gün hidrojen, otomobiller ve kamyonlar için yakıt olarak yaygın şekilde kullanılabilir. Hidrojen motorları çevreyi kirletmez ve yalnızca su buharı yayar (her ne kadar hidrojen üretiminin kendisi bir miktar çevre kirliliğine yol açsa da). Güneşimiz çoğunlukla hidrojenden oluşur. Güneş ısısı ve ışığı, hidrojen çekirdeklerinin füzyonundan nükleer enerjinin açığa çıkmasının sonucudur.
Hidrojenin yakıt olarak kullanılması (uygun maliyetli)
Yakıt olarak kullanılan maddelerin en önemli özelliği yanma ısılarıdır. Genel kimyanın seyrinden, hidrojen ve oksijen arasındaki reaksiyonun ısı salınımıyla meydana geldiği bilinmektedir. Standart koşullar altında 1 mol H2 (2 g) ve 0,5 mol O2 (16 g) alırsak ve reaksiyonu uyarırsak, o zaman denkleme göre
H 2 + 0,5 Ö 2 = H 2 Ö
Reaksiyonun tamamlanmasından sonra, 285,8 kJ/mol enerji açığa çıkarak 1 mol H20 (18 g) oluşur (karşılaştırma için: asetilenin yanma ısısı 1300 kJ/mol, propan - 2200 kJ/mol) . 1 m³ hidrojenin ağırlığı 89,8 g'dır (44,9 mol). Dolayısıyla 1 m³ hidrojen üretmek için 12832,4 kJ enerji harcanacaktır. 1 kWh = 3600 kJ olduğu gerçeğini dikkate alırsak 3,56 kWh elektrik elde ederiz. 1 kWh elektrik tarifesini ve 1 m³ gaz maliyetini bildiğimizden, hidrojen yakıtına geçmenin tavsiye edilebilir olduğu sonucuna varabiliriz.
Örneğin 156 litrelik hidrojen tankına (25 MPa basınç altında 3,12 kg hidrojen içerir) sahip 3. nesil Honda FCX deney modeli 355 km yol kat etmektedir. Buna göre 3,12 kg H2'den 123,8 kWh elde edilir. 100 km'de enerji tüketimi 36,97 kWh olacaktır. Elektriğin maliyetini, gaz veya benzinin maliyetini ve bir araba için 100 km başına tüketimini bilerek, arabaları hidrojen yakıtına geçirmenin olumsuz ekonomik etkisini hesaplamak kolaydır. Diyelim ki (Rusya 2008), kWh başına 10 sent elektrik, 1 m³ hidrojenin 35,6 sentlik bir fiyata yol açtığını ve 40-45 sentlik su ayrıştırma verimliliği dikkate alındığında aynı miktarda kWh'nin ortaya çıktığını varsayalım. benzin yakmanın maliyeti perakende satış fiyatında 12832,4 kJ/42000 kJ/0,7 kg/l*80 cent/l=34 cent iken, hidrojen için nakliye, ekipman amortismanı vb.'yi hesaba katmadan ideal seçeneği hesapladık. Metan için m³ başına yaklaşık 39 MJ'lik yanma enerjisi, fiyat farkından dolayı sonuç iki ila dört kat daha düşük olacaktır (1 m³'ün Ukrayna için maliyeti 179 $ ve Avrupa için 350 $'dır). Yani eşdeğer miktarda metan 10-20 sente mal olacak.
Ancak hidrojeni yaktığımızda, çıkarıldığı temiz suyu elde ettiğimizi unutmamalıyız. Yani yenilenebilir bir kaynağımız var. stokçu Birincil enerji kaynakları olan gaz veya benzinin aksine çevreye zarar vermeyen enerji.
Php on line 377 Uyarı: require(http://www..php): akışı açamadı: 377 numaralı satırda /hsphere/local/home/winexins/site/tab/vodorod.php dosyasında uygun sarmalayıcı bulunamadı error: require(): "http://www..php" gerekli açılması başarısız oldu (include_path = "..php, 377. satırda)
Ders 29
Hidrojen. su
Dersin özeti:
Su. Kimyasal ve fiziksel özellikler
Hidrojen ve suyun doğadaki rolü
Kimyasal element olarak hidrojen
Hidrojen, D.I. Mendeleev'in periyodik tablosunun yeri belirsiz olan tek elementidir. Kimyasal sembolü periyodik tabloda iki kez yazılır: hem IA hem de VIIA gruplarında. Bu, hidrojenin kendisini hem alkali metaller hem de halojenlerle birleştiren bir takım özelliklere sahip olmasıyla açıklanmaktadır (Tablo 14).
Tablo 14
Hidrojenin özelliklerinin alkali metaller ve halojenlerin özellikleriyle karşılaştırılması
| Alkali metallerle benzerlikler | Halojenlere benzerlik |
| Dış enerji seviyesinde hidrojen atomları bir elektron içerir. Hidrojen bir s elementidir | Dış ve tek seviye tamamlanmadan önce, halojen atomları gibi hidrojen atomları da bir elektrondan yoksundur. |
| Hidrojen indirgeyici özellikler sergiler. Oksidasyonun bir sonucu olarak hidrojen, +1 bileşiklerinde en sık bulunan oksidasyon durumunu alır. | Alkali ve alkalin toprak metalleri içeren bileşiklerde halojenler gibi hidrojenin oksidasyon durumu -1'dir, bu da onun oksitleyici özelliklerini doğrular. |
| Uzayda metal kristal kafesli katı hidrojenin var olduğu varsayılmaktadır. | Flor ve klor gibi hidrojen de normal koşullar altında bir gazdır. Halojen molekülleri gibi molekülleri diatomiktir ve kovalent polar olmayan bir bağ yoluyla oluşur. |
Doğada hidrojen, kütle numaraları 1, 2 ve 3 olan üç izotop formunda bulunur: protium 1 1 H, döteryum 2 1 D ve trityum 3 1 T. İlk ikisi kararlı izotoplardır ve üçüncüsü radyoaktiftir. Protium izotopların doğal karışımında baskındır. H:D:T izotopları arasındaki niceliksel oranlar 1: 1,46 10 -5: 4,00 10 -15'tir.
Hidrojen izotoplarının bileşikleri özellik bakımından birbirinden farklıdır. Örneğin, hafif protium suyunun (H 2 O) kaynama ve donma noktaları sırasıyla - 100 o C ve 0 o C'ye ve döteryum suyunun (D 2 O) - 101,4 o C ve 3,8 o C'ye eşittir. Reaksiyon hızı şunları içerir: hafif su, ağır sudan daha yüksektir.
Evrende hidrojen en yaygın elementtir; Evrenin kütlesinin yaklaşık %75'ini veya tüm atomlarının %90'ından fazlasını oluşturur. Hidrojen, Dünya'nın en önemli jeolojik kabuğu olan hidrosferdeki suyun bir parçasıdır.
Hidrojen, karbonla birlikte tüm organik maddeleri oluşturur, yani Dünya'nın canlı kabuğunun - biyosferin bir parçasıdır. Yer kabuğunda - litosferde - hidrojenin kütle içeriği yalnızca %0,88'dir, yani. tüm elementler arasında 9. sırada yer alır. Dünyanın hava kabuğu - atmosfer, moleküler hidrojenin payı olan toplam hacmin milyonda birinden daha azını içerir. Sadece atmosferin üst kısmında bulunur.
Hidrojen üretimi ve kullanımı
Hidrojen ilk olarak 16. yüzyılda ortaçağ doktoru ve simyacı Paracelsus tarafından bir demir plakanın sülfürik asit içine daldırılmasıyla elde edildi ve 1766'da İngiliz kimyager Henry Cavendish, hidrojenin yalnızca demirin sülfürik asitle etkileşimi yoluyla üretilmediğini kanıtladı. aynı zamanda diğer asitlerle birlikte diğer metaller. Cavendish ayrıca ilk kez hidrojenin özelliklerini tanımladı.
İÇİNDE laboratuvar koşullar altında hidrojen elde edilir:
1. Metallerin asitle etkileşimi:
Zn + 2HCl → ZnCl2 + H2
2. Alkali ve toprak alkali metallerin su ile etkileşimi
2Na + 2H20 → 2NaOH + H2
Ca + 2H20 → Ca(OH)2 + H2
İÇİNDE endüstri Hidrojen aşağıdaki yollarla elde edilir:
1. Tuzların, asitlerin ve alkalilerin sulu çözeltilerinin elektrolizi. En sık kullanılan çözüm sofra tuzudur:
2NaCl + 2H20 →el. akım H 2 + Cl 2 + NaOH
2. Sıcak kok ile su buharının azaltılması:
C + H2O → tCO + H2
Ortaya çıkan karbon monoksit ve hidrojen karışımına denir. su gazı (sentez gazı), ve çeşitli kimyasal ürünlerin (amonyak, metanol vb.) sentezinde yaygın olarak kullanılır. Hidrojeni su gazından ayırmak için karbon monoksit, su buharı ile ısıtıldığında karbondioksite dönüştürülür:
CO + H2 → tCO2 + H2
3. Metanın ısıtılması su buharı ve oksijen varlığında. Bu yöntem şu anda ana yöntemdir:
2CH4 + Ö2 + 2H2Ö → t2CO2 + 6H2
Hidrojen yaygın olarak aşağıdaki amaçlarla kullanılır:
1. amonyak ve hidrojen klorürün endüstriyel sentezi;
2. sentez gazının bir parçası olarak metanol ve sentetik sıvı yakıtın elde edilmesi (2 hacim hidrojen ve 1 hacim CO);
3. Petrol fraksiyonlarının hidro-işlenmesi ve hidrokrakingi;
4. sıvı yağların hidrojenasyonu;
5. metallerin kesilmesi ve kaynaklanması;
6. Oksitlerinden tungsten, molibden ve renyumun elde edilmesi;
7. Yakıt olarak uzay motorları.
8. Termonükleer reaktörlerde yakıt olarak hidrojen izotopları kullanılır.
Hidrojenin fiziksel ve kimyasal özellikleri
Hidrojen renksiz, tatsız ve kokusuz bir gazdır. Yoğunluk hayır. 0,09 g/l (havadan 14 kat daha hafif). Hidrojen suda çok az çözünür (100 hacim su başına yalnızca 2 hacim gaz), ancak d-metaller - nikel, platin, paladyum (bir hacim paladyumda 900 hacme kadar hidrojen çözülür) tarafından iyi emilir.
Kimyasal reaksiyonlarda hidrojen hem indirgeyici hem de oksitleyici özellikler gösterir. Çoğu zaman hidrojen indirgeyici bir madde olarak görev yapar.
1. Metal olmayanlarla etkileşim. Hidrojen, ametallerle uçucu hidrojen bileşikleri oluşturur (bkz. Ders 25).
Halojenli reaksiyon hızı ve koşullar flordan iyodine kadar değişir: flor ile hidrojen karanlıkta bile patlayıcı bir şekilde reaksiyona girer, klor ile reaksiyon oldukça sakin bir şekilde ışıkla çok az ışınlamayla ilerler, brom ve iyot ile reaksiyonlar tersine çevrilebilir ve yalnızca ısıtıldığında meydana gelir:
H2 + F2 → 2HF
H 2 + Cl 2 → hν 2HCl
H 2 + I 2 → t 2HI
Oksijen ile ve kükürt hidrojen hafif ısıtmayla reaksiyona girer. Oksijen ve hidrojenin 1:2 oranındaki karışımına denir patlayıcı gaz:
H 2 + Ö 2 → t H 2 Ö
H 2 + S → t H 2 S
Azot, fosfor ve karbon ile reaksiyon ısı altında, yüksek basınç altında ve bir katalizör varlığında gerçekleşir. Reaksiyonlar tersine çevrilebilir:
3H2 + N2 → kat., p, t2NH3
2H 2 + 3P → kat., p, t3PH 3
H 2 + C → kat., p, t CH 4
2. Karmaşık maddelerle etkileşim. Yüksek sıcaklıklarda hidrojen metalleri oksitlerinden ayırır:
CuO + H 2 → t Cu + H 2 O
3. Şu tarihte: alkali ve toprak alkali metallerle etkileşim Hidrojen oksitleyici özellikler sergiler:
2Na + H2 → 2NaH
Ca + H 2 → CaH 2
4. Organik maddelerle etkileşim. Hidrojen birçok organik maddeyle aktif olarak etkileşime girer; bu tür reaksiyonlara hidrojenasyon reaksiyonları denir. Bu tür reaksiyonlar “Organik Kimya” koleksiyonunun III.Bölümünde daha ayrıntılı olarak tartışılacaktır.
Sıvı
Hidrojen(lat. Hidrojenyum; sembolüyle gösterilir H) periyodik element tablosunun ilk elementidir. Doğada yaygın olarak dağıtılır. Hidrojenin en yaygın izotopu olan 1H'nin katyonu (ve çekirdeği) protondur. 1H çekirdeğinin özellikleri, NMR spektroskopisinin organik maddelerin analizinde yaygın olarak kullanılmasını mümkün kılar.
Hidrojenin üç izotopunun kendi isimleri vardır: 1H - protium (H), 2H - döteryum (D) ve 3H - trityum (radyoaktif) (T).
Basit madde hidrojen - H2 - açık renksiz bir gazdır. Hava veya oksijenle karıştığında yanıcı ve patlayıcıdır. Toksik değildir. Etanolde ve bir dizi metalde çözünür: demir, nikel, paladyum, platin.
Hikaye
Asitlerin ve metallerin etkileşimi sırasında yanıcı gazların salınması, 16. ve 17. yüzyıllarda kimyanın bir bilim olarak oluşumunun şafağında gözlemlendi. Mikhail Vasilyevich Lomonosov da doğrudan izolasyonuna dikkat çekti, ancak bunun flojiston olmadığının kesinlikle farkındaydı. İngiliz fizikçi ve kimyager Henry Cavendish 1766 yılında bu gazı incelemiş ve ona “yanıcı hava” adını vermiştir. Yakıldığında "yanıcı hava" su üretiyordu, ancak Cavendish'in flojiston teorisine bağlılığı onun doğru sonuçlara varmasını engelledi. Fransız kimyager Antoine Lavoisier, mühendis J. Meunier ile birlikte 1783 yılında özel gazometreler kullanarak suyun sentezini ve ardından su buharını sıcak demirle ayrıştırarak analizini gerçekleştirdi. Böylece “yanıcı havanın” suyun bir parçası olduğunu ve ondan elde edilebileceğini tespit etti.
ismin kökeni
Lavoisier hidrojene, "su doğuran" anlamındaki hidrojen adını verdi. Rusça "hidrojen" adı, 1824'te kimyager M. F. Soloviev tarafından Slomonosov'un "oksijenine" benzetilerek önerildi.
Yaygınlık
Hidrojen evrende en bol bulunan elementtir. Tüm atomların yaklaşık %92'sini oluşturur (%8'i helyum atomudur, diğer tüm elementlerin toplam payı %0,1'den azdır). Bu nedenle hidrojen, yıldızların ve yıldızlararası gazın ana bileşenidir. Yıldız sıcaklıkları koşullarında (örneğin Güneş'in yüzey sıcaklığı ~ 6000 °C), hidrojen plazma formunda bulunur; yıldızlararası uzayda bu element ayrı moleküller, atomlar ve iyonlar formunda bulunur ve oluşabilir Boyut, yoğunluk ve sıcaklık bakımından önemli ölçüde değişen moleküler bulutlar.
Yerkabuğu ve canlı organizmalar
Hidrojenin yer kabuğundaki kütle oranı %1'dir; en bol bulunan onuncu elementtir. Bununla birlikte, doğadaki rolü kütleye göre değil, diğer elementler arasında payı% 17 olan atom sayısına göre belirlenir (atomların payı ~% 52 olan oksijenden sonra ikinci sırada). Bu nedenle Dünya'da meydana gelen kimyasal işlemlerde hidrojenin önemi neredeyse oksijen kadar büyüktür. Dünya üzerinde hem bağlı hem de serbest halde bulunan oksijenin aksine, Dünya üzerindeki hidrojenin hemen hemen tamamı bileşikler halindedir; Atmosferde yalnızca çok az miktarda basit madde formunda hidrojen bulunur (hacimce %0,00005).
Hidrojen hemen hemen tüm organik maddelerin bir parçasıdır ve tüm canlı hücrelerde bulunur. Canlı hücrelerde hidrojen, atom sayısının neredeyse %50'sini oluşturur.
Fiş
Basit maddelerin üretimine yönelik endüstriyel yöntemler, karşılık gelen elementin doğada bulunduğu forma, yani üretimi için hammaddenin ne olabileceğine bağlıdır. Böylece serbest halde bulunan oksijen, fiziksel olarak sıvı havadan ayrıştırılarak elde edilir. Hidrojenin neredeyse tamamı bileşik halinde olduğundan elde edilmesi için kimyasal yöntemler kullanılır. Özellikle ayrışma reaksiyonları kullanılabilir. Hidrojen üretmenin bir yolu, suyun elektrik akımıyla ayrıştırılmasıdır.
Hidrojen üretiminin ana endüstriyel yöntemi, doğal gazın bir parçası olan metanın suyla reaksiyonudur. Yüksek sıcaklıkta gerçekleştirilir (metan kaynar sudan geçirildiğinde bile herhangi bir reaksiyonun oluşmadığını doğrulamak kolaydır):
CH 4 + 2H 2 O = CO 2 + 4H 2 −165 kJ
Laboratuvarda basit maddeler elde etmek için mutlaka doğal hammaddeler kullanılmaz, ancak gerekli maddeyi izole etmenin daha kolay olduğu başlangıç materyalleri seçilir. Örneğin laboratuvarda havadan oksijen elde edilmez. Aynı durum hidrojen üretimi için de geçerlidir. Bazen endüstride kullanılan hidrojen üretimine yönelik laboratuvar yöntemlerinden biri, suyun elektrik akımıyla ayrıştırılmasıdır.
Tipik olarak hidrojen, çinkonun hidroklorik asitle reaksiyona sokulmasıyla laboratuvarda üretilir.
Endüstride
1. Sulu tuz çözeltilerinin elektrolizi:
2NaCl + 2H20 → H2 + 2NaOH + Cl2
2. Yaklaşık 1000 °C sıcaklıktaki sıcak kok üzerinden su buharının geçirilmesi:
H2O+C? H2+CO
3. Doğalgazdan.
Buhar dönüşümü:
CH4 + H20 ? CO + 3H2 (1000 °C)
Oksijenle katalitik oksidasyon:
2CH4 + O2? 2CO + 4H2
4. Petrol rafinasyonu sırasında hidrokarbonların kırılması ve yeniden şekillendirilmesi.
Laboratuvarda
1.Seyreltik asitlerin metaller üzerindeki etkisi. Bu reaksiyonu gerçekleştirmek için çoğunlukla çinko ve seyreltik hidroklorik asit kullanılır:
Zn + 2HCl → ZnCl2 + H2
2.Kalsiyumun su ile etkileşimi:
Ca + 2H20 → Ca(OH)2 + H2
3.Hidridlerin hidrolizi:
NaH + H20 → NaOH + H2
4.Alkalilerin çinko veya alüminyum üzerindeki etkisi:
2Al + 2NaOH + 6H20 → 2Na + 3H2
Zn + 2KOH + 2H20 → K2 + H2
5.Elektroliz kullanma. Alkalilerin veya asitlerin sulu çözeltilerinin elektrolizi sırasında katotta hidrojen açığa çıkar, örneğin:
2H 3 Ö + + 2e − → H 2 + 2H 2 Ö
Fiziki ozellikleri
Hidrojen iki formda (modifikasyonlar) mevcut olabilir - orto- ve para-hidrojen formunda. Bir ortohidrojen molekülünde Ö-H2 (en −259,10 °C, bp −252,56 °C) nükleer dönüşler aynı şekilde (paralel) yönlendirilir ve parahidrojen için P-H2 (erime noktası -259,32 °C, kaynama noktası -252,89 °C) - birbirine zıttır (antiparalel). Denge karışımı Ö-H2 ve P Belirli bir sıcaklıkta -H2 denir denge hidrojeni e-H2.
Hidrojen modifikasyonları, sıvı nitrojen sıcaklığında aktif karbon üzerinde adsorpsiyonla ayrılabilir. Çok düşük sıcaklıklarda ortohidrojen ve parahidrojen arasındaki denge neredeyse tamamen parahidrojene doğru kayar. 80 K'de formların oranı yaklaşık 1:1'dir. Isıtıldığında desorbe edilen parahidrojen, oda sıcaklığında dengede olan bir karışım oluşana kadar ortohidrojene dönüştürülür (orto-para: 75:25). Katalizör olmadan, dönüşüm yavaş yavaş gerçekleşir (yıldızlararası ortamın koşulları altında - karakteristik zamanlarla kozmolojik olanlara kadar), bu da bireysel modifikasyonların özelliklerini incelemeyi mümkün kılar.
Hidrojen en hafif gazdır, havadan 14,5 kat daha hafiftir. Açıkçası, moleküllerin kütlesi ne kadar küçükse, aynı sıcaklıkta hızları da o kadar yüksek olur. En hafif moleküller olan hidrojen molekülleri, diğer gazların moleküllerinden daha hızlı hareket eder ve böylece ısıyı bir cisimden diğerine daha hızlı aktarabilir. Buradan hidrojenin gaz halindeki maddeler arasında en yüksek termal iletkenliğe sahip olduğu sonucu çıkar. Isıl iletkenliği havanın ısıl iletkenliğinden yaklaşık yedi kat daha yüksektir.
Hidrojen molekülü diyatomiktir - H2. Normal şartlarda renksiz, kokusuz ve tatsız bir gazdır. Yoğunluk 0,08987 g/l (n.s.), kaynama noktası -252.76 °C, özgül yanma ısısı 120.9×10 6 J/kg, suda az çözünür - 18.8 ml/l. Hidrojen birçok metalde (Ni, Pt, Pd, vb.), özellikle paladyumda (1 hacim Pd başına 850 hacim) oldukça çözünür. Hidrojenin metallerdeki çözünürlüğü metaller arasında yayılma yeteneği ile ilgilidir; Bir karbon alaşımından (örneğin çelik) difüzyona bazen hidrojenin karbonla etkileşimi nedeniyle (dekarbonizasyon olarak adlandırılan) alaşımın tahrip olması eşlik eder. Gümüşte pratik olarak çözünmez.
Sıvı hidrojen−252,76 ile −259,2 °C arasında çok dar bir sıcaklık aralığında bulunur. Renksiz, çok hafif (-253 °C'de yoğunluk 0,0708 g/cm3) ve akışkan (-253 °C'de viskozite 13,8 spuaz) bir sıvıdır. Hidrojenin kritik parametreleri çok düşüktür: sıcaklık -240,2 °C ve basınç 12,8 atm. Bu, hidrojenin sıvılaştırılmasındaki zorlukları açıklamaktadır. Sıvı halde denge hidrojeni %99,79 para-H2, %0,21 orto-H2'den oluşur.
Katı hidrojen, erime noktası −259,2 °C, yoğunluk 0,0807 g/cm3 (−262 °C'de) - kar benzeri kütle, altıgen kristaller, P6/mmc uzay grubu, hücre parametreleri A=3,75 C=6.12. Yüksek basınçta hidrojen metalik bir duruma dönüşür.
İzotoplar
Hidrojen, ayrı adlara sahip üç izotop formunda oluşur: 1H - protium (H), 2H - döteryum (D), 3H - trityum (radyoaktif) (T).
Protium ve döteryum, kütle numaraları 1 ve 2 olan kararlı izotoplardır. Doğadaki içerikleri sırasıyla 99,9885 ± %0,0070 ve 0,0115 ± %0,0070'tir. Bu oran hidrojenin kaynağına ve üretim yöntemine bağlı olarak biraz değişebilir.
Hidrojen izotopu 3H (trityum) kararsızdır. Yarı ömrü 12,32 yıldır. Trityum doğal olarak çok küçük miktarlarda oluşur.
Literatürde ayrıca kütle numaraları 4 - 7 ve yarı ömürleri 10 -22 - 10 -23 s olan hidrojen izotoplarına ilişkin veriler de sağlanmaktadır.
Doğal hidrojen 3200:1 oranında H2 ve HD (döteryum hidrojen) moleküllerinden oluşur. Saf döteryum hidrojen D2'nin içeriği daha da azdır. HD ve D2 konsantrasyonlarının oranı yaklaşık 6400:1'dir.
Kimyasal elementlerin tüm izotopları arasında, hidrojen izotoplarının fiziksel ve kimyasal özellikleri birbirinden en çok farklılık gösterir. Bunun nedeni atom kütlelerindeki en büyük göreceli değişimdir.
|
Sıcaklık |
Sıcaklık |
Üçlü |
Kritik |
Yoğunluk |
|
Döteryum ve trityumun ayrıca orto ve para modifikasyonları da vardır: P-D2, Ö-D2, P-T2, Ö-T 2 . Heteroizotop hidrojenin (HD, HT, DT) orto ve para modifikasyonları yoktur.
Kimyasal özellikler
Ayrışmış hidrojen moleküllerinin fraksiyonu
Hidrojen molekülleri H2 oldukça güçlüdür ve hidrojenin reaksiyona girmesi için çok fazla enerji harcanması gerekir:
H 2 = 2H - 432 kJ
Bu nedenle, normal sıcaklıklarda hidrojen, yalnızca kalsiyum gibi çok aktif metallerle reaksiyona girerek kalsiyum hidrit oluşturur:
Ca + H2 = CaH2
ve hidrojen florür oluşturan tek metal olmayan flor ile:
Hidrojen, yüksek sıcaklıklarda veya aydınlatma gibi diğer etkiler altında metallerin ve metal olmayanların çoğuyla reaksiyona girer:
02 + 2H2 = 2H20
Bazı oksitlerden oksijeni “çıkarabilir”, örneğin:
CuO + H2 = Cu + H2O
Yazılı denklem hidrojenin indirgeyici özelliklerini yansıtır.
N2 + 3H2 → 2NH3
Halojenlerle hidrojen halojenürler oluşturur:
F 2 + H 2 → 2HF, reaksiyon karanlıkta ve herhangi bir sıcaklıkta patlayıcı bir şekilde meydana gelir,
Cl 2 + H 2 → 2HCl, reaksiyon yalnızca ışıkta patlayıcı bir şekilde ilerler.
Yüksek ısı altında kurumla etkileşime girer:
C + 2H 2 → CH 4
Alkali ve alkalin toprak metallerle etkileşim
Hidrojen, aktif metallerle etkileşime girdiğinde hidritler oluşturur:
2Na + H2 → 2NaH
Ca + H 2 → CaH 2
Mg + H 2 → MgH 2
Hidritler- kolayca hidrolize edilen tuz benzeri katı maddeler:
CaH2 + 2H20 → Ca(OH)2 + 2H2
Metal oksitlerle etkileşim (genellikle d-elementler)
Oksitler metallere indirgenir:
CuO + H 2 → Cu + H 2 O
Fe 2 Ö 3 + 3H 2 → 2Fe + 3H 2 Ö
WO 3 + 3H 2 → W + 3H 2 O
Organik bileşiklerin hidrojenasyonu
Moleküler hidrojen, organik bileşiklerin indirgenmesi için organik sentezlerde yaygın olarak kullanılır. Bu süreçlere denir hidrojenasyon reaksiyonları. Bu reaksiyonlar, yüksek basınç ve sıcaklıkta bir katalizör varlığında gerçekleştirilir. Katalizör homojen (örn. Wilkinson Catalyst) veya heterojen (örn. Raney nikeli, karbon üzerinde paladyum) olabilir.
Böylece, özellikle alkenler ve alkinler gibi doymamış bileşiklerin katalitik hidrojenasyonu sırasında doymuş bileşikler - alkanlar oluşur.
Hidrojenin jeokimyası
Serbest hidrojen H2, karasal gazlarda nispeten nadir bulunur, ancak su formunda jeokimyasal süreçlerde son derece önemli bir rol alır.
Hidrojen minerallerde amonyum iyonu, hidroksil iyonu ve kristal su formunda bulunabilir.
Atmosferde suyun güneş ışınımıyla ayrışması sonucu sürekli olarak hidrojen üretilir. Kütlesi düşük olan hidrojen molekülleri, yüksek bir yayılma hareket hızına sahiptir (ikinci kozmik hıza yakındır) ve atmosferin üst katmanlarına girdiklerinde uzaya uçabilirler.
Tedavinin özellikleri
Hidrojen, havayla karıştırıldığında patlayıcı bir karışım oluşturur; buna patlayıcı gaz denir. Bu gaz, hidrojen ve oksijenin hacim oranı 2:1 olduğunda veya hava yaklaşık %21 oksijen içerdiğinden hidrojen ve hava yaklaşık 2:5 olduğunda en patlayıcıdır. Hidrojen aynı zamanda bir yangın tehlikesidir. Sıvı hidrojen ciltle temas ederse ciddi donmalara neden olabilir.
Hidrojen ve oksijenin patlayıcı konsantrasyonları hacimce %4 ila %96 arasında meydana gelir. Hava ile karıştırıldığında hacimce %4'ten %75(74)'e kadar.
Ekonomi
Büyük toptan tedarikler için hidrojenin maliyeti kg başına 2-5 dolar arasında değişmektedir.
Başvuru
Atomik hidrojen, atomik hidrojen kaynağı için kullanılır.
Kimyasal endüstri
- Amonyak, metanol, sabun ve plastik üretiminde
- Sıvı bitkisel yağlardan margarin üretiminde
- Besin takviyesi olarak kayıtlı E949(paketleme gazı)
Gıda endüstrisi
Havacılık endüstrisi
Hidrojen çok hafiftir ve daima havada yükselir. Bir zamanlar hava gemileri ve balonlar hidrojenle dolduruluyordu. Ama 30'lu yıllarda. XX yüzyıl Zeplinlerin patladığı ve yandığı birçok felaket yaşandı. Günümüzde hava gemileri, maliyeti çok yüksek olmasına rağmen helyumla dolduruluyor.
Yakıt
Hidrojen roket yakıtı olarak kullanılıyor.
Hidrojenin otomobil ve kamyonlarda yakıt olarak kullanılmasına ilişkin araştırmalar sürüyor. Hidrojen motorları çevreyi kirletmez ve sadece su buharı yayar.
Hidrojen-oksijen yakıt hücreleri, kimyasal reaksiyonun enerjisini doğrudan elektrik enerjisine dönüştürmek için hidrojeni kullanır.
"Sıvı Hidrojen"(“LH”), 0,07 g/cm³ düşük özgül yoğunluğa ve 14,01 K (-259,14 °C) donma noktasına ve 20,28 K (-252,87 °C) kaynama noktasına sahip kriyojenik özelliklere sahip hidrojenin sıvı halidir. ). Renksiz, kokusuz, hava ile karıştırıldığında %4-75 yanıcılık aralığına sahip patlayıcı olarak sınıflandırılan bir sıvıdır. Sıvı hidrojendeki izomerlerin dönüş oranı: %99,79 - parahidrojen; %0,21 - ortohidrojen. Hidrojenin toplanma durumunu gaz haline değiştirirken genleşme katsayısı 20°C'de 848:1'dir.
Diğer gazlarda olduğu gibi hidrojenin sıvılaştırılması da hacminin azalmasına neden olur. Sıvılaştırmadan sonra sıvı sıvı, ısı yalıtımlı kaplarda basınç altında depolanır. Sıvı hidrojen Sıvı hidrojen, LH2, Sol 2) endüstride bir gaz depolama biçimi olarak ve uzay endüstrisinde roket yakıtı olarak aktif olarak kullanılmaktadır.
Hikaye
Yapay soğutmanın belgelenen ilk kullanımı 1756'da İngiliz bilim adamı William Cullen tarafından gerçekleştirildi; 1784'te kükürt oksidin sıvı halini elde eden ilk kişi Gaspard Monge oldu; sıvılaştırılmış amonyağı elde eden ilk kişi Michael Faraday oldu; Amerikalı mucit Oliver Evans 1805'te bir soğutma kompresörü geliştiren ilk kişi oldu, 1834'te soğutma makinesinin patentini alan ilk kişi Jacob Perkins oldu ve 1851'de Amerika Birleşik Devletleri'nde bir klimanın patentini alan ilk kişi John Gorey oldu. Werner Siemens, 1857'de rejeneratif soğutma konseptini önerdi; Karl Linde, 1876'da kademeli bir "Joule-Thomson genleşme etkisi" ve rejeneratif soğutma kullanarak sıvı hava üretmek için ekipmanın patentini aldı. 1885 yılında Polonyalı fizikçi ve kimyager Zygmunt Wroblewski hidrojenin kritik sıcaklığını 33 K, kritik basıncını ise 13,3 atm olarak yayınladı. ve kaynama noktası 23 K'dır. Hidrojen ilk kez 1898'de James Dewar tarafından rejeneratif soğutma ve onun icadı olan Dewar şişesi kullanılarak sıvılaştırıldı. Sıvı hidrojenin kararlı bir izomeri olan parahidrojenin ilk sentezi 1929'da Paul Harteck ve Carl Bonhoeffer tarafından gerçekleştirildi.
Hidrojenin spin izomerleri
Oda sıcaklığında hidrojen esas olarak bir spin izomeri olan ortohidrojenden oluşur. Üretimden sonra sıvı hidrojen yarı kararlı bir durumdadır ve düşük sıcaklıklarda değiştiğinde meydana gelen patlayıcı ekzotermik reaksiyonu önlemek için parahidrojen formuna dönüştürülmesi gerekir. Parahidrojen fazına dönüşüm genellikle demir oksit, krom oksit, aktif karbon, platin kaplı asbest, nadir toprak metalleri gibi katalizörler kullanılarak veya uranyum veya nikel katkı maddeleri kullanılarak gerçekleştirilir.
Kullanım
Sıvı hidrojen, içten yanmalı motorlar ve yakıt hücreleri için bir yakıt depolama biçimi olarak kullanılabilir. Hidrojenin bu toplam formu kullanılarak çeşitli denizaltılar ("212A" ve "214" projeleri, Almanya) ve hidrojen taşıma konseptleri oluşturulmuştur (örneğin "DeepC" veya "BMW H2R"ye bakınız). Tasarımların yakınlığı nedeniyle, LHV ekipmanının yaratıcıları sıvılaştırılmış doğal gaz (LNG) kullanan sistemleri kullanabilir veya yalnızca değiştirebilir. Ancak hacimsel enerji yoğunluğunun düşük olması nedeniyle yanma, doğal gaza göre daha büyük hacimde hidrojen gerektirir. Pistonlu motorlarda "CNG" yerine sıvı hidrojen kullanılıyorsa genellikle daha hacimli bir yakıt sistemine ihtiyaç duyulur. Direkt enjeksiyonda emme kanalındaki artan kayıplar silindir dolumunu azaltır.
Sıvı hidrojen ayrıca nötron saçılma deneylerinde nötronları soğutmak için de kullanılır. Nötron ve hidrojen çekirdeğinin kütleleri neredeyse eşittir, bu nedenle elastik çarpışma sırasında enerji alışverişi en etkili olanıdır.
Avantajları
Hidrojen kullanmanın avantajı, kullanımının “sıfır emisyon” olmasıdır. Hava ile etkileşiminin ürünü sudur.
Engeller
Bir litre “ZhV” yalnızca 0,07 kg ağırlığındadır. Yani özgül ağırlığı 20 K'de 70,99 g/l'dir. Sıvı hidrojen, özel ısı yalıtımlı kaplar gibi kriyojenik depolama teknolojisi gerektirir ve tüm kriyojenik malzemeler için tipik olan özel kullanım gerektirir. Bu bakımdan sıvı oksijene yakındır ancak yangın tehlikesi nedeniyle daha fazla dikkat gerektirir. Yalıtılmış kaplarda bile onu sıvı halde tutmak için gereken düşük sıcaklıklarda tutmak zordur (tipik olarak günde %1 oranında buharlaşır). Hidrojenle çalışırken olağan güvenlik önlemlerini de uygulamanız gerekir; patlayıcı olan havayı sıvılaştıracak kadar soğuktur.
Roket yakıtı
Sıvı hidrojen, fırlatma araçlarını ve uzay araçlarını hareket ettirmek için kullanılan roket yakıtlarının yaygın bir bileşenidir. Sıvı hidrojen roket motorlarının çoğunda, bir oksitleyici ile karıştırılıp itme kuvveti üretmek üzere yakılmadan önce ilk olarak memeyi ve diğer motor parçalarını rejeneratif olarak soğutmak için kullanılır. H2/O2 bileşenlerini kullanan modern motorlar, hidrojen açısından aşırı zenginleştirilmiş bir yakıt karışımı tüketir ve bu da egzozda belirli miktarda yanmamış hidrojene yol açar. Molekül ağırlığını azaltarak motorun özgül itiş gücünü artırmanın yanı sıra, bu aynı zamanda meme ve yanma odasının aşınmasını da azaltır.
LH'nin diğer alanlarda kullanılmasının önündeki kriyojenik doğa ve düşük yoğunluk gibi engeller de bu durumda kullanımı sınırlayıcı bir faktördür. 2009 yılı itibariyle tamamı hidrojen roketinden oluşan tek bir fırlatma aracı (Delta-4 fırlatma aracı) bulunmaktadır. Temel olarak "ZhV", roketlerin üst aşamalarında veya yükün uzaya vakumla fırlatılması işinin önemli bir bölümünü gerçekleştiren bloklarda kullanılır. Bu tür yakıtın yoğunluğunu artırmaya yönelik önlemlerden biri olarak, çamur benzeri hidrojenin, yani yarı donmuş bir "sıvı hidrojen" formunun kullanılması önerileri vardır.