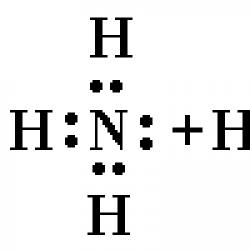Amonyum klorürdeki kimyasal bağ. Kimyasal bağ türleri. Amonyum klorürün kimyasal özellikleri
§5. Ve tuzlar için geleneksel olan iyonik bağdır
Elektronegatifliği çok farklı olan elementlerin atomlarından (örneğin bir alkali metal) oluşuyorsa ne tür bir kimyasal bağa sahip olacaktır? sodyum ve halojen klor?
Atom elektronu sodyum Hayır Dış değerlik seviyesinde yer alan, mahallede dolaşmanın büyük bir hayranıdır ve çoğu zaman evine, kendi atom çekirdeğine dönmeyi bile unutur. Ve sonra sodyum atomu inatçı elektronundan mahrum kalır ve katyon Na+:
Na 0 - 1 e− = Na +
Bir atomun yedi elektronu klor Cl Tam tersine iflah olmaz ev insanlarıdırlar, ziyaret etmeyi sevmezler ama misafir ağırlamaktan memnuniyet duyarlar. Eğer komşu elektronlardan biri onlara doğru dönerse bu atom demektir. klor dönüşecek anyon Cl¯ genellikle denir klorür-iyon:
Cl 0 + 1 e− = Cl −
Zıt yüklü iyonlar birbirini çekecektir; oluştu Na+ iyonik bağ ~~~~ Cl-. Yani ortaya çıkıyor sodyum klorit NaCl, Herkes biliyor tuz.
Doğal sofra tuzu bir mineraldir.
Doğada bu mineral tuzlu deniz veya göl suyundan oluşur. Bir tuz çözeltisi tabakası altında soğutulduğunda kristalleri keşfedilir - şeffaf küpler sodyum klorit. Oluşan iyonlar sodyum klorit, biçim iyonik kristal katyonlardan oluşan sodyum Na+ Ve klorür anyonları Cl-.
Çözünmüş iyonlardan bir katı oluştuğunda, katyonlar ve anyonlar kristalde gelişigüzel değil, pozitif ve negatif yüklerin birbirini değiştireceği şekilde düzenlenir. O zaman güçlü olacak kristal hücre tuz NaCl iyonlardan oluşur.
Diğer tuzların kristalleri de benzer şekilde oluşturulur. sodyum karbonat Na2C03 (soda), Amonyum Klorür NH4Cl (amonyak), gümüş nitrat AgNO3 (lapis) Ve bircok digerleri.
Tüm tuzların tek başına var olan bireysel iyonlardan oluştuğu doğru mu? Doğru ama küçük bir "ama" var...
Tuz katyonu elektron bulutunun bir kısmını tutar çünkü en yaramaz elektron bile zaman zaman eve döner. Ancak bu bulutun çok büyük bir kısmı tuz anyonuna doğru kayar. Bu nedenle iyonik bağ dikkate alınır kovalent polar bağın sınırlayıcı durumu.
TANIM
Amonyum– pozitif yüklü çok atomlu iyon.
Kimyasal formül NH4+
Amonyum iyonu NH4+, merkezinde bulunan ve tetrahedronun köşelerinde atomları bulunan düzenli bir tetrahedrondur.
Amonyak molekülü NH3'te üç elektron çifti üç N - H bağı oluşturur, nitrojen atomuna ait dördüncü elektron çifti yalnızdır. Bu elektron çiftinin yardımıyla boş yörüngeye sahip bir hidrojen iyonu ile bir bağ oluşur:

Böylece, amonyum iyonunda, değişim mekanizması tarafından üç kovalent bağ ve verici-alıcı mekanizması tarafından bir kovalent bağ oluşturulur. Oluşum mekanizması bağın özelliklerini etkilemez; amonyum katyonundaki tüm bağlar eşdeğerdir.
Amonyum bileşikleri
Amonyum katyonu, pozitif yüklü bir nitrojen atomunun hidrojen iyonlarına ve/veya organik radikallere kovalent olarak bağlandığı ve bazı anyonlara iyonik olarak bağlandığı çeşitli karşı iyonlara sahip amonyum bileşikleri oluşturabilir.
İnorganik amonyum bileşikleri
Amonyak hidrat(amonyum hidroksit, amonyak suyu, amonyum hidroksit, amonyak hidroksit). Formül: NH3H20
Amonyak suyla reaksiyona girdiğinde oluşur. Zayıf bir baz suda amonyum katyonları ve hidroksit iyonları oluşturmak üzere ayrışır:
Reaksiyon tersine çevrilebilir, bu nedenle amonyum hidroksitin sulu çözeltileri her zaman karakteristik keskin bir amonyak kokusuna sahiptir.
Amonyum tuzları
Tüm amonyum tuzlarının özellikleri karşılık gelen sodyum tuzlarına benzer. Suda iyi çözünürler, sulu bir çözeltide tamamen ayrışırlar ve ısıtıldığında ayrışırlar:
Çözeltide katyonla hidrolize olurlar:
Organik amonyum bileşikleri nitrojen atomuyla ilişkili organik radikallerin sayısına göre birincil (R 1 NH3) + X -, ikincil (R 1 R 2 NH 2) + X -, üçüncül (R 1 R 2 R 3 NH) + X - ve dördüncül (R 1 R 2 R 3 R 4 N) + X – .
Birincil, ikincil ve üçüncül amonyum bileşikleri, karşılık gelen aminlerin tuzları olarak düşünülebilir; bu aminlerin asitlerle reaksiyona sokulmasıyla hazırlanabilirler:
burada R1, R2, R3 organik radikaller veya hidrojendir, X asit kalıntısının anyonudur.
Kalitatif reaksiyon amonyum iyonları için - amonyak salınımı ile alkalilerle etkileşim:
Problem çözme örnekleri
ÖRNEK 1
| Egzersiz yapmak | Sulu bir amonyum klorür çözeltisinin pH değeri (7'den fazla veya az) nedir? Hidrolizin moleküler ve iyon-moleküler denklemlerini yazın. |
| Çözüm | NH4Cl, zayıf bir bazın ve güçlü bir asidin tuzudur, dolayısıyla katyon yoluyla hidroliz meydana gelir. Moleküler denklem: Tam iyonik denklem: Kısa iyonik denklem: Hidroliz işlemi sırasında hidrojen (H+) oluştuğundan çözelti asidik bir ortama (pH) sahiptir. |
| Cevap | Amonyum klorür çözeltisinin pH'ı 7'den azdır. |
ÖRNEK 2
| Egzersiz yapmak | 44,8 litre amonyak ile 33,6 litre hidrojen klorürün (normal koşullar) etkileşimi sonucu hangi tuz kütlesi oluşur? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Çözüm | Reaksiyon denklemini yazalım: Amonyak, hidrojen klorür ve elde edilen tuz, amonyum klorürün (NH4Cl) molar kütleleri eşittir. Kimyasal bağ. Kristal hücre Görevlerin cevapları bir kelime, cümle, sayı veya kelime dizisi, sayılardır. Cevabınızı boşluk, virgül veya diğer ek karakterler olmadan yazın. Formun başlangıcı 1 Amonyum klorür kimyasal bağlar içerir: 1. iyonik 2. kovalent polar 3. kovalent polar olmayan 4. Hidrojen 5. metal 2 Sıvı haldeki moleküller arası hidrojen bağları aşağıdakilerin karakteristik özelliğidir: 1. Hidrojen 2. Su 3. Amonyak 4. Asetaldehit 5. İzobutan 3 Kovalent polar olmayan kimyasal bağlar maddelerde bulunur: 1. beyaz fosfor 2. fosforik asit 3. amonyak 4. etil alkol 5. eşkenar dörtgen kükürt 4 Verilen listeden iyonik kimyasal bağ içeren iki bileşik seçin. 1. Ca(ClO 2 ) 2 2. HClO 3 3.NH 4 Cl 4.HClO 4 5.C l2Ö 7 5 Sağlanan listeden aşağıdakileri içeren iki bileşiği seçin: kovalent polar olmayan kimyasal bağ. 1. Ca 2. N 2 3. AlCl 3 4. HClO 4 5.Cl 2 6 Potasyum sülfat kimyasal bağlar içerir: 1. iyonik 2. kovalent polar olmayan 3. kovalent polar 4. hidrojen 5. metal 7 Maddede hem iyonik hem de kovalent kimyasal bağlar mevcuttur: 1.HCl 2.H 2 BU YÜZDEN 4 3. NaOH 4. NH 4 Kardeş 5.C 2 N 5 O 8 Önerilen listeden molekülleri arasında iki bileşik seçin. hidrojen bağı. 1. fenol 2. dietil eter 3. Etil asetat 4. formik aldehit 5. formik asit 9 Verilen listeden kovalent bağ içeren iki bileşik seçin polar kimyasal bağ. 1. CaCl2 2 2.HCl 3.BaO 4.KSIO 4 5.Cl 2 10 Moleküler olmayan bir yapıya sahiptirler: 1. potasyum hidroksit 2. Amonyak 3. asetik asit 4. nitrik asit 5. grafit 11 İyonik bağlar iki maddenin her birinde gerçekleştirilir: 1. Aben 2 Ö 3 VeFeCl 3 2.K 2 SVeNaNO 3 3. BİLİYORUM 2 ve hayır 2 4. HF ve HCl 5. NaBr ve NH 4 F 12 Katı haldeki atomik kristal kafes şunları içerir: 1. oksijen 2. beyaz fosfor 3. kırmızı fosfor 4. elmas 5. sodyum klorür 13 Verilen listeden kimyasal bağın oluştuğu iki bileşiği seçin ortak bir elektron çifti nedeniyle 1. CA 2. H 2 Ö 3. NaCl 4. CaO 5. Cl 2 14 Moleküler yapı: 1. propanol-2 2. potasyum asetat 3. karbondioksit 4. sodyum metoksit 5. kalsiyum karbonat 15 İyonik kristal kafeslere sahip tüm maddeler 1. sert 2. plastik 3. nispeten uçucu 4. Suda yüksek oranda çözünür 5. Yüksek erime noktalarına sahiptir 16 Verilen listeden molekülleri hidrojen bağı oluşturan iki bileşik seçin. 1. metan 2. Silan 3. Amonyak 4. Fosfin 5. Su Formun sonu Amonyum klorür (amonyum klorür, amonyak), çeşitli alanlarda yaygın olarak kullanılan inorganik bir bileşiktir. Kimyasal açıdan bakıldığında bu bir amonyum tuzudur; formül NH4Cl. Amonyum klorür Antik Yunan ve Eski Mısır'da zaten biliniyordu. Adlarından biri olan "amonyak", Mısır'da rahiplerin törenden önce buharını solumak ve ilahi güçlerle iletişim kurmak için mağaraların duvarlarına topladıkları bir madde olan "nushadir"den geliyor. "Amonyak", adını Mısır güneş tanrısı Amun'a kadar takip ediyor. Antik Yunan'da bu madde, Yunanlılar için yakıt görevi gören deve gübresinin yakılması sonucu baca duvarlarında oluşan kurumdan elde ediliyordu (amonyum klorür, hayvan ve insan dışkılarının ayrışmasından elde ediliyordu). Amonyum klorür doğal olarak volkanik mağaralarda ve yer kabuğundaki çatlakların yakınında plak veya kabuk şeklinde oluşur. ÖzelliklerNH4Cl beyaz kristal bir tozdur (teknik sınıf reaktif sarımsı veya pembe olabilir), hafif higroskopik, kokusuz ve tadı tuzludur. Suda ve sıvı amonyakta iyi çözünür, sıcaklığın artmasıyla suda çözünürlüğü artar. Alkalilerle reaksiyona girerek tuz, su ve amonyak oluşturur. Reaktif, etil ve metil alkollerde çok daha az oranda çözünür. Kalın beyaz dumanın salınmasıyla yanar. 338 °C'nin üzerindeki sıcaklıklarda ve elektrik akımının etkisi altında tamamen ayrışır. Amonyum klorürün yanması, solunumu tahriş eden amonyak açığa çıkarır. Reaktifin sulu bir çözeltisi, sinir sistemi üzerinde uyarıcı etkiye sahip, keskin kokulu bir sıvı olan amonyaktır. Reaktif bir ilaç olarak kullanılır, ancak aşırı dozda solunum durmasına ve komaya yol açabileceğinden amonyakla tedavi kesinlikle doktor tavsiyesi üzerine yapılmalıdır (örneğin sodyum bikarbonat gibi alkalin çözeltiler panzehir olarak uygulanır) . Ayrıca bu ilacın kontrendikasyonları vardır.
Amonyum klorür orta derecede tehlikeli bir madde olarak sınıflandırılır (sınıf 3); onunla koruyucu ekipman kullanarak çalışmalısınız: lastik eldivenler, koruyucu gözlükler ve solunum cihazı, besleme ve egzoz havalandırması olan bir odada. Reaktifin cilt ve mukoza ile temas etmemesine dikkat edilmelidir. Kimyasal depolayın Reaktifin, neme erişimi olmayan kapalı alanlarda, hava geçirmez şekilde kapatılmış çok katmanlı torbalarda olması gerekir. Bağlantı çevreye zararlıdır. BaşvuruMetallerin dekapajı için demir dışı metalurjide. Prime Chemicals Group mağazasından satın alabilirsiniz 1. Bir moleküldeki en polar bağlar şunlardır: a) HC1 b) AsH 3 c) PH 3 r)H 2 S 2. Molekül doğrusal bir şekle sahiptir: a)H 2 O b)H 2 S c)WeC1 2 d) OF 2 3. CH4 metan molekülünün geometrik şekli: a) açısal b) piramidal b) üçgen d) dört yüzlü 4. Molekül piramidal bir şekle sahiptir: a) BC1 3 b) SiBr 4 c) A1Br 3 d) PC1 3 5. Polar bir molekül: a) C02 b) CH4 b) NH3 r) N2 6. σ-bağlarının sayısı moleküldeki π-bağlarının sayısından üç kat daha fazladır: a) klorlu asit b) ortofosforik asit c) sülfürlü asit d) perklorik asit 7. Yalnızca kovalent bağ içeren bileşiklerin formülleri hangi seride sunulmaktadır? a) BaCl 2, CdC1 2, LiF c) NaCl, CuSO 4, Fe(OH) 3 b) H 2 O, SiO 2, CH3COOH d) N 2, HNO 3, NaNO 3 8. Amonyum klorürde ne tür kimyasal bağlar yoktur? a) kovalent polar b) kovalent polar olmayan c) bağışçı-alıcı d) iyonik 9. Atom numarası 3 ve 9 olan elementlerin atomları arasında oluşan kimyasal bağ: a) kovalent polar b) metal c) kovalent polar olmayan d) iyonik 10. Bir etilen molekülünde kaç elektron bulunur? Olumsuz kimyasal bağların oluşumuna katılıyor musunuz? a) 4 b) 8 c) 12 d) 16 11. Kimyasal bağların oluşumunda rol oynayan elektronların sayısı bir molekülde en fazladır: a)H 2 O b)C1 2 b)H 2 S r)N 2 12. Atomik kristal kafes şunları içerir: a) sodyum hidroksit c) demir b) elmas d) buz 13. Yüksek elektronegatifliğe sahip p elementli s-metal bileşiklerinin özelliği ne tür kristal kafestir? a) metalik b) atomik b) iyonik d) moleküler 14. Katı haldeki atomik, moleküler ve iyonik kristal kafeslere sahip maddeler sırasıyla hangi satırda listelenmiştir? a) elmas, sodyum klorür, grafit b) beyaz fosfor, su, tebeşir c) silikon (IV) oksit, bakır, nitrojen d) elmas, karbondioksit, potasyum florür 15. Amonyak ve hidrojen klorürden amonyum klorür oluştuğunda ne değişir? a) nitrojen atomunun oksidasyon durumu b) nitrojen atomunun oksidasyon durumu ve değeri c) nitrojen atomunun değerliliği d) hidrojen atomunun oksidasyon durumu 16. Aşağıdaki parçacıklardan hangisi verici-alıcı mekanizmasıyla oluşmuştur? a)F 2 b)HF c)BF 4 – d)BF 3 17. Hangi maddede nitrojenin oksidasyon durumu ve değeri mutlak değere eşittir? a)N 2 b)NH 3 b)HNO 3 d) NH 4 C1 18. Hangi molekül en az kararlıdır? a)H 2 O 6)H 2 S B)H 2 Se d) H 2 Te 19. Hangi kimyasal bağ en az güçlüdür? a) metalik b) hidrojen b) iyonik d) kovalent 20. Hangi elementin atomu iyonik bağ oluşturma konusunda en büyük eğilimi gösterir? a) C b) Si c) F d) P 21. Bir dizi molekülde polarite ve bağ kuvveti nasıl değişir? HF → HC1 → YÜKSEK? a) hem polarite hem de bağ kuvveti artar b) polarite artar, güç azalır c) hem polarite hem de bağ kuvveti azalır d) polarite azalır, kuvvet artar 22. Bir hidrojen klorür molekülü oluşturulurken sırasıyla hidrojen ve klor atomlarının hangi tür yörüngeleri örtüşür? A) S Ve S B) S Ve R V) R Ve R G) P Ve S 23. Hangi moleküldeki tüm bağlar polar kovalenttir? a) H 2 O 2 b) C 2 H 4 c) C 2 H 2 d) C02 24. En yüksek oksidasyon durumunun cebirsel değeri en yüksek olan element hangisidir? a) flor b) krom c) karbon d) klor 25. En düşük oksidasyon durumunun cebirsel değeri en düşük olan element hangisidir? a) nitrojen b) kükürt c) hidrojen d) brom 26. Hidrojen hangi bileşikte negatif oksidasyon durumuna sahiptir? a) NH4Cl b) CaH2 c) H2O2 d) HF 27. BC1 3, Be1 2 ve SiBr 4 bileşiklerinde merkezi atomların değerlik yörüngeleri sırasıyla aşağıdaki hibrit hallerdedir: A) sp, sp 2, sp 3 V) sp, sp3, sp2 B) sp 2, sp, sp 3 G) sp3, sp2, sp 28. Aşağıdaki bileşiklerde nitrojenin değeri: N2, NH3, NH4 +, CH3NH2, HNO3 - sırasıyla eşittir: a) 0, III, IV, V, V c) III, III, IV, III, IV b) I, III, III, IV, IV r) III, III, III, IV, V 29.İyonik bağın doğru özelliği: b) yönlü, doymamış c) yönlendirilmiş, doyurulabilir d) yönsüz, doyurulabilir 30. Kovalent bir bağın doğru özelliği şudur: a) yönsüz, doyurulamaz b) yönlü, doymamış c) yönlendirilmiş, doyurulabilir d) yönsüz, doyurulabilir 31. Grupta yer alan her bileşikte atomlar arasında çift bağ bulunur: a) CO, CO2 c) S8, C2H4 b) C 2 H 2, SO 2 d) CO 2, C 2 H 4 32. Grupta yer alan her bileşikte atomlar arasında üçlü bağ mevcuttur: a) CO, N 2 b) N 2, SO 2 c) S 8, C 2 H 2 d) CO 2, C 2 H 4 33.Hangi elementin en yüksek oksidasyon durumu periyodik tabloda bulunduğu grubun sayısından daha büyüktür? a) manganez b) altın c) bor d) nitrojen 34. Bu elementlerin atomları arasındaki kimyasal bağın türünü yargılamamızı sağlayan elementlerin niceliksel bir özelliği şöyledir: a) atom yarıçapı c) elektronegatiflik b) nükleer yük d) atom kütlesi 35. Aşağıdaki maddelerin moleküllerinde sırasıyla tek polar, çift polar olmayan, tek polar olmayan, üçlü polar bağlar bulunur: a) HF, C2H4, Br2, CO c) H2, CO2, HC1, N2 b) HBr, SO 3, N 2, C 2 H 2 d) C1 2, O 2, C 2 H 6, CO 36. Bir dikromik asit molekülündeki toplam σ sayısı ve π bağları sırasıyla şöyledir: a) 10 ve 4 b) 4 ve 10 c) 6 ve 2 d) 2 ve 6 37. Verilen maddeler: sezyum klorür, bakır, elmas, eşkenar dörtgen kükürt, buz, sodyum oksit, iyot, “kuru buz” (katı CO2), grafit, platin, potasyum hidrit. Bunlar arasında atomik kristal kafesi olan maddelerin sayısı şuna eşittir: a) 4 b)3 c) 2 d)1 38. Verilen maddeler: sezyum klorür, bakır, elmas, eşkenar dörtgen kükürt, buz, sodyum oksit, iyot, “kuru buz” (katı CO2), grafit, platin, potasyum hidrit. Bunlar arasında moleküler kristal kafesi olan maddelerin sayısı şuna eşittir: a) 4 b) 3 c) 2 d) 1 39. Verilen maddeler: sezyum klorür, bakır, elmas, eşkenar dörtgen kükürt, buz, sodyum oksit, iyot, “kuru buz” (katı CO2), grafit, platin, potasyum hidrit. Bunlar arasında iyonik kristal kafesli maddelerin sayısı şuna eşittir: a) 4 b) 3 c) 2 d) 1 40. Verilen maddeler: sezyum klorür, bakır, elmas, eşkenar dörtgen kükürt, buz, sodyum oksit, iyot, “kuru buz” (katı CO2), grafit, platin, potasyum hidrit. Bunlar arasında metal kristal kafesli maddelerin sayısı şuna eşittir: a) 4 b) 3 c) 2 d) 1
|

 Endüstride soda üretiminde yan ürün olarak amonyum klorür elde edilir. Laboratuvarda bileşik, klor ve amonyaktan veya amonyak ve hidrojen klorürün bir sofra tuzu çözeltisinden geçirilmesiyle sentezlenebilir.
Endüstride soda üretiminde yan ürün olarak amonyum klorür elde edilir. Laboratuvarda bileşik, klor ve amonyaktan veya amonyak ve hidrojen klorürün bir sofra tuzu çözeltisinden geçirilmesiyle sentezlenebilir.