Газ в твердое тело. Строение твердых, жидких и газообразных тел — Гипермаркет знаний
Установлению идеального порядка в расположении атомов, т. е. образованию твердого тела, препятствуют тепловые движения, главной особенностью которых является, как мы знаем, хаотичность, беспорядочность. Поэтому для того, чтобы вещество могло находиться в твердом состоянии, его температура должна быть достаточно низкой - настолько низкой, чтобы энергия тепловых движений была меньше, чем потенциальная энергия взаимодействия атомов.
Вполне идеальным кристаллом, в котором все атомы находятся в равновесии и обладают минимальной энергией, тело может быть только при абсолютном нуле. В действительности все вещества становятся твердыми при значительно более высоких температурах. Исключение составляет только гелий, который остается жидким и при абсолютном нуле, но это связано с некоторыми квантовыми эффектами, о которых мы кратко скажем ниже.
В твердое состояние вещество может перейти как из жидкого, так и из газообразного состояния. И в том и в другом случае такой переход есть переход из состояния, лишенного симметрии, в состояние, в котором симметрия существует (это во всяком случае относится к дальнему порядку, существующему в кристаллах, но не существующему ни в жидких, ни в газообразных веществах). Поэтому переход в твердое состояние должен происходить скачком, т. е. при определенной температуре, в отличие от перехода газ - жидкость, который, как мы знаем, может происходить и непрерывным образом.
Рассмотрим сначала превращение жидкость-твердое тело. Процесс образования твердого тела при охлаждении жидкости есть процесс образования кристалла (кристаллизация), (и происходит он при определенной температуре температуре кристаллизации или отвердевания. Так как при таком превращении энергия уменьшается, то оно сопровождается выделением энергии в виде скрытой теплоты кристаллизации. Обратное превращение - плавление - также происходит скачком при тон же температуре и сопровождается поглощением энергии в виде
той теплоты плавления, равной по величине теплоте кристаллизации.
Это ясно видно из графика зависимости температуры охлаждающейся жидкости от времени, изображаемого на рис. 179 (кривая а). Участок 1 кривой а дает ход монотонного понижения температуры жидкости вследствие отвода тепла от нее. Горизонтальный участок 2 показывает, что при определенном значении температуры ее понижение прекращается, несмотря на то, что отвод тепла продолжается. Через некоторое время температура снова начинает понижаться (участок 3). Температура, соответствующая участку 2, это и есть температура кристаллизации. Выделяющееся при кристаллизации тепло компенсирует отвод тепла от вещества и поэтому понижение температуры временно прекращается. После окончания процесса кристаллизации температура, теперь уже твердого тела, вновь начинает понижаться.
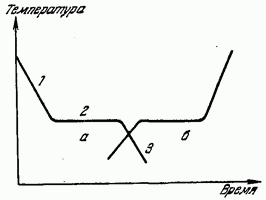
Такой ход графика понижения температуры характерен для кристаллических тел. При охлаждении жидкостей, не кристаллизующихся (аморфных веществ), скрытая теплота не выделяется и график охлаждения представляет собой монотонную кривую без остановки охлаждения.
При обратном процессе перехода вещества из твердого состояния в жидкое (плавление) на кривой нагревания также наблюдается остановка в повышении температуры, вследствие поглощения скрытой теплоты плавления - теплоты, за счет которой происходит разрушение кристаллической решетки (кривая на рис. 179).
Для начала кристаллизации необходимо присутствие центра или центров кристаллизации. Такими центрами могли бы служить случайные скопления частиц жидкости, прилипших друг к другу, к которым могли бы присоединяться всё новые и новые частицы, пока вся жидкость не обратилась бы в твердое тело. Однако образование таких скоплений в самой жидкости затрудняется тепловыми движениями, которые их разрушают еще до того, как они успевают приобрести сколько-нибудь заметные размеры. Кристаллизация существенно облегчается, если в жидкости с самого начала присутствуют достаточно большие твердые частицы в виде пылинок и тел, которые становятся центрами кристаллизации.
Образование центров кристаллизации в самой жидкости облегчается, конечно, с понижениемтемпературы. Поэтому кристаллизация чистой жидкости, лишенной посторонних образований,
начинается обычно при температуре несколько более низкои, чем истинная температура кристаллизации. В обычных условиях в кристаллизующейся жидкости имеется много центров кристаллизации, так что в жидкости образуется множество кристалликов, срастающихся вместе, и затвердевшее вещество оказывается поликристаллическим.
Только в особых условиях, которые обычно трудно обеспечить, можно получить одиночный кристалл - монокристалл, вырастающий из единственного центра кристаллизации. Если при этом для всех направлений обеспечены одинаковые условия накопления частиц, то кристалл получается правильно ограненным соответственно его свойствам симметрии.
Переход жидкость - твердое тело, так же как и обратное превращение, является фазовым переходом, так как жидкое и твердое состояния можно рассматривать как две фазы вещества. Обе фазы при температуре кристаллизации (плавления) могут соприкасаться друг с другом, находясь в равновесии (лед, например, может плавать в воде, не плавясь), так же как могут находиться в равновесии жидкость и ее насыщенный пар.
Подобно тому как температура кипения зависит от давления, температура кристаллизации (и равная ей температура плавления) также зависит от давления, обычно возрастая с ростом давления. Растет она потому, что внешнее давление сближает атомы между собой, а для разрушения кристаллической решетки при плавлении атомы нужно отдалить друг от друга: при большем давлении для этого требуется большая энергия тепловых движений, т. е. более высокая температура.
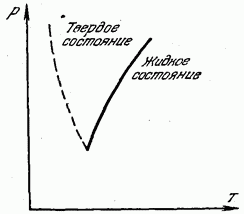
На рис. 180 показана кривая зависимости температуры плавления (кристаллизации) от давления. Сплошная кривая делит всю область на две части. Область влево от кривой соответствует твердому состоянию, а область справа от кривой - жидкому состоянию. Любая же точка, лежащая на самой кривой плавления, соответствует равновесию твердой и жидкой фаз: при этих давлениях и температурах вещество в жидком и твердом состояниях находится в равновесии, соприкасаясь друг с другом, и при этом жидкость не твердеет, а твердое тело не плавится.
Пунктиром на рис. 180 показана кривая плавления для тех немногих веществ (висмут, сурьма, лед, германий), у которых при отвердевании объем не уменьшается, а увеличивается. У таких
веществ, естественно, температура плавления с повышением давления понижается.
Изменение температуры плавления связано с изменением давления соотношением Клапейрона - Клаузиуса:
![]()
Здесь - температура плавления (кристаллизации), и - соответственно молярные объемы жидкой и твердой фаз и молярная теплота плавления.
Эта формула справедлива и для других фазовых переходов. В частности, для случая испарения и конденсации формула Клапейрона-Клаузиуса была выведена в гл. VII [см. (105.6)].
Из формулы Клапейрона - Клаузиуса видно, что знак изменения температуры плавления с изменением давления определяется тем, какая из двух величин, или больше. Крутизна кривой зависит также от величины скрытой теплоты перехода чем меньше тем меньше изменяется температура плавления с давлением. В табл. 20 приведены значения удельной (т. е. отнесенной к единице массы) теплоты плавления для некоторых веществ.
Таблица 20 (см. скан) Удельная теплота плавления для некоторых веществ
Уравнение Клапейрона - Клаузиуса может быть написано и в таком виде:
![]()
Это уравнение показывает, как изменяется давление, под которым находятся обе равновесные фазы, при изменении температуры.
Твердое тело может образоваться не только путем кристаллизации жидкости, но и конденсацией газа (пара) в кристалл, минуя жидкую фазу. При этом также выделяется скрытая теплота перехода, которая, однако, всегда больше скрытой теплоты плавления. Ведь образование твердого тела при определенных температуре и давлении может произойти как непосредственно из газообразного состояния, так и путем предварительного ожижения, В обоих
случаях начальное и конечное состояния одинаковы. Одинакова, значит, и разность энергий этих состояний. Между тем во втором случае выделяется, во-первых, скрытая теплота конденсации при переходе из газообразного в жидкое состояние и, во-вторых, скрытая теплота кристаллизации при переходе из жидкого в твердое состояние. Отсюда следует, что скрытая теплота при непосредственном образовании твердого тела из газообразной фазы должна быть равна сумме теплоты конденсации и кристаллизации из жидкости. Это относится только к теплотам, измеренным при температуре плавления. При более низких температурах теплота конденсации из газа возрастает.
Обратный процесс испарения твердого тела называется обычно возгонкой или сублимацией. Испаряющиеся частицы твердого тела образуют над ним пар совершенно так же, как это происходит при испарении жидкости. При определенных давлении и температуре пар и твердое тело могут находиться в равновесии. Пар, находящийся в равновесии с твердым телом, также называется насыщенным паром. Как и в случае жидкости, упругость насыщенного пара над твердым телом зависит от температуры, быстро уменьшаясь с понижением температуры, так что у многих твердых тел при обычных температурах упругость насыщенного пара ничтожно мала.
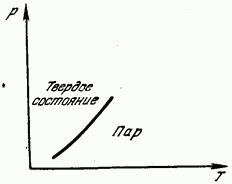
На рис. 181 показан вид кривой зависимости упругости насыщенного пара от температуры. Эта кривая является линией равновесия твердой и газообразной фаз. Область слева от кривой соответствует твердому состоянию, справа от нее - газообразному. Возгонка, так же как и плавление, связана с разрушением решетки и требует затраты необходимой для этого энергии. Эта энергия проявляется как скрытая теплота возгонки (сублимации), равная, разумеется, скрытой теплоте конденсации.. Теплота возгонки равна поэтому сумме теплот плавления и парообразования.
Большая часть веществ, способна пребывать в трёх
состояниях: жидком, твёрдом и газообразном. Эти состояния принято называть агрегатными.
 Из одного состояния в другое вещество переходит при нагревании или охлаждении, а также при изменении давления.
Из одного состояния в другое вещество переходит при нагревании или охлаждении, а также при изменении давления.
Ты уже знаешь, что если нагреть воду до температуры кипения, то она превратится в пар . То есть, перейдёт в газообразное состояние. Существует теория, которая объясняет свойства всех трёх состояний.
Она называется кинетической и основана на утверждении, что в составе вещества частицы двигаются.
Кинетическая теория.
 Большинство гипотез в науке не принимаются, пока не будут доказаны, но считаются истинными лишь потому, что объясняют те или иные явления. Объяснение свойств твёрдых, жидких и газообразных тел, исходя из энергии частиц, которые в их составе, даёт кинетическая теория. Частицы твёрдого тела расположены очень тесно друг к другу, связаны силой притяжения и не могут освободиться. Они лишь колеблются вокруг центра. Но как только мы начнём нагревать тело, то энергия его частиц начнёт расти. Вот тогда они могут оторваться друг от друга. Твёрдое тело начинает плавиться и течь. Частицы газа обладают ещё большей энергией и располагаются на ещё большем расстоянии друг от друга. Нагревание позволяет увеличить энергию частиц, те двигаются быстрее и тело переходит в другое агрегатное состояние.
Большинство гипотез в науке не принимаются, пока не будут доказаны, но считаются истинными лишь потому, что объясняют те или иные явления. Объяснение свойств твёрдых, жидких и газообразных тел, исходя из энергии частиц, которые в их составе, даёт кинетическая теория. Частицы твёрдого тела расположены очень тесно друг к другу, связаны силой притяжения и не могут освободиться. Они лишь колеблются вокруг центра. Но как только мы начнём нагревать тело, то энергия его частиц начнёт расти. Вот тогда они могут оторваться друг от друга. Твёрдое тело начинает плавиться и течь. Частицы газа обладают ещё большей энергией и располагаются на ещё большем расстоянии друг от друга. Нагревание позволяет увеличить энергию частиц, те двигаются быстрее и тело переходит в другое агрегатное состояние.
Броуновское движение.
 Английский биолог Роберт Броун в 1927 году исследовал частицы пыльцы, помещённые в жидкость, под микроскопом.
Английский биолог Роберт Броун в 1927 году исследовал частицы пыльцы, помещённые в жидкость, под микроскопом.
Он заметил, что они двигаются зигзагообразно, но объяснить это не смог.
Это хаотичное движение молекул назвали броуновским движением. Объяснение дал позже Альберт Эйнштейн.
Он высказал, что частицы, помещённые в жидкость, двигаются благодаря соударению также двигающихся, но невидимых молекул.
 Изменение состояния.
Изменение состояния.
С повышением температуры энергия частиц тела увеличивается и достигает точки плавления. Тогда происходит разрыв связей между частицами и тело плавится.
Например, парафин от свечи. Нагреваясь - стекает вниз, остывая, застывает снова в твердом состоянии.
При дальнейшем нагревании достигается точка кипения, и частицы полностью освобождаются от взаимной связи и жидкость превращается в пар.
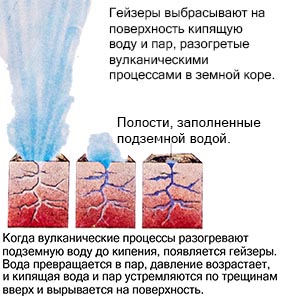 Примером может служить гейзер, который разогретый вулканическими процессами, выбрасывает на поверхность кипящую воду и пар. А вот при остывании происходит обратный процесс. Газ конденсируется и становится жидкостью, а жидкость, охлаждаясь дальше, замерзает, превращаясь в твёрдое тело.
Примером может служить гейзер, который разогретый вулканическими процессами, выбрасывает на поверхность кипящую воду и пар. А вот при остывании происходит обратный процесс. Газ конденсируется и становится жидкостью, а жидкость, охлаждаясь дальше, замерзает, превращаясь в твёрдое тело.
Углекислый газ может переходить из твердого в газообразное состояние, минуя жидкое.
Отсутствие воды на Марсе объясняется ничтожно малым атмосферным давлением.
Вода там сразу же закипает и испаряется. У разных веществ переход в другое состояние происходит при разных температурах.
Также можно изменить температуру плавления и кипения, если добавить в вещество какую-нибудь примесь или изменить давление.
Давление земной атмосферы мы называем атмосферным.
 |
 |
 Поверхностное натяжение.
Поверхностное натяжение.
Вы видели, как по поверхности водоёма спокойно разгуливают водомерки.
Они не тонут и могут передвигаться по водной глади столько, сколько вздумают.
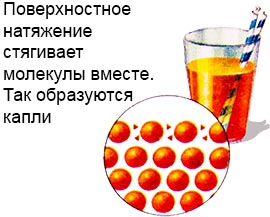 Это возможно потому, что у жидкости есть слой поверхностного натяжения.
Это возможно потому, что у жидкости есть слой поверхностного натяжения.
Молекулы этого слоя гораздо прочнее связаны, чем в глубине жидкости.
Это и создаёт своего рода плёнку на поверхности жидкости, а также формирует капли.
А веса водомерки просто не хватает разорвать её.
Испарение.
 Жидкость испаряется постоянно, даже когда не подогревается. Это происходит из-за того, что энергия молекул у поверхностного слоя значительно больше и это позволяет молекулам отрываться от поверхности, то есть испаряться.
Жидкость испаряется постоянно, даже когда не подогревается. Это происходит из-за того, что энергия молекул у поверхностного слоя значительно больше и это позволяет молекулам отрываться от поверхности, то есть испаряться.
Испаряясь, температура жидкости снижается. Это особенно характерно, когда человек потеет.
Капельки воды на коже испаряются и кожа охлаждается.
Газы.
 Газ - это вещество, которое не имеет определённого объёма и формы. Следуя кинематической теории, энергии молекул газа хватает, чтобы разорвать связи и, разлетаясь, заполнить весь объём вокруг них.
Газ - это вещество, которое не имеет определённого объёма и формы. Следуя кинематической теории, энергии молекул газа хватает, чтобы разорвать связи и, разлетаясь, заполнить весь объём вокруг них.
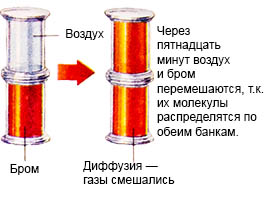
Этот процесс получил название - диффузия.
От того, как сильно молекулы газа будут ударяться о стенки сосуда, зависит величина давления газа. Если, не меняя температуру, уменьшить объём газа, за счёт уменьшения объёма сосуда, тогда давление его вырастет, так как молекулы газа будут чаще ударять в стенки сосуда. Либо если накачать новую порцию газа.
Нагреваясь, молекулы газа двигаются быстрее и на большее расстояние, газ расширяется и становится менее плотным. Если нагревая газ, ограничить его объём, то начнёт расти давление.
 |
 |
Объём, масса и плотность .
Объём - это количество пространства, которое занимает жидкость или твёрдое тело. Измеряется объём в кубических метрах. Чтобы узнать объём жидкости, нужно налить её в измерительную ёмкость. Объём твёрдого тела неправильной формы узнают по объёму вытесненной им жидкости из сосуда. Объём твердого тела правильной формы - по формуле.
На одну чашу весов помещаем взвешиваемое тело, на другую - тело с известной массой. Масса твердого, жидкого или газообразного тела говорит нам, сколько в нем содержится вещества. Масса измеряем в килограммах и граммах. Нужно понимать отличие массы и веса - величины силы тяготения действующую на тело.
 |
 |
 По плотности мы можем судить о том, насколько плотно "подогнаны" частицы составляющие тело. Например, молекулы металла располагаются ближе друг к другу, чем молекулы бумаги.
По плотности мы можем судить о том, насколько плотно "подогнаны" частицы составляющие тело. Например, молекулы металла располагаются ближе друг к другу, чем молекулы бумаги.
Значит и плотность металла выше. Плотность рассчитывается путем деления массы тела на его объем и измеряется в килограммах на кубический метр (кг/м3).
Есть прибор для измерения плотности жидкости - гидрометр. В плотной жидкости он плавает вблизи поверхности, так как его вес может вытеснить лишь, небольшой объем жидкости.
СОВМЕСТИТЕ ПОЛЕЗНОЕ С ПРИЯТНЫМ!
 Этот эксперимент показывает действие силы поверхностного натяжения. Налей в блюдечко чистой волы и добавь немного порошка, например талька.
Этот эксперимент показывает действие силы поверхностного натяжения. Налей в блюдечко чистой волы и добавь немного порошка, например талька.
Накапай в середину жидкого мыла. Что происходит?
Мыло разрушает поверхностное натяжение, т.е. силы притяжения между молекулами. Молекулы находящиеся возле стенок, крепче связаны друг с другом, поэтому всесь порошок в блюдечке собрался у бортиков.
Минеральное топливо в земной коре сконцентрировано в виде скоплений углерода (различных углей и сланцев) и углеводородов (нефтяных и газовых залежей). В науке и практике прочно сложилось представление о том, что скопления углеводородов с молекулярным весом более 60 пребывают в земной коре в жидком состоянии, а более легкие - в газообразном.
Однако советские ученые академик А. А. Трофимук, член-корреспондент АН СССР Н. В. Черский, доктор технических наук Ф. А. Требин, кандидат технических наук Ю. Ф. Макогон и кандидат геолого-минералогических наук В. Г. Васильев обнаружили свойство природного газа в определенных термодинамических условиях переходить в земной коре в твердое состояние и образовывать газогидратные залежи, причем с несравненно более высокой концентрацией газа в единице объема пористой среды, чем в обычных газовых месторождениях.
Газ переходит в твердое состояние в земной коре, соединяясь с пластовой водой при гидростатических давлениях и сравнительно низких температурах - до +25°. Экспериментальные исследования показали, что при одинаковых давлениях газогидратная залежь содержит в несколько раз больше газа, чем обычная равнообъемная газовая залежь, ибо один объем воды при переходе ее в гидратное состояние связывает до 220 объемов газа, тогда как обычная растворимость газа в воде не превышает двух - четырех объемов, а для льда она еще ниже.
Физическая характеристика газогидратной залежи резко отличается от физической характеристики обычной газовой залежи. Электропроводимость такой залежи намного ниже, чем у обычной, что позволяет разработать новые методы интерпретации геофизических характеристик с целью выявления газогидратных залежей в земной коре, а также использования этих свойств для создания новых процессов (разделения газов, хранения больших объемов газа при низких давлениях и т. д.).
Процесс формирования газогидратной залежи может сопровождаться значительным понижением пластового давления (ниже гидростатического), сокращением размеров залежи, а при наличии подтока газа и воды - значительным приростом запасов газа в залежи.
Зоны размещения газогидратных залежей сосредоточены главным образом в районах распространения многолетнемерзлых пород, а общая территория, где могут быть встречены подобные залежи, составляет более 50% территории Советского Союза, около четверти суши нашей планеты и более 90% территории Мирового океана.
Один из исследователей - начальник главка геологии Министерства газовой промышленности СССР В. Г. Васильев сообщил: "Это важный резерв природного газа, который умножит энергетические и химические ресурсы нашей страны. Кроме того, предполагается, что под дном Мирового океана также находятся месторождения газа в твердом состоянии. Логика рассуждений ученых тако* ва: океаническое дно находится под водным прессом с давлением в 300-500 ат, а при таком давлении для образования гидратов уже не нужны низкие температуры якутских недр. Поскольку океан покрывает большую часть планеты, а вечная мерзлота занимает значительную часть суши, то можно предположить, что твердое состояние газа не исключение, а правило".
Каким же способом можно добывать гидраты из-под земли, не строя шахт? Исследователи предложили переводить метан из твердого состояния в газообразное непосредственно в пласте, а затем "отбирать" его с помощью обычных скважин. Для этого есть несколько путей. Если искусственно снизить давление в скважине или поднять температуру в пласте, это вызовет распад гидрата, и свободный газ поднимается по трубам вверх. Но самое перспективное, считают ученые, это воздействовать на воду катализатором, ускоряющим освобождение молекул газа от прочной хватки молекул воды. Концентрация газа в пласте слишком велика, и высвобождать эту титаническую силу надо осмотрительно.
Можно ли сегодня говорить о промышленной эксплуатации газогидратных месторождений? На этот вопрос отвечает член-корреспондент АН СССР Н. В. Черский: "Многие сотни тысяч кубометров газа, добытого из газогидратных пластав Мессояхского месторождения в Заполярье, - говорит он, - уже поступили на Норильский горно-металлургический комбинат. Себестоимость газа примерно такая же, как обычно. Сейчас обнаружено уже более 30 залежей твердого газа. Ученые Москвы, Новосибирска, Якутска работают над проблемами их рациональной разработки и использования".
>>Строение твердых, жидких и газообразных тел
Отослано читателями из интернет-сайтов
библиотека физики , уроки физики, программа с физики, конспекты уроков физики, учебники по физике, готовые домашние задания
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные урокиАгрегатным состоянием вещества принято называть его способность сохранять свою форму и объем. Дополнительный признак – способы перехода вещества их одного агрегатного состояния в другое. Исходя из этого, выделяют три агрегатных состояния: твердое тело, жидкость и газ. Видимые свойства их таковы:
Твердое тело – сохраняет и форму, и объем. Может переходить как в жидкость путем плавления, так и непосредственно в газ путем сублимации.
- Жидкость – сохраняет объем, но не форму, то есть обладает текучестью. Пролитая жидкость стремится неограниченно растечься по поверхности, на которую вылита. В твердое тело жидкость может перейти путем кристаллизации, а в газ – путем испарения.
- Газ – не сохраняет ни формы, ни объема. Газ вне какого-нибудь вместилища стремится неограниченно расшириться во все стороны. Помешать ему в этом может только сила тяжести, благодаря чему земная атмосфера не рассеивается в космос. В жидкость газ переходит путем конденсации, а непосредственно в твердое тело может перейти путем осаждения.
Фазовые переходы
Переход вещества из одного агрегатного состояния в другое называется фазовым переходом, так как научный синоним агрегатного состояния – фаза вещества. Например, вода может существовать в твердой фазе (лед), жидкой (обычная вода) и газообразной (водяной пар).
На примере воды также хорошо демонстрируется сублимация . Вывешенное во дворе на просушку в морозный безветренный день белье тут же промерзает, но спустя некоторое время оказывается сухим: лед сублимирует, непосредственно переходя в водяной пар.
Как правило, фазовый переход из твердого тела в жидкость и газ требует нагрева, но температура среды при этом не повышается: тепловая энергия уходит на разрыв внутренних связей в веществе. Это так называемая скрытая теплота фазового перехода . При обратных фазовых переходах (конденсации, кристаллизации) эта теплота выделяется.
Именно поэтому так опасны ожоги паром. Попадая на кожу, он конденсируется. Скрытая теплота испарения/конденсации воды очень велика: вода в этом отношении – аномальное вещество; именно поэтому и возможна жизнь на Земле. При ожоге паром скрытая теплота конденсации воды «прошпаривает» обожженное место очень глубоко, и последствия парового ожога оказываются куда тяжелее, чем от пламени на такой же площади тела.
Псевдофазы
Текучесть жидкой фазы вещества определяется ее вязкостью, а вязкость – характером внутренних связей, которым посвящен следующий раздел. Вязкость жидкости может быть очень высокой, и такая жидкость может течь незаметно для глаза.
Классический пример – стекло. Оно не твердое тело, а очень вязкая жидкость. Обратите внимание, что листы стекла на складах никогда не хранят прислоненными наискось к стене. Уже через несколько дней они прогнутся под собственной тяжестью и окажутся непригодными к употреблению.
Другие примеры псевдотвердых тел – сапожный вар и строительный битум . Если забыть угловатый кусок битума на крыше, за лето он растечется в лепешку и прилипнет к основе. Псевдотвердые тела отличить от настоящих можно по характеру плавления: настоящие при нем либо сохраняют свою форму, пока враз не растекутся (припой при пайке), либо оплывают, пуская лужицы и ручейки (лед). А очень вязкие жидкости постепенно размягчаются, как тот же вар или битум.
Чрезвычайно вязкими жидкостями, текучесть которых не заметна на протяжении многих лет и десятилетий, являются пластики. Высокая их способность сохранять форму обеспечивается огромным молекулярным весом полимеров, во многие тысячи и миллионы атомов водорода.
Структура фаз вещества
В газовой фазе молекулы или атомы вещества отстоят друг от друга очень далеко, во много раз больше, чем расстояние между ними. Взаимодействуют они между собой изредка и нерегулярно, только при столкновениях. Само взаимодействие упругое: столкнулись, как твердые шарики, и тут же разлетелись.
В жидкости молекулы/атомы постоянно «чувствуют» друг друга за счет очень слабых связей химической природы. Эти связи все время рвутся и тут же опять восстанавливаются, молекулы жидкости непрерывно перемещаются относительно друг друга, поэтому жидкость и течет. Но чтобы превратить ее в газ, нужно разорвать все связи сразу, а на это нужно очень много энергии, потому жидкость и сохраняет объем.
Вода в этом отношении отличается от прочих веществ тем, что ее молекулы в жидкости связаны так называемыми водородными связями, довольно прочными. Поэтому вода и может быть жидкостью при нормальной для жизни температуре. Многие вещества с молекулярной массой в десятки и сотни раз больше, чем у воды, в нормальных условиях – газы, как хотя бы обычный бытовой газ.
В твердом теле все его молекулы прочно стоят на своих местах благодаря сильным химическим связям между ними, образуя кристаллическую решетку. Кристаллы правильной формы требуют для своего роста особых условий и потому в природе встречаются редко. Большинство твердых тел представляют собой прочно сцепленные силами механической и электрической природы конгломераты мелких и мельчайших кристалликов – кристаллитов.
Если читателю доводилось видеть, например, треснувшую полуось автомобиля или чугунный колосник, то зерна кристаллитов на сломе там видны простым глазом. А на осколках разбитой фарфоровой или фаянсовой посуды их можно наблюдать под лупой.
Плазма
Физики выделяют и четвертое агрегатное состояние вещества – плазму. В плазме электроны оторваны от атомных ядер, и она представляет собой смесь электрически заряженных частиц. Плазма может быть очень плотной. Например, один кубический сантиметр плазмы из недр звезд – белых карликов, весит десятки и сотни тонн.
Плазму выделяют в отдельное агрегатное состояние потому, что она активно взаимодействует с электромагнитными полями из-за того, что ее частицы заряжены. В свободном пространстве плазма стремится расшириться, остывая и переходя в газ. Но под воздействием электромагнитных полей она может вне сосуда сохранять форму и объем, как твердое тело. Это свойство плазмы используется в термоядерных энергетических реакторах – прообразах энергоустановок будущего.






