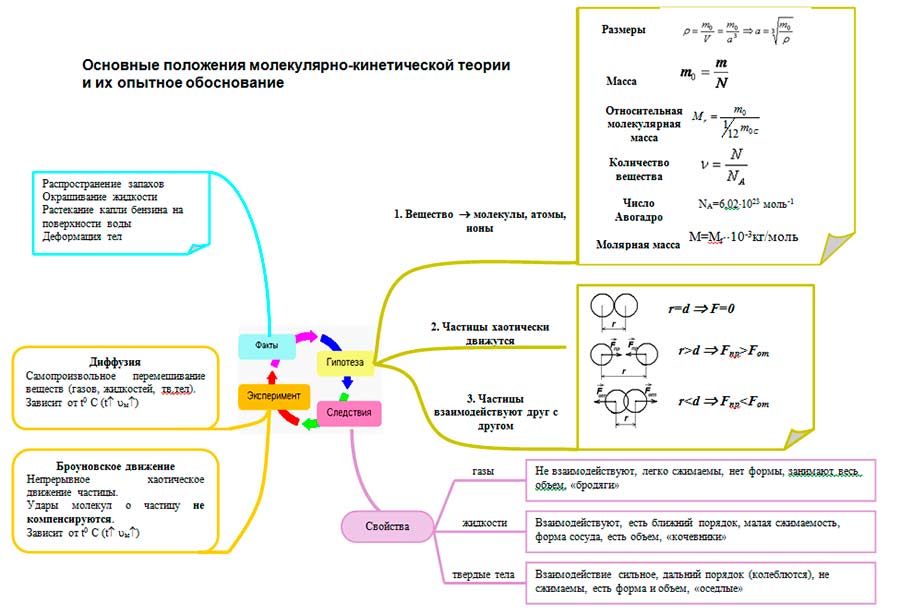
Сформулируйте основные положения молекулярно кинетической. Все тела состоят из частиц – атомов, молекул, ионов. Основные положения молекулярно-кинетической теории
Основные положения молекулярно-кинетической теории
В чем заключается основная задача молекулярной физики? Что такое молекулярно-кинетическая теория? Сформулируйте основные положения молекулярно-кинетической теории. Какие наблюдения и эксперименты подтверждают основные положения молекулярно-кинетической теории? Что такое молекула? атом?
В чем заключается основная задача молекулярной физики? Объяснить свойства макроскопических тел и тепловых процессов, происходящих в них, на основе представления о том, что все тела состоят из отдельных, беспорядочно движущихся частиц.
Что такое молекулярно-кинетическая теория? Молекулярно-кинетическая теория (МКТ) - теория, рассматривающая строение вещества с точки зрения трёх основных приближенно верных положений.
Сформулируйте основные положения молекулярно-кинетической теории. все тела состоят из частиц, между которыми есть промежутки частицы находятся в непрерывном хаотическом движении частицы взаимодействуют друг с другом
Какие наблюдения и эксперименты подтверждают основные положения молекулярно-кинетической теории? Диффузия Броуновское движение Опыты Дюнуайе и Штерна
Что такое молекула? атом? Молекула - это самостоятельная частица, обязательная составляющая любого вещества, которая обладает всеми химическими и физическими свойствами этого вещества. Любая молекула состоит из самых простых самостоятельных частиц – атомов. Атом - наименьшая возможная частица любого из простейших химических веществ, называемых элементами.
Основные положения молекулярно-кинетической теории были подвергнуты всесторонней экспериментальной проверке. Наиболее известными экспериментами, демонстрирующими молекулярную структуру вещества и подтверждающими молекулярно-кинетическую теорию, являются опыт Дюнуайе и опыт Отто Штерна (1888 - 1969), выполненные соответственно в 1911 и 1920 годах. В этих опытах молекулярные пучки создавались путем испарения различных металлов, и поэтому молекулы исследуемых газов представляли собой атомы этих металлов. Такие эксперименты позволили проверить предсказания молекулярно-кинетической теории, которые она дает для случая газов, молекулы которых можно рассматривать как материальные точки, то есть для одноатомных газов.
Опыт Дюнуайе Схема опыта Дюнуайе с молекулярными пучками показана на рис. 1. Стеклянный сосуд, материал которого выбирался таким, чтобы обеспечивать высокий вакуум, был разделён на три отделения 1, 2 и 3 двумя перегородками с диафрагмами 4. В отделении 1 находился газ, в качестве которого в данном эксперименте были использованы пары натрия, полученные при его нагревании. Молекулы этого газа могли свободно пролетать через отверстия в диафрагмах, коллимирующие молекулярный пучок 5, то есть позволяющие ему проходить только в пределах малого телесного угла. В отделениях 2 и 3 был создан сверхвысокий вакуум, такой, чтобы атомы натрия могли пролетать их без столкновений с молекулами воздуха. Нерассеянный молекулярный пучок оставлял на торцевой стенке сосуда след 6. Но даже в случае сверхвысокого вакуума имело место рассеяние молекулярного пучка на краях диафрагм 4. Поэтому на торцевой стенке сосуда имелась область "полутени" 7, в которой оставляли следы частицы, претерпевшие рассеяние. По мере ухудшения вакуума в отделении 3 область 7 увеличивалась. По величине размытости следа рассеянных атомов натрия можно было оценить длину их свободного пробега. Такие оценки были проведены Максом Борном (1882 - 1970) на основании результатов опытов, аналогичных опыту Дюнуайе.
Опыт Отто Штерна Одними из самых знаменитых опытов с молекулярными пучками были эксперименты Штерна, в которых впервые удалось осуществить прямые измерения молекулярных скоростей. Наиболее известная схема опыта Штерна показана на рис. 2. Платиновая нить 1, на которую была нанесена капля серебра, находилась на оси двух коаксиальных цилиндров 2 и 3, причём в цилиндре 2 имелась щель, параллельная его оси. Цилиндры могли вращаться вокруг своей оси. В опытах Штерна угловая скорость их вращения составляла 2...3 тысячи оборотов в минуту. При пропускании через платиновую нить электрического тока она разогревалась до максимальной температуры порядка 1200 oС. В результате этого серебро начинало испаряться, его атомы пролетали через щель 4 цилиндра 2 и оседали на поверхности цилиндра 3, оставляя на нём след 5. Для не вращающихся цилиндров, атомы серебра, двигаясь прямолинейно, более-менее равномерно оседали на поверхности внешнего цилиндра, внутри сектора, соответствующего прямолинейному их распространению. Вращение цилиндров приводило к искривлению траектории молекул в системе отсчёта, связанной с цилиндрами и, как следствие, к изменению положения атомов серебра, осевших на внешний цилиндр. Анализируя плотность осевших молекул, можно было оценить характеристики распределения молекул по скоростям, в частности, максимальную и минимальную скорости, соответствующие краям следа, а также найти наиболее вероятную скорость, соответствующую максимуму плотности осевших молекул.
Рис. 1 - Схема опыта Дюнуайе 1 - отделение, заполненное газом 2 и 3 - отделения со сверхвысоким вакуумом 4 - перегородки с диафрагмами 5 - молекулярный пучок 6 - след не рассеянного пучка 7 - след рассеянных молекул
Рис.2 - Схема опыта Штерна 1 - источник молекул 2 и 3 - вращающиеся цилиндры 4 - щель, ограничивающая молекулярный пучок 5 - след молекулярного пучка
Диффузия Диффузия - это явление взаимного проникновения молекулы одного вещества между молекулами другого. Диффузия может происходить в газах (очень быстро), в жидкостях (быстро), в металлах (очень медленно).
Броуновское движение Броуновское движение – это тепловое движение частиц взвешенных в жидкости или газе. Причинами броуновского движения является: 1. Беспорядочное движение молекул 2. Отклонение от среднего значения, производимого ими давления. Установлено следующие: 1. Броуновское движение осуществляется при любой t и длится бесконечно долго. 2. Броуновские частицы совершают беспорядочные траектории. 3. Характер движения броуновской частицы не зависит от ее природы Броуновское движение является прямым доказательством беспорядочного движения молекул.
Нас окружают разнообразные предметы. Мы можем увидеть, что это либо твердые тела, либо жидкости, либо газы. Возникает масса вопросов обо всем, что нас окружает. Ответы на многие вопросы дает молекулярно-кинетическая теория .
Молекулярно-кинетическая теория – это совокупность воззрений, используемых для описания наблюдаемых и измеряемых свойств вещества на основе изучения свойств атомов и молекул данного вещества, их взаимодействия и движения.
Основные положения молекулярно-кинетической теории
Все тела состоят из частиц – атомов, молекул, ионов.
Все частицы находятся в непрерывном хаотическом тепловом движении.
Между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Таким образом, в молекулярно-кинетической теории объектом исследования является система, состоящая из большого количества частиц – макросистема . Для объяснения поведения такой системы законы механики не применимы. Поэтому основным методом исследования является статистический метод изучения свойств вещества.
Для объяснения и предсказания явлений важно знать основные характеристики молекул :
- Размеры

Оценка размера молекулы может быть сделана как размер кубика a в котором содержится одна молекула, исходя из плотности твердых или жидких веществ и массы одной молекулы:

- Масса молекул
Отношение массы вещества m к числу молекул N в данном веществе:
- Относительная молекулярная масса
Отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:
- Количество вещества
Количество вещества равно отношению числа частиц N в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле веществаN А:

- Постоянная Авогадро
Количество молекул, содержащихся в 1 моль вещества.
- Молярная масса
Молярной массой вещества называют массу вещества, взятого в количестве 1 моля.
В Международной системе единиц молярная масса вещества выражается в кг/моль .
- Взаимодействие (количественно на основе опытов)

Для взаимодействия молекул характерно одновременно и притяжение, и отталкивание: на расстояниях r
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях. С точки зрения МКТ агрегатные состояния различаются по значению среднего расстояния между молекулами и характеру движения молекул друг относительно друга .
Основные положения молекулярно-кинетической теории неоднократно подтверждались различными физическими экспериментами. Например, исследованием:
А) Диффузии
Б) Броуновского движения
Краткие итоги
Молекулярно-кинетическая теория объясняет строение и свойства тел на основе движения и взаимодействия атомов, молекул и ионов. В основе МКТ лежат три положения , которые полностью подтверждены экспериментально и теоретически:
1) все тела состоят из частиц – молекул, атомов, ионов;
2) частицы находятся в непрерывном хаотическом тепловом движении;
3) между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Молекулярное строение вещества подтверждается непосредственным наблюдением молекул в электронных микроскопах, а также растворением твердых веществ в жидкостях, сжимаемостью и проницаемостью вещества. Тепловое движение – броуновским движением и диффузией. Наличие межмолекулярного взаимодействия прочностью и упругостью твердых тел, поверхностным натяжением жидкостей.
Опорный конспект к уроку:
Вопросы для самоконтроля по блоку «Основные положения молекулярно-кинетической теории и их опытное обоснование»
- Сформулируйте основные положения молекулярно-кинетической теории.
- Какие наблюдения и эксперименты подтверждают основные положения молекулярно-кинетической теории?
- Что такое молекула? атом?
- Что называют относительной молекулярной массой? Какая формула выражает это понятие?
- Что называют количеством вещества? Какая формула выражает это понятие? Какова единица количества вещества?
- Что называют постоянной Авогадро?
- Что такое молярная масса вещества? Какая формула выражает смысл этого понятия? Какова единица молярной массы?
- Какова природа межмолекулярных сил?
- Какими свойствами обладают силы молекулярного взаимодействия?
- Как силы взаимодействия зависят от расстояния между ними?
- Опишите характер движения молекул в газах, жидкостях и твердых телах.
- Каков характер упаковки частиц у газов, жидкостей и твердых тел?
- Каково среднее расстояние между молекулами у газов, жидкостей и твердых тел?
- Перечислите основные свойства газов, жидкостей, твердых тел.
- Что называют броуновским движением?
- О чем свидетельствует броуновское движение?
- Что называют диффузией? Приведите примеры диффузии в газах, жидкостях и твердых телах.
- 18. Как зависит скорость диффузии от температуры тел?
ОПРЕДЕЛЕНИЕ
Атом — наименьшая частица данного химического элемента. Все существующие в природе атомы представлены в периодической системе элементов Менделеева.
Атомы соединяются в молекулу за счет химических связей, основанных на электрическом взаимодействии. Число атомов в молекуле может быть разным. Молекула может состоять из одного, из двух, трех и даже нескольких сотен атомов.
ОПРЕДЕЛЕНИЕ
Молекула - наименьшая частица данного вещества, обладающая его химическими свойствами.
Молекулярно-кинетическая теория - учение о строении и свойствах вещества на основе представлений о существовании атомов и молекул.
Основоположником молекулярно-кинетической теории является М.В. Ломоносов (1711-1765), который сформулировал ее основные положения и применил их к объяснению различных тепловых явлений.
Основные положения молекулярно-кинетической теории
Основные положения МКТ:
- все тела в природе состоят из мельчайших частиц (атомов и молекул);
- частицы находятся в непрерывном хаотическом движении, которое называется тепловым;
- частицы взаимодействуют друг с другом: между частицами действуют силы притяжения и отталкивания, которые зависят от расстояния между частицами.
Молекулярно-кинетическая теория подтверждается многими явлениями.
Смешивание различных жидкостей, растворение твердых тел в жидкостях объясняется перемешиванием молекул различного рода. При этом объем смеси может отличаться от суммарного объема входящих в нее компонент. что говорит о разных размерах молекулярных соединений.
ОПРЕДЕЛЕНИЕ
Диффузия - явление проникновения двух или нескольких соприкасающихся веществ друг в друга.
Наиболее интенсивно диффузия протекает в газах. Распространение запахов обусловлено диффузией. Диффузия свидетельствует о том, что молекулы находятся в постоянном хаотическом движении. Также явление диффузии свидетельствует о том, что между молекулами есть промежутки, т.е. вещество является дискретным.
ОПРЕДЕЛЕНИЕ
Броуновское движение - тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе.
Это явление впервые наблюдал английский ботаник Р. Броун в 1827 г. Наблюдая в микроскоп цветочную пыльцу, взвешенную в воде, он увидел, что каждая частица пыльцы совершает быстрые беспорядочные движения, перемещаясь на некоторое расстояние. В результате отдельных перемещений каждая частица пыльцы двигалась по зигзагообразной траектории (рис. 1, а).
Рис.1. Броуновское движение: а) траектории движения отдельных частиц, взвешенных в жидкости; б) передача импульса молекулами жидкости взвешенной частице.
Дальнейшие исследования броуновского движения в различных жидкостях и с различными твердыми частицами показали, что это движение становится тем интенсивнее, чем меньше размеры частиц и чем выше температура опыта. Это движение никогда не прекращается и не зависит от каких-либо внешних причин.
Р. Броун не смог дать объяснение наблюдаемому явлению. Теория броуновского движения была построена А. Эйнштейном в 1905 г. и получила экспериментальное подтверждение в опытах французского физика Ж. Перрена (1900-1911 гг.).
Молекулы жидкости, которые находятся в постоянном хаотическом движении при столкновении со взвешенной частицей передают ей некоторый импульс (рис.1, б). В случае частицы больших размеров число налетающих на нее со всех сторон молекул велико, их удары в каждый момент времени компенсируются, и частица остается практически неподвижной. Если же размер частицы очень мал, то удары молекул не компенсируются - с одной стороны об нее может удариться большее число молекул, чем с другой, в результате чего частица придет в движение. Именно такое движение под влиянием беспорядочных ударов молекул и совершают броуновские частицы. Хотя броуновские частицы по массе в миллиарды раз превосходят массу отдельных молекул и движутся с очень малыми скоростями (по сравнению со скоростями молекул), все же их движение можно наблюдать в микроскоп.
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
Молекулярно-кинетической теорией
называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1.
Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов.
Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами
пренебрежимо мало.
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение .
Броуновское движение - э то тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном.
Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую.
Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии.
Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга.
Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов. Так, если в двух частях сосуда, разделенных перегородкой, находятся кислород O 2 и водород H 2 , то после удаления перегородки начинается процесс взаимопроникновения газов друг в друга, приводящий к образованию взрывоопасной смеси – гремучего газа.
Диффузия и броуновское движение – родственные явления. Взаимопроникновение соприкасающихся веществ друг в друга и беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходят вследствие хаотичного теплового движения молекул.
Дайте определение понятию «теплоемкость». Какие виды теплоемкостей применяют в теплотехнических расчетах. Объясните от чего зависит величина теплоёмкости газов? Приведите запись уравнения Майера.
Теплоемкость – величина, равная отношению сообщаемой телу или отводимой от него теплоты к соответствующему изменению его температуры: C= , [Дж/К]
где С – теплоемкость; Q – подведенная (или отведенная) теплота; ∆Т – изменение температуры тела.
В теплотехнических расчетах применяют различные виды приведенных теплоемкостей (отнесенных к единице массы, количества и объема)
Массовой (или удельной) теплоемкостью называется отношение теплоемкости тела к его массе: с = ,
где с – массовая теплоемкость; m – масса тела.
Молярной теплоемкостью называется отношение теплоемкости к количеству вещества: µ с = ,
где μ c – молярная теплоемкость; n – количество вещества.
Объемной теплоемкостью называется отношение теплоемкости к 1 м 3 газа при нормальных условиях: с`= ,
где с`– объемная теплоемкость; v 0 – объем газа при нормальных условиях.
В СИ массовая теплоемкость с измеряется в Дж/кг*К, молярная теплоемкость µ с – Дж/моль*К, объемная теплоемкость с" – Дж/м 3 *К.
Теплоемкости газов и паров являются переменными величинами; для идеальных газов они зависят от их температуры, а для реальных газов и паров также и от их давления.
Теплоемкость газов в сильной степени зависит от тех условий, при которых происходят процессы их нагревания или охлаждения. Среди этих процессов в технике наиболее важное значение имеют процессы, протекающие при постоянном объеме газа (изохорный процесс) и при постоянном давлении газа (изобарный процесс).
В связи с этим различают теплоемкость при постоянном объеме (с v) и теплоемкость при постоянном давлении (с p).
Количественное соотношение между с р и с v устанавливают с помощью уравнения Майера: с р − с v = R, где R-универсальная газовая постоянная.
Таким образом, разность между изобарной и изохорной теплоемкостями для всех газов есть величина постоянная и равна универсальной газовой постоянной.
Дайте определение понятию «дисперсные системы». Назовите два основных признака дисперсных систем. По каким признакам классифицируют дисперсные системы? Используя каждый признак, опишите дисперсные системы.
Дисперсными называют системы, состоящие из множества малых частиц, распределенных в жидкой, твердой или газообразной среде.
Для всех дисперсных систем характерны два основных признака : высокая раздробленность (дисперсность) и гетерогенность.
Гетерогенность дисперсных систем проявляется в том, что эти системы состоят из двух (или более) фаз. Все дисперсные системы состоят из сплошной фазы - дисперсионной среды и прерывистой фазы (частиц) - дисперсной фазы .
Высокая дисперсность придает веществам новые качественные признаки: повышенную реакционную способность и растворимость, интенсивность окраски, светорассеяние и т. п.
Классификацию дисперсных систем проводят на основе различных признаков, а именно: 1) по размеру частиц, 2) по агрегатному состоянию дисперсной фазы и дисперсионной среды, 3) по характеру взаимодействия частиц дисперсной фазы между собой и со средой.
В зависимости от размера частиц
дисперсные системы подразделяют на группы:
1) грубодисперсные системы - системы, у которых частицы имеют размер 1000 нм и более;
2) коллоидные системы - частицы имеют размер от 1 до 500 нм.
3) истинные растворы – частицы имеют размер до 1 нм.
По агрегатному состоянию дисперсной фазы и дисперсионной среды системы классифицируют следующим образом:
По отношению коллоидных частиц к дисперсионной среде выделяют лиофильные и лиофобные системы (от греч. "philia" - любовь, "phobia" - ненависть ).
Лиофильные системы - те, у которых коллоидные частицы связаны с молекулами дисперсионной среды и имеют из них оболочку (если дисперсионная среда - вода, системы называются гидрофильными). Например, к лиофильным коллоидным системам относят растворы, образующиеся при растворении природных или синтетических ВМС. Таковы растворы белков, крахмала, эфиров целлюлозы и разнообразных смол, как природных так и синтетических.
Лиофобные системы (гидрофобные) - те, у которых коллоидные частицы слабо связаны с молекулами дисперсионной среды или растворителя. Например, к лиофобным системам относятся золи драгоценных металлов, золи серы, золи гидроксидов железа, алюминия и т.д. Эти системы характеризуются агрегативной неустойчивостью и требуют стабилизации.
7. Дайте определение понятию «химическое равновесие». Сформулируйте принцип Ле-Шателье. Обоснуйте, как влияет изменения давления на положение равновесия реакции: N 2 +3H 2 ⇄2NH 3 . Для этого процесса составьте выражение константы равновесия и спрогнозируйте ее значение, если равновесные концентрации реагирующих веществ азота, водорода и аммиака соответственно равны 3 моль/л, 9 моль/л, 4 моль/л.
Химическое равновесие
Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Принцип Ле Шателье: если на систему, находящуюся в состоянии равновесия, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию (или ослабление) внешнего воздействия.
Реакция N 2 +3H 2 ⇄2NH 3 протекает с участием газообразных веществ и является обратимой. Давление существенно влияет на положение равновесия в таких реакциях, т.к. они сопровождаются изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам реакции: при повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
По уравнению реакции N 2 +3H 2 ⇄2NH 3 видно, что количество исходных газообразных веществ равно 4 моль (1 моль азота и 3 моль водорода), а количество газообразных продуктов равно 2 моль (2 моль аммиака). Следовательно, при увеличении давления химическое равновесие сместится вправо, в сторону меньшего количества газообразных веществ, а при уменьшении давления – влево, в сторону исходных веществ.
Константа равновесия - величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Дано: =3 моль/л, =9 моль/л, =4 моль/л
Найти: К с -?
Решение: 1) Запишем уравнение реакции N 2 +3H 2 ⇄2NH 3
2) Константа равновесия для этой реакции имеет выражение: К с = 2 /* 3 ; 3) вычислим константу равновесия К с =4 2 /3*9 3 =0,0073
Ответ: К с =0,0073
8. Дайте определение понятию «дисперсная система». Приведите классификацию дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсной среды. Систематизируйте данные знания и определите агрегатные состояния дисперсной фазы и дисперсионной среды для предложенных систем: нефть; пыльный воздух. Спрогнозируйте и объясните устойчивость данных коллоидных систем.
Дисперсная система - это образования из двух или более числа фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически.
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
| Обозначение | Дисперсная фаза | Дисперсионная среда | Название и пример |
| Г/Г | Газообразная | Газообразная | Дисперсная система не образуется |
| Ж/Г | Жидкая | Газообразная | Аэрозоли: туманы, облака |
| Т/Г | Твёрдая | Газообразная | Аэрозоли (пыли, дымы), порошки |
| Г/Ж | Газообразная | Жидкая | Газовые эмульсии и пены |
| Ж/Ж | Жидкая | Жидкая | Эмульсии: нефть, крем, молоко |
| Т/Ж | Твёрдая | Жидкая | Суспензии и золи: пульпа, ил, взвесь, паста |
| Г/Т | Газообразная | Твёрдая | Пористые тела |
| Ж/Т | Жидкая | Твёрдая | Капиллярные системы: жидкость в пористых телах, грунт, почва |
| Т/Т | Твёрдая | Твёрдая | Твёрдые гетерогенные системы: сплавы, бетон, композиционные материалы |
В свою очередь эти системы классифицируются по степени дисперсности.
Системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, а с неодинаковыми по размеру частицами - полидисперсными. Как правило, окружающие нас реальные системы полидисперсны.
Устойчивость дисперсных систем
– это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
1. К осаждению
дисперсной фазы - характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называется седиментационная (кинетическая)
устойчивость.
2. К агрегации
ее частиц. Агрегативная устойчивость
– это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически
и термодинамически
. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной системы.
Дисперсионная система: пыльный воздух состоит из газообразной дисперсионной среды и твердой дисперсионной фазы. Эта система кинетически и агрегативно неустойчива.
Дисперсионная система: нефть состоит из жидкой дисперсионной среды и жидкой дисперсионной фазы. А система кинетически и агрегативно устойчива.
9. Дайте определение понятию «смещение химического равновесия». Прокомментируйте, какие факторы влияют и какие не влияют на положение химического равновесия? Сформулируйте принцип Ле-Шателье. Спрогнозируйте, в каком направлении смещается равновесие при увеличении давления, температуры, концентрации исходных веществ для реакции:
+СаСОз + O(пар)⇄Ca(HCO 3 +Q
Химическое равновесие - динамическое состояние химической системы, в которой обратимо протекает химическая реакция, причём скорости прямой и обратной реакции равны между собой.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Изменение этих параметров вызывает изменение скоростей протекающих химических реакций и смещает химическое равновесие.
Факторы, влияющие на химическое равновесие : температура, давление, концентрация.
1) температура: при увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
2) давление: при увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции - в сторону исходных веществ.






