Строение и энергетические свойства кристаллов твердых тел
По способности проводить электрический ток все твердотельные материалы принято делить на проводники, полупроводники и диэлектрики. К проводникам относят материалы с проводимостью? > 10 6 Ом -1 см -1 ; к ним относятся металлы, в которых высокая проводимость обеспечивается высокой концентрацией электронов проводимости. В диэлектриках при комнатной температуре электронов очень мало, и их проводимость мала? < 10 -10 Ом -1 см -1 . В промежуточную группу попадают полупроводники, которые могут иметь концентрацию электронов, близкую к нулю (тогда они являются диэлектриками) и близкую к концентрации электронов в металле (тогда они являются проводниками).
Металлы и полупроводники помимо того, что они имеют разную электропроводность, отличаются также и зависимостью электропроводности от температуры. В металлах электропроводность с повышением температуры, как правило, падает почти по линейному закону. В полупроводниках, в которых отсутствуют дефекты и примеси (их принято называть собственными) с ростом температуры проводимость растет примерно по экспоненциальному закону:
Чтобы рассмотреть структуру и энергетические свойства кристаллических твердых тел, к которым относятся кремний и германий (полупроводники, получившие наибольшее распространение для изготовления полупроводниковых приборов), следует сначала обратиться к энергетическим свойствам отдельного атома.
Атом состоит из ядра, вокруг которого движутся электроны, создавая электронную оболочку. Суммарный отрицательный заряд электронов уравновешивает положительный заряд ядра, так что в нормальном состоянии атом электрически нейтрален. Согласно квантовой теории, электроны атома могут обладать только строго определенными значениями энергии, именуемыми разрешенными. Эти значения энергии называют энергетическими уровнями. Энергетические уровни электронов отделены друг от друга запрещенными интервалами. Двигаясь вокруг ядра по определенным орбитам, электроны удалены от ядра на разные расстояния и, соответственно, обладают разной по величине энергией: чем дальше от ядра, тем больше энергия электрона и тем слабее он связан с ядром.
Электроны наружного слоя электронной оболочки называют валентными. Они обладают наибольшей энергией и слабее всего связаны с ядром. Графически энергетический спектр электронов в отдельном атоме можно представить в виде энергетической диаграммы. Пример такой диаграммы представлен на рис. 1.1, а. По вертикали отложены значения энергии, а соответствующие энергетические уровни показаны горизонтальными линиями. В соответствии с принципом Паули на одном энергетическом уровне могут находиться одновременно не более двух электронов, имеющих разные направления вращения вокруг своей оси (противоположные спины).
Если атом находится в нормальном состоянии и не поглощает извне энергию, то все нижние разрешенные энергетические уровни заняты электронами; переход электрона с одного уровня на другой невозможен. Более высокие разрешенные уровни остаются не занятыми электронами и называются свободными. Переход электрона на более высокий свободный энергетический уровень, т.е. на более удаленную от ядра орбиту, возможен лишь при поглощении им извне строго определенной порции (кванта) энергии (тепловой, световой, электрической, магнитной), равной разности значений энергии свободного и занятого этим электроном уровней. В этом случае атом переходит в возбужденное состояние.
Возбужденное состояние атома очень неустойчиво. Оно длится всего стомиллионную долю секунды, и атом возвращается в нормальное состояние, что сопровождается переходом электрона обратно на свой прежний энергетический уровень. Переход атома из возбужденного в нормальное состояние сопровождается выделением избытка энергии в виде кванта электромагнитных излучений.
Если электрон получит достаточный квант энергии, он отрывается от атома, происходит ионизация атома: он расщепляется на свободный электрон и положительный ион. Обратный процесс – соединение свободного электрона и положительного иона в нейтральный атом – носит название рекомбинации и сопровождается выделением избытка энергии в виде кванта излучения. Выделяемая энергия равна энергии, затраченной ранее на ионизацию атома.
При образовании кристаллов твердого тела возникает взаимодействие между атомами, в результате которого разрешенные уровни энергии отдельных атомов расщепляются на N подуровней, образуя энергетические зоны (рис.1.1, б). При этом, как и в отдельном атоме, на одном энергетическом уровне не может быть более двух электронов с противоположными спинами (сохраняется принцип Паули). Поскольку количество подуровней (N) велико (в 1 см 3 твердого тела находится около 10 22 – 10 23 атомов), то энергетическое расстояние между подуровнями весьма мало, и электрон способен перемещаться с подуровня на подуровень от дна зоны к потолку даже при небольших внешних энергетических воздействиях, т.е. он ведет себя, как свободный. Это, однако, справедливо только в том случае, если верхние энергетические уровни в зоне не заняты, т.е. зона заполнена не полностью.
Уровни энергии отдельного атома, занятые электронами при температуре абсолютного нуля (Т = 0 К), образуют в кристалле заполненные зоны, верхняя из которых, занятая валентными электронами, называется валентной зоной.
Разрешенные более высокие уровни энергии атома, не занятые электронами при
Т = 0 К, образуют в кристалле свободные зоны. Ближайшую к валентной зоне свободную зону называют зоной проводимости, так как попавшие туда электроны могут перемещаться между атомами и создавать электрический ток. Электроны, находящиеся в заполненной зоне, перемещаться под действием поля (и соответственно набирать энергию) не могут, поскольку все энергетические уровни заняты, а согласно принципу Паули электрон не может переходить с занятого состояния на занятое. Поэтому электроны полностью заполненной валентной зоны не участвуют в создании электропроводности.
Между зоной проводимости и валентной зоной находится запрещенная зона E g (она измеряется в электрон-вольтах (эВ)), в которой согласно законам квантовой механики электроны находиться не могут (подобно тому, как электроны в атоме не могут иметь энергии не соответствующие энергиям электронных оболочек). Ширина запрещенной зоны является основным параметром, определяющим электрические свойства твердого тела.
По характеру заполнения зон электронами все тела можно разделить на две большие группы:
- к первой группе относят тела, у которых над целиком заполненными зонами расположена зона, заполненная лишь частично (рис. 1.2, а). Такая зона возникает в том случае, когда атомный уровень, из которого она образуется, заполнен в атоме не полностью. Наличие зоны, заполненной лишь частично, присуще металлам. У металлов запрещенная зона отсутствует;
- ко второй группе относят тела, у которых над целиком заполненными зонами расположены свободные зоны (рис. 1.2, б, в). Типичным примером таких тел являются химические элементы IV группы таблицы Менделеева: углерод в модификации алмаза, кремний, германий и серое олово, имеющее структуру алмаза. К этой же группе тел относятся многие химические соединения – оксиды металлов, нитриды, карбиды, галогениды щелочных металлов и т.д.
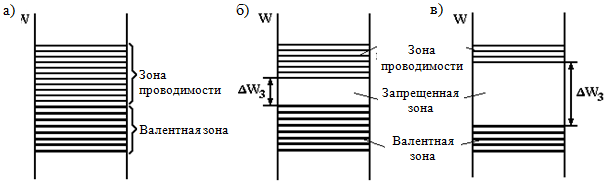
По ширине запрещенной зоны тела второй группы условно делят на диэлектрики и полупроводники. К диэлектрикам относят тела, имеющие относительно широкую запрещенную зону. У типичных диэлектриков Е g > 3 эВ. Так, у алмаза E g = 5,2 эВ; у нитрида бора E g = 4,6 эВ; у А1 2 О 3 E g = 7 эВ и т.д.
К полупроводникам относят тела, имеющие сравнительно узкую запрещенную зону (рис. 1.2, б). У типичных полупроводников E g ? 1 эВ, например:
- у германия Е g = 0,72 эВ;
- у кремния E g = 1,12 эВ;
- у антимонида индия E g = 0,17 эВ;
- у арсенида галлия E g = 1,43 эВ и т.д.
Энергетические диаграммы металлов, полупроводников и диэлектриков при
T = 0 К представлены на рис. 1.2. На этих диаграммах валентная зона, заполненная электронами, показана более толстыми сплошными линиями, а зона проводимости, в которой при этих условиях нет электронов, – тонкими линиями.
Ответы на коллоквиум №2 по физике.
Энергетические уровни атомов и молекул. Квантовые переходы в атомах и молекулах. Поглощение и излучение энергии атомами и молекулами, спектры поглощения и излучения.
Электронные энергетические уровни в атоме Электроны в невозбужденном состоянии заполняют нижние энерг. уровни, а верхние уровни - свободны. Если атом получает энергию в результате столкновения с другими атомами или поглощая квант света, то он переходит в возбужденное состояние и какой-либо электрон атома переходит с нижнего уровня на один из верхних. Через небольшой промежуток времени он возвращается на нижний уровень, испуская квант света определенной частоты.
Молекулы состоят из взаимодействующих атомов, внутримолекулярное движение сложнее внутриатомного. В молекуле кроме движения электронов относительно ядер происходит колебательное движение атомов около их положения равновесия и вращательное движение молекулы как целого. Электронному, колебательному и вращательному движению молекуле соответствует три типа уровней энергии: Еэл, Екол, Евр. Полная энергия молекулы равна: Е=Еэл+Евр+Екол. Согласно квантовой механике колебательная и вращательная энергия молекул, так так же как и электронная энергия, имеют квантовый характер, т.е. изменяются дискретно. Расстояние между колебательными уровнями гораздо меньше, чем между электронными. Поэтому каждый электронный уровень молекулы распадается на ряд колебательных уровней (подуровней). В свою очередь каждому колебательному уровню молекулы соответствует ряд вращательных подуровней, расстояние между которыми еще меньше, чем между колебательными уровнями.
Стационарных энерг. состояние: не излучается и не поглощается энергия. При квантовых переходах атомы и молекулы скачкообразно переходят из одного стационарного состояния в другое, с одного энергетического уровня на другой. Это связано с энергетическими переходами электронов.
При переходе с более высоких энергетических уровней на нижние атом или молекул отдает энергию, в обратном случае – поглощает. Атом в основном состоянии способен только поглощать энергию.
Излучаемая атомами или молекулами энергия формирует спектр испускания, а поглощаемая - спектр поглощения.
При переходе электрона в атоме выделяется или поглощается энергия в виде кванта ЭМ излучения. Атомные спектры излучения и поглощения являются линейчатыми.
Переход в молекулах :
В результате того, что электронные уровни в молекуле распадаются на колебательные и вращательные подурони, количество возможных энергетических переходов значительно возрастает по сравнению с атомами. Поэтому усложняются молекулярные спектры, они имеют сплошной характер.
∆Е >>∆Епол.> ∆Евр.
∆Еэ ~ 1-3 ЭВ λ~ 0,5 мкВ
∆Епол. ~ 10 -2 -10 -1 ЭП λ~1-100мкВ
∆Евр. ~ 10 3 -10 -5 В λ~100-1000мкВ
поглощение энергии молекулы
2- излучение энергии атома на молекуле
Люминесценция, спектры излучения и поглощения, правило Стокса. Использование люминесценции в биофизике и медицине.
Люминесценция – излучение, представляющее собой избыток над тепловым излучением при данной температуре, и имеющее период t (10 -15) больше, чем период световой волны. Люминесценция идет при любой температуре. Люминесцирующие вещества светятся без нагревания. Никогда не бывает равновесной.
По виду возбуждения люминесценция бывает:
1) Фотолюминесценция – возбуждение светом;
2) Электролюминесценция – возбуждение электрическим полем;
3) Хемолюминесцениця (возбуждение с помощью химической реакции).
Воздействие перечисленных источников приводит к возбуждению атомов, молекул или ионов люминесцирующего вещества. Излучение возникает в результате квантовых переходов частиц вещества из возбужденных состояний в основное(или менее возбужденное)
По длительности свечения фотолюминесценцию делят на:
Флуоресценция – кратковременное послесвечение
Фосфоресценция - сравнительно длинное послесвечение

Спектр люминесценции сплошной.
Основные характеристики люминесценции.
1) квантовый выход:
ζ= 100% N(излуч)/N(поглощ),
где N(излуч) – кол-во квантов, давших свет,
N(поглощ) – кол-во поглощенных квантов.
2) D – оптическая плотность образца.
D=lgI 0 /I λ =Есl, где Е – молекулярный показатель поглощения
3) D = f (λ ) –спектр поглощения
I λ = f (λ ) – спектр излучения
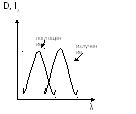
Правило Стокса:
Спектр поглощения данного вещества сдвинут по отношению спектра излучения в сторону более коротких волн.
Использование люминесценции в биофизике и медицине:
Фотолюминесценция:
Обнаружение начальной стадии порчи продуктов
Сортировка фармакологических препаратов
Диагностика некоторых заболеваний (свечение волос, чешуек, ногтей при диагностике их поражения грибком или лишаем)
На основе фотолюминесценции созданы источники света, спектр которых больше соответствует дневному, чем у лам накаливания (лампы дневного света)
Хемолюминесценция – применение в диагностике
Применение специальных флуоресцирующих молекул, добавляемых к мембранным системам извне. Такие молекулы получили название флуоресцентных зондов ли меток. Изменение их позволяет обнаружить конформационные перестройки в белках в мембранах.
Индуцированное излучение. Инверсная заселенность уровней. Оптические квантовые генераторы (лазеры). Свойства лазерного излучения, его применение в медицине.
Индуцированное излучение – вынужденный переход возбужденной частицы на нижний уровень. При этом число переходов, совершаемых в секунду, зависит от числа фотонов, попадающих в вещество за это же время, т.е. от интенсивности света. Кроме того, вынужденные переходы будут определяться населенностью соответствующих энергетических состояний. Инверсная населенность – такое состояние среды, при котором число частиц на одном из верхних уровней больше, чм на нижнем. Инверсная заселенность уровней обеспечивается тем, что на метастабильном уровне электроны могут находиться в 10 -5 раз дольше, чем на возбужденном.
Вв 1960г. был создан первый квантовый генератор видимого диапазона излучения – лазер с рубинов в качестве рабочего вещества. Он создает импульсное излучение с длиной волны 694,3 нм.
Принцип работы лазера похож на люминесценцию.
![]()
![]()
Al 2 O 3 + Cr 2 O 3 – рубин
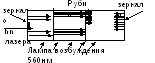
Свойства лазерного излучения
Лазерное излучение всегда монохроматично
Поляризация
Лучи не расходятся, строго параллельны
Можно получать очень высокие интенсивности.
Применение лазера:
Идентифицирование ДНК и белков.
Офтальмология
Лечение трофических язв., злокачественных опухолей
Лазеры, работающие в непрерывном режиме, используются для операций на обильно кровоснабжаемых органах
Рентгеновское излучение: характеристическое и тормозное; механизм излучения, спектры характеристического и тормозного рентгеновского излучений.
Рентгеновское излучение – это электромагнитная волна в диапазоне от 80 до 10 -4 нм. Длинноволновое рентгеновское излучение перекрывается коротковолновым УФ излучением, коротковолновое- длинноволновым γ-излучением. По способу возбуждения рентгеновское излучение делится на тормозное и характеристическое
Тормозное Re -излучение.
Излучение, возникающее при торможении электрона в веществе анода, называют тормозным рентгеновским излучением. При торможении электронов лишь часть энергии идет на создание фотона, другая часть расходуется на нагревание анода. Так как соотношение между этими частями случайно, то при торможении большого количества электронов образуется непрерывный спектр рентгеновского излучения.
Спектр тормозного рентгеновского излучения: (1) - при различных напряжениях в рентгеновской трубке)
Поток рентгеновского излучения измеряется по формуле:
Ф=КUа-кIZ 2), где U, I – напряжение и сила тока в рентгеновской трубке, Z- порядковый номер атомного вещества анода, к=10 -9 В -1 - - коэффициент прапорциональности.
Ф=- λ min ˜ ∫Ф λ d λ
Если увеличить температуру накала катода, то возрастут эмиссия электронов и сила тока в трубке. Это приведет к увеличению числа фотонов рентгеновского излучения, испускаемых каждую секунду. А спектральный состав его не изменяется.
2) Характеристическое рентгеновское излучение.
Увеличение напряжения на рентгеновской трубке приводит к тому, что на фоне сплошного спектра появляется линейчатый, который соответствует характеристическому рентгеновскому излучению. Ускоренные большим напряжением электроны проникают в глубь атома и выбивают из его внутренних слоев электроны. На свободные места переходят электроны с верхних уровней, в результате чего высвечиваются фотоны характеристического излучения.
Характеристический рентгеновский спектр атома не зависит от химического соединения, в которое этот атом входит. Спектр:
Взаимодействие рентгеновского излучения с веществом (когерентное рассеяние, фотоэффект, Комптон-эффект). Закон ослабления интенсивности рентгеновского излучения. Защита от рентгеновского излучения.
Взаимодействие рентгеновского излучения с веществом
1)
Когерентное
рассеяние
– рассеивание длинноволнового
рентгеновского излучения Условие:
hn hn 1 =
hn 2 ,
где n-частота. 2)
Фотоэффект
.
hn≥Aи.
При этом рентгеновский квант поглощается,
а электрон отрывается от атома.
Оторвавшийся электрон приобретает
кинетическую энергию. Если она велика,
то электрон может ионизировать соседние
атомы путем соударения. удаление электрона
– процесс ионизации hn=
Еион + m 0 v 2 /2 3)Комптон-эффектhn>>Aи.
При этом электрон отрывается от атома
и приобретает некоторую кинетическую
энергию. Энергия самого фотона
уменьшается. Т.о. в результате
некогерентного рассеивания
(Комптон-эффекта) образуется вторичное
рассеянное излучение и происходит
ионизация атомов вещества.
hn=
Еион+ mv 2 /2
+ hn Закон ослабления
интенсивности рентгеновского излучения:
Iх=I 0
е -µх µ=µ п
+µ р вклад каждого
слагаемого процесса определяется
энергией фотона. Фотоэффкт Комптон-эффект 6.
Устройство рентгеновской трубки и
рентгеновского аппарата. Жесткость и
интенсивность излучения, их регулировка.
Способ получения рентгеновских снимков.
Применение рентгеновского излучения
в медицине.
Устройство
рентгеновской трубки:
Трубка представляет собой стеклянную
колбу (с возможно высоким вакуумом), с
двумя электродами: анодом и катодом, к
которым приложено высокое напряжение.
Катод является источником электронов.
Анод – металлический стуржень, имеет
наклонную поверхность для того, чтобы
направлять возникающее рентгеновское
излучение под углом к оси трубки. Под
действием высокого напряжения электроны,
испущенные раскаленной нитью катода,
ускоряются до большой энергии.
Кинетическая энергия приобретаемая
электроном равна работе электрических
сил и прапорциональна напряжению между
катодом и анодом. Рентгеновское излучение
возникает вследствие интенсивного
торможения быстрых электронов в веществе
анода при столкновения с его атомами
(взаимодействия с электрическим полем
атомного ядра и электронов). Uа-к≈100∙10 3 В λmin= hc/
еUа-к
1) Коротковолновое
рентгеновское излучение обычно обладает
большей проникающей способностью, чем
длинноволновое, и называется жестким,
а длинноволновое мягким.
Мягкое излучение сильнее поглощается
веществом. Увеличивая напряжение на
рентгеновской трубке, изменяют
спектральный состав излучения и
увеличивают жесткость. Получение
рентгеновских снимков.
Если на пути рентгеновских лучей
поместить неоднородное тело и перед
ним поставить флуоресцирующий экран,
то это тело, поглощая или ослабляя
излучение, образует на экране тень. По
характере этой тени можно судить о
форме, плотности, структуре, а во многих
случаях и о природе тел. т.е. существенное
различие поглощения рентгеновского
излучения разными тканями позволяет
в теневой проекции видеть изображение
внутренних органов. µ1<µ2
I 2 < применение
рентгеновского излучения в медицине:
Рентгенодиагностика: 1) Рентгеноскопия
(рентгеновская трубка расположена
позади пациента. Перед ним располагается
флуоресцирующий экран. На экране
наблюдается теневое (позитивное)
изображение). 2) рентгенография
(объект помещается на кассете, в которую
вложена пленка со специальной
фотоэмульсией. рентгеновская трубка
располагается над объектом. Получаемая
рентгенограмма дает негативное
изображение, т.е. обратное по контрасту
с картиной наблюдаемой при просвечивании.
В данном методе имеет место большая
четкость изображения. Перспективным
вариантом данного метода является
рентгеновская томография и компьютерная
томография). 3) Флюорография 4)Рентгенотерапия
– использование рентгеновского
излучения для уничтожения злокачественных
образований. 7.Принцип
рентгеновской томографии. Рентгеновский
томограф. Его устройство. В чем состоят
основные отличия рентгеновской
томограммы от рентгеновского снимка?
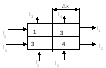
1) Поглощение Re µ - коэффициент
поглощения, свойство ткани 2) Re-исследование Iа=
I 0
e -µ х 1 Iв=
I 0
e -µ2 х 2 Iв=
I 0
e -µ1х1
e -µ2х2 =
I 0
e -(µ1х1+µ2х2) Цель диагноза. Определить µ3 и
∆µ3 lnI1/I 0 =
-(µ1+µ2)∆х lnI2/I 0 =
-(µ3+µ4)∆х lnI3/I 0 =
-(µ3+µ1)∆х lnI4/I 0 =
-(µ4+µ2)∆х I 0
-
задаем I1,I2,I3,I4
– измеряем(известно) ∆х – задаем
(известно) находим µ1µ2µ3µ4,
решая систему из 4 уравнений 2048∙2048= 4194304 Система теорем
Радона Если я буду брать
бесчисленное множество изображений
предмета, то можно восстановить его с
любой точностью Техническое
решение. этап:
измерения
I1,I2,I3,I4… этап: построение
изображения Каждому значению
µ ПК приписывает свою яркость (цвет) 1срез – 1 секунда Контраст ∆µ/µ=0,1%(на
10%) Толщина слоя –
1-2мм Предел разрешения
0,2мм При томографии
можно получить послойное рентгеновское
изображение тела с деталями менее 2 мм.
Это позволяет различать серое и белое
вещество мозга и видеть очень маленькие
опухолевые образования 8. Виды ионизирующих
излучений.
Действие
ионизирующего излучения на вещество.
Поглощенная, экспозиционная и
биологическая (эквивалентная) дозы,
соотношения между ними. Единицы доз в
системе СИ и внесистемные единицы,
применяемые в медицине.
В процессе излучения
явления радиоактивности были обнаружены
3 вида лучей, испускаемых радиоактивными
ядрами. Альфа –распад
состоит в самопроизвольном превращении
ядра с испусканием -частиц
(ядра гелия). А Z Х→
А-4 Z -2 Y+
4 2 При -распаде
дочернее ядро может образоваться в
возбужденном состоянии. В эжтом случае
энергия возбужденного ядра чаще всего
выделяется в виде -кванта.
Поэтому альфа-распад сопровождается
-излучением. Бета-распад
состоит в самопроизвольном превращении
ядра с испусканием электронов (или
позитронов). А Z Х→
А Z +1 Y
+ 0 -1 β
+ν Где ν
– обозначение частицы антинейтрино.
Электрон образуется вследствие
внутриядерного превращения нейтрона
в протон. Гамма излучение
имеет электромагнитную природу и
представляет собой фотоны с длиной
волны λ≤10 -10
м Излучение этого
типа сопровождает не только -распад,
но и более сложные ядерные реакции. Взаимодействие
с веществом
: Заряженная частица
при прохождении через вещество теряет
свою энергию вследствие ионизационного
торможения. При этом её кинетическая
энергия расходуется на возбуждение и
ионизацию атомов среды.Для количественной
характеристики взаимодействия заряженной
частицы с веществом используют величины: линейная плотность
ионизации, i,
число пар ионов, образующихся на
единице ути пробега частицы: i=dn/dl линейная тормозная
способность вещества (S)
– энергия, теряемая заряженной частицей
на единице пути пробега: S=dE/dl средний линейный
пробег заряженной ионизирующей частицы
(R)
– расстояние между началом и концом
пробега частицы в данном веществе. Характерные
особенности взаимодействие различных
видов излучения с веществом: Альфа- излучение: По мере продвижения
альфа-частицы в среде I
сначала возрастает (при уменьшении
скорости возрастает время, которое она
проводит вблизи молекулы среды, поэтому
вероятность ионизации увеличивается),
а при завершении пробега (х=R)
резко убывает, что связано с уменьшением
скорости движения. Когда энергия частицы
становится меньше энергии, необходимой
для ионизации, образлование ионов
прекращается. График зависимости
линейной плотности ионизации от пути,
пройденного альфа-частицей в среде: Ионизация и
возбуждение являются первичными
процессами. Вторичные: увеличение
скорости молекулярно-теплового движения,
характеристическое рентгеновское
излучение, радиолюминисценция, химические
процессы. Бета-излучение.
Вызывает ионизацию, возбуждение,
рентгеновское излучение (при торможении
электронов), характерное черенковское
излучение, когда скорость движения
электрона в среде превышает скорость
распространения света в этой среде. Гамма-излучение
вызывает незначительную первичную
ионизацию, когерентное и некогерентное
рассеяние, ионизирующий фотоэффект,
образование электронно-позитронных
пар, фотоядерные реакции, обусловленные
взаимодействием кванта с ядром. Поглощенная доза
(D
)
-
величина,
равная отношению энергии ∆Е, переданной
элементу облучаемого вещества, к массе
m
этого элемента: D=∆Е
/m.
В Си единицей поглощенной дозы является
грей (Гр). 1 Гр соответствует дозе
излучения, при которой облученному
веществу массой 1 кг передается энергия
ионизирующего излучения 1 Дж. Внесистемная
единица 1рад=10 -2
Гр Экспозиционная
доза
излучения
(Х) характеризует ионизирующее действие
рентгеновского и γ-излучения в воздухе,
окружающим облучаемое тело. В СИ единицей
экспозиционной дозы является Кл/кг. В
СИ единицей экспозиционной дозы является
Кл/кг. 1Кл/кг соответствует
экспозиционной дозе фотонного излучения,
при которой в результате ионизации 1кг
сухого воздуха (н.у.) образуются ионы с
зарядом 1Кл каждого знака. Единицей
мощности экспозиционной дозы является
1А/кг, а внесистемной единицей: 1Р/с. Так
как доза излучения прапорциональна
падающему ионизирующему излучению, то
между излученной и экспозиционной
дозами должна быть пропорциональная
зависимость: D=fХ,
где f
– некоторый переходный коэффициент,
зависящий от облучаемого вещества и
энергии фотонов. Эквивалентная
доза – (Н)
используется для оценки действия
ионизирующего излучения на биологические
объекты; она имеет ту же размерность,
что и поглощенная доза излучения, но
название другое. В СИ: Зиверт [Зв],
1Зв=1Дж/кг Внесистемная
единица: 1бер=10 -2
Зв. Между
экспозиционной и поглощенными дозами
есть связь:
H=KD,
где К – коэффициент качества (показывает
во сколько раз эффективность биологического
действия данного вида излучения больше,
чем фотонного, при одинаковой дозе
излучения в тканях). 9. Мощность
дозы. Связь мощности экспозиционной
дозы с активностью радиоактивного
препарата.
Мощность дозы
–
величина, определяющая дозу, полученную
объектом за единицу времени. При
равномерном действии излучения мощность
дозы N
численно равна отношению дозы D
ко времени t,
в течение которого действовало
ионизирующее излучение: N=D/t. Единицей мощности
дозы излучения является грей (Гр),
который соответствует дозе излучения,
при которой облученному веществу массой
1кг передается энергия ионизирующего
излучения 1Дж; мощность дозы излучения
выражается в Гр/сек. Внесистемная
единица дозы излучения – рад (1 рад=10 -2
Гр=100эрг/г), её мощности рад в секунду. Экспозиционная
доза излучения (Х) характеризует
ионизирующее действие рентгеновского
и γ-излучения в воздухе, окружающим
облучаемое тело. В СИ единицей
экспозиционной дозы является Кл/кг. 1Кл/кг соответствует
экспозиционной дозе фотонного излучения,
при которой в результате ионизации 1кг
сухого воздуха (н.у.) образуются ионы с
зарядом 1Кл каждого знака. Единицей
мощности экспозиционной дозы является
1А/кг, а внесистемной единицей: 1Р/с. Так
как доза излучения прапорциональна
падающему ионизирующему излучению, то
между излученной и экспозиционной
дозами должна быть пропорциональная
зависимость: D=fХ,
где f
– некоторый переходный коэффициент,
зависящий от облучаемого вещества и
энергии фотонов. Для воды и мягких
тканей человека f=1,
следовательно доза излучения в радах
численно равна соответствующей
экспозиционной дозе в рентгенах. Связь мощности
экспозиционной дозы с активностью
радиоактивного препарата:
Из источника
γ-фотоны вылетают по всем направления.
Число этих фотонов, пронизывающих 1м 2
поверхности некоторой сферы в 1с,
прапорционально активности А и обратно
пропорциональнаплощади поверхности
сферы (4πr 2)/
Мощность экспозиционной дозы (Х/t)
в объеме V
зависит от числа фотонов, так как именно
они вызывают ионизацию: Х/t=k γ A/r 2 Где k γ
- которая
характерна для данного радионуклида. 10. Закон
радиоактивного распада (вывод). График
закона. Искусственная радиоактивность.
Метод меченых атомов, применение в
медицине.
Радиоактивный
распад
–
это статистическое явление. Пусть за
малый интервал времени dt
распадается dN
ядер. Это число прапорционально интервалу
времени dt,
а также общему числу N
радиоактивных ядер: dN=-λNdt,
где λ – постоянная распада, пропорциональная
вероятности распада радиоактивного
ядра т различная для разных радиоактивных
ядер убывает со временем. Интегрируем
полученное выражение и получаем
lnN/N 0 =-λt.
N=
N 0 e - λt . Это и есть основной
закон радиоактивного распада: за равный
промежуток времени распадается
одинаковая доля начального количества
ядер. Процессы
радиоактивного распада для двух веществ
λ1>λ2. Задание №1.
Какие части растительной клетки видны под световым школьным микроскопом?
1. Рибосомы
2. Митохондрии
3. Клеточная стенка
4. Плазматическая мембрана
Объяснение:
в световой микроскоп видны крупные части клеток. Из представленных, такой крупной органеллой является клеточная стенка (она достаточно толстая), а плазматическую мембрану сложно визуально (при небольшом увеличении) выделить из клеточной стенки. Правильный ответ - 3.
Задание №2.
Фрагмент молекулы ДНК, состоящей из 12 нуклеотидов, хранит информацию о
1. 4 аминокислотах в молекуле белка
2. 16 нуклеотидах молекулы тРНК
3. 12 аминокислотах молекулы иРНК
4. 24 нуклеотидах молекулы рРНК
Объяснение:
три нуклеотида молекулы ДНК кодируют одну аминокислоту (такая структура называется триплет), поэтому 12 нуклеотидов ДНК кодируют 4 аминокислоты в молекуле белка. Правильный ответ - 1.
Задание №3.
Переход электронов на более высокий энергетический уровень происходит в световую фазу в молекулах
1. Хлорофилла
2. Воды
3. Глюкозы
4. Углекислого газа
Объяснение:
в ходе фотосинтеза именно молекула хлорофилла переходит в возбужденного состояние, так как именно с пигмента начинает цепочка биохимических реакций при фотосинтезе. Правильный ответ - 1.
Задание №4.
В ходе индивидуального развития животного многоклеточный организм развивается из зиготы путем
1. Мейоза
2. Митоза
3. Филогенеза
4. Гаметогенеза
Объяснение:
после образования зиготы, зигота начинает дробиться именно путем митоза (это процесс деления соматических клеток), то есть из одной диплоидной клетки образуются две диплоидные: из одной клетки - две, из двух - 4, из четырех - 8 и т.д. Правильный ответ - 2.
Задание №5.
Особенность бесполого размножения заключается в том, что новый организм развивается из
1. Мужской гаметы
2. Неоплодотворенной яйцеклетки
3. Зиготы с двойным набором хромосом
4. Соматической клетки с двойным набором хромосом
Объяснение:
бесполое размножение не связано с половыми клетками, поэтому из представленных вариантов ответа бесполое размножение возможно только при развитии организма из соматической клетки с двойным набором хромосом. При вегетативном размножении получается дочерний организм, идентичный материнскому. Правильный ответ - 4.
Задание №6.
Определите схему скрещивания, если известно, что при скрещивании томата с круглыми плодами, генотип которого неизвестен, с томатом с грушевидными плодами (рецессивный признак) 50% потомков имеют грушевидные плоды.
1. АА х аа
2. Аа х аа
3. Аа х Аа
4. АА х АА
Объяснение:
50% потомков будут иметь грушевидные плоды только если скрещивается гетерозигота с гомозиготой по рецессивному признаку - Аа х аа. Правильный ответ - 2.
Задание №7.
Независимое расхождение гомологичных хромосом в мейозе причина изменчивости
1. Геномной
2. Комбинативной
3. Хромосомной
4. Цитоплазматической
Объяснение:
комбинативная изменчивость - изменчивость, возникающая при перекомбинации родительских генов. Причинами могут быть нарушения в: кроссинговере в метафазе мейоза, расхождении хромосом в мейозе, слиянии половых клеток. Правильный ответ - 2.
Задание №8.
Н.И. Вавилов, занимаясь исследованием особенностей наследования признаков культурных растений, обосновал закон
1. Гомологических рядов в наследственной изменчивости
2. Независимого наследования неаллельных генов
3. Доминирования гибридов первого поколения
4. Сцепленного с полом наследования
Объяснение:
Н.И. Вавилов сформулировал закон гомологических рядов, который звучит следующим образом: близкие виды благодаря большому сходству их генотипов (почти идентичные наборы генов) обладают сходной потенциальной наследственной изменчивостью (сходные мутации одинаковых генов); по мере эволюционно-филогенетического удаления изучаемых групп (таксонов), в связи с появляющимися генотипическими различиями параллелизм наследственной изменчивости становится менее полным. Следовательно, в основе параллелизмов в наследственной изменчивости лежат мутации гомологичных генов и участков генотипов у представителей различных таксонов, то есть действительно гомологичная наследственная изменчивость. Однако и в пределах одного и того же вида внешне сходные признаки могут вызываться мутациями разных генов; такие фенотипические параллельные мутации различных генов могут, конечно, возникать и у разных, но достаточно близких видов. Правильный ответ - 1.
Задание №9.
К царству бактерий следует отнести
1. Хламидомонаду
2. Кишечную палочку
3. Инфузорию-туфельку
4. Малярийного плазмодия
Объяснение:
хламидомонада, инфузория-туфелька и малярийный плазмодий - простейшие, а кишечная палочка (Escherichia coli) -
бактерия. Правильный ответ - 2.
Задание №10.
Клубень, луковица - это
1. Органы почвенного дыхания
2. Видоизмененные побеги
3. Генеративные органы
4. Зачаточные побеги
Объяснение:
клубень и луковица (как еще и, например, корневище) являются видоизмененными побегами. Правильный ответ - 2.
Задание №11.
Папоротники, в отличие от цветковых растений, размножаются с помощью
1. Спор
2. Корней
3. Корневищ
4. Почкования
Объяснение:
цветковые растения размножаются при помощи семян, а папоротники - при помощи спор. Правильный ответ - 1.
Задание №12.
К какому классу относят членистоногих, имеющих простые глаза и четыре пары ходильных ног?
1. Насекомых
2. Головоногих
3. Ракообразных
4. Паукообразных
Объяснение:
посмотрим на картинку и сделаем вывод, что правильный ответ - 4.
Задание №13.
Высокий уровень обмена веществ позволяет птицам
1. Заботиться о потомстве
2. Откладывать яйца в гнезда
3. Питаться растительной пищей
4. Расходовать во время полета много энергии
Объяснение:
высокий уровень обмена веществ - это одно из приспособлений к полету, поэтому выбираем расходование большого количества энергии во время полета. Правильный ответ - 4.
Задание №14.
Если человек страдает малокровием, то у него в крови по сравнению с нормой понижено содержание
1. Лейкоцитов
2. Эритроцитов
3. Тромбоцитов
4. Фибриногена
Объяснение:
малокровие (другое название - анемия) выражается в пониженном содержании красных кровяных телец - эритроцитов и/или гемоглобина. Симптомы заболевания: головокружение, повышенная усталость и т.д. из-за недостаточного снабжения клеток кислородом. Правильный ответ - 2.
Задание №15.
Первичное расщепление сложных углеводов в организме человека происходит в
1. Ротовой полости под действием фермента слюны
2. Полости желудка под действием фермента пепсина
3. Клетках печени, запасающих гликоген
4. Клетках поджелудочной железы, вырабатывающих гормоны
Объяснение:
фермент, вырабатываемый в желудке и ротовой полости, - амилаза начинает расщепление сложных углеводов - полимеров в ротовой полости. Правильный ответ - 1.
Задание №16.
Функцию уничтожения чужеродных микроорганизмов в крови человека выполняют
1. Нейроны
2. Эритроциты
3. Эпителиальные клетки
4. Лимфоциты
Объяснение:
лимфоциты - клетки иммунитета, то есть они борятся с чужеродными микроорганизмами в крови человека. Правильный ответ - 4.
Задание №17.
Воздействие сумеречного света преобразуется зрительным анализатором человека в нервные импульсы в
1. Хрусталике глаза
2. Зрачке радужной оболочки
3. Палочках сетчатки
4. Склере глазного яблока
Объяснение:
рецепторами, воспринимающими световые сигналы в сумерках и темноте, являются палочки сетчатки. От них сигнал передается в центральную нервную систему. Правильный ответ - 3.
Задание №18.
Наложение шины на сломанную конечность
1. Уменьшает кровотечение
2. Снижает отек конечности
3. Препятствует проникновению микроорганизмов в место перелома
4. Предупреждает смещение сломанных костей
Объяснение:
шину на сломанную конечность накладывают для того, чтобы не допустить смещение костей. Правильный ответ - 4.
Задание №19.
Творческая роль естественного отбора проявляется в
1. Усилении внутривидовой борьбы
2. Освоении организмами новых сред обитания
3. Возникновении новых мутаций
4. Возникновении новых видов
Объяснение:
естественный отбор являются одной из движущих сил эволюции. Целью эволюции является создании наиболее приспособленного вида в данных условиях, поэтому и творческая роль естественного отбора проявляется в создании новых видов. Правильный ответ - 4.
Задание №20.
В современной биологической науке популяцией принято считать
1. Совокупность организмов одного царства
2. Особей, образующих пищевую цепь
3. Особей разных видов, образующих биоценоз
4. Особей одного вида, обитающих на одной территории
Объяснение:
популяция - группа особей одного вида, живущих на одной территории и свободно скрещивающихся между собой. Правильный ответ - 4.
Задание №21.
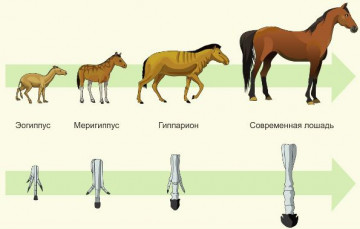
Филогенетический ряд лошади свидетельствует о(об)
1. Обратимости процесса эволюции
2. Регулярном возврате к предковым формам
3. Сходстве постэмбрионального развития организмов
4. Историческом развитии современного вида
Объяснение:
рассмотрим филогенетический ряд лошади.
Как видно из картинки, филогенетический ряд вида - это отслеживание этапов его исторического развития. Правильный ответ - 4.
Задание №22.
Какой из приведенных примеров иллюстрирует конкурентные отношения между организмами?
1. Белка - дятел
2. Дуб - белый гриб
3. Корова - бычий цепень
4. Уж - лягушка
Задание №23.
В результате длительных биотических отношений хищник - жертва в естественном биоценозе наблюдается
1. Нерегулируемое увеличение численности хищников
2. Закономерное колебание численности обеих групп организмов
3. Накопление мутантных аллелей в генофонде жертв
4. Проявление доминантных признаков в популяции хищников
Объяснение:
при длительных отношениях хищник-жертва поддерживается постоянное число этих двух видов, но из-за изменения условий среды происходят популяционные волны и они постепенно гасятся постоянством данной системы (то есть такая система является достаточно устойчивой). Правильный ответ - 2.
Задание №24.
Благодаря живому веществу в биосфере круговорот веществ
1. Незамкнутый
2. Вовлекает много химических элементов
3. Увеличивает разнообразие агроценозов на Земле
4. Обеспечивает накопление в атмосфере инертных газов
Объяснение:
благодаря живым организмов (а особенно микроорганизмам) в природе существуют круговороты очень многих элементов (и сложных веществ - углекислый газ, вода), таких как: углерод, водород, кислород, сера и мн. другие и даже железо. Правильный ответ - 2.
Задание №25.
Верны ли следующие суждения о формах естественного отбора?
А. Стабилизирующий отбор проявляется в условиях внезапного изменения полового состава популяции.
Б. Движущий отбор способствует увеличению числа особей со средним значением признака.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение:
стабилизирующий отбор работает только в постоянных условиях среды и сохраняет особей со средним значением признака, А - неверно. Движущий отбор сохраняет особей с отклоняющимся от средним значением признака, Б - неверно. Правильный ответ - 4.
Задание №26.
В процессе сперматогенеза
1. Образуются мужские половые клетки
2. Образуются соматические клетки
3. Уменьшается вдвое число хромосом
4. Образуются четыре гаметы
5. Образуется одна яйцеклетка
6. Образуются клетки с диплоидным набором хромосом
Объяснение:
сперматогенез - процесс образования мужских половых клеток, при этом из клетки-предшественника (диплоидной) образуется четыре гаплоидных половых клетки (то есть хромосомный набор уменьшается вдвое). Правильный ответ - 1, 3, 4.
Задание №27.
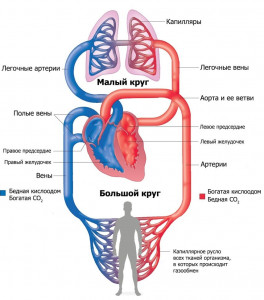
Большой круг кровообращения в организме человека
1. Начинается в левом желудочке
2. Берет начало в правом желудочке
3. Насыщается кислородом в альвеолах легких
4. Снабжает органы и ткани кислородом и питательными веществами
5. Заканчивается в правом предсердии
6. Приносит кровь в левую половину сердца
Объяснение:
рассмотрим большой круг кровообращения.
Как видно из рисунка, большой круг берет начало в левом желудочке и несет кровь (кислород, гормоны и т.д.) во все клетки организма, а углекислый газ забирает из клеток и несет его обратно в сердце, а именно, в правое предсердие. Правильный ответ - 1, 4, 5.
Задание №28.
К процессам, приводящим к образованию новых видов в природе, относят
1. Митотическое деление клеток
2. Скачкообразный мутационный процесс
3. Модификационную изменчивость
4. Географическую изоляцию
5. Бесполое размножение особей
6. Естественный отбор
Объяснение:
к образованию новых видов приводят различные мутации (этому предшествует их накопление и распространение во всей популяции), географическая изоляция (именно в условиях отсутствия размножения с особями других популяций может появиться новый вид) и естественный отбор - это направленный процесс, в ходе которого выживает наиболее приспособленный организм и, впоследствии, формируется максимально приспособивишийся к данным условиям среды вид. Правильный ответ - 2, 4, 6.
Задание №29.
Установите соответствие между характеристикой автотрофного питания и его типом.
Характеристика Тип автотрофного питания
А. Используется энергия окисления 1. Фотосинтез
неорганических веществ 2. Хемосинтез
Б. Источник энергии - солнечный свет
В. Осуществляется в клетках растений
Г. Происходит окисление аммиака
Д. Выделяется в атмосферу кислород
Объяснение:
фотосинтез - процесс превращения энергии Солнца в энергию химических связей, осуществляемый фототрофами. Хемосинтез - процесс превращения неорганических веществ в органические при помощи энергии окисления химических соединений. Поэтому, к фотосинтезу относится: источник энергии - солнечный свет, процесс происходит в клетках растений и выделение в атмосферу кислорода. Остальные два положения относятся к хемосинтезу. Правильный ответ - 21121.
Задание №30.
Установите соответствие между характеристикой и царством организмов.
Характеристика Царство организмов
А. В состав клеточной стенки входит хитин 1. Грибы
Б. Тип питания автотрофный 2. Растения
В. Образуют органические вещества из неорганических
Г. Запасным питательным веществом является крахмал
Д. В природных системах являются редуцентами
Е. Тело состоит из мицелия
Объяснение:
в состав клеточной стенки грибов входит хитин, они - гетеротрофы (то есть потребляют готовые органические вещества) и редуценты (разлагают органические вещества до неорганических), их тело состоит из мицелия. Растения - автотрофы (образуют органические вещества из неорганических, запасным веществом является крахмал. Правильный ответ - 122211.
Задание №31.
Установите соответствие между признаком регуляции функций в организме человека и его механизмом.
Признак Механизм регуляции
А. Осуществляется эндокринной системой 1. Нервный
Б. Распространяются гормоны 2. Гуморальный
В. Доставляется к органам кровью
Г. Скорость воздействия очень высокая
Д. Основывается на биоэлектрических явлениях
Объяснение:
нервная регуляция - регуляция при помощи нервной системы, то есть осуществляется по отросткам нервных клеток (при помощи элекрических импульсов), скорость воздействия такой регуляции очень высокая. Гуморальная (гормональная) регуляция - регуляция при помощи биологически активных веществ - гормонов, которые доставляются к органам кровью и вырабатываются железами эндокринной системы. Правильный ответ - 22211.
Задание №32.
Установите соответствие между видом организмов и направлением эволюции, которое для него характерно.
Виды Направление эволюции
А. Крыса серая 1. Биологический прогресс
Б. Снежный барс 2. Биологический регресс
В. Амурский тигр
Г. Пырей ползучий
Д. Лошадь Пржевальского
Е. Одуванчик обыкновенный
Объяснение:
биологический прогресс - увеличение приспособленности особей, сопровождающееся ростом численности, расширением ареала и внутривидовой изменчивостью. Биологический регресс - уменьшение приспособленности особей, сопровождающееся снижением численности, уменьшением ареала и дальнейшим вымиранием вида. Сокращение численности характерно для снежного барса, амурского тигра и лошади Пржевальского. Правильный ответ - 122121.
Задание №33.
Укажите последовательность процессов географического видообразования.
1. Распространение признака в популяции
2. Появление мутаций в новых условиях жизни
3. Пространственная изоляция популяций
4. Отбор особей с полезными изменениями
5. Образование нового вида
Объяснение:
видообразование начинается с изоляции, в таких условиях начинают появляться мутации, среди которых отбираются только полезные, затем эти полезные мутации распространяются среди всех особей популяции. Заканчивается географическое видообразование, что логично, образованием нового вида. Правильный ответ - 32415.
Задание №34.
С какой целью при выпечке хлеба и хлебобулочных изделий применяют дрожжевые грибы? Какой процесс при этом происходит?
Объяснение:
при выпечке хлеба используют дрожжи, так как дрожжи осуществляют брожение (бескислородное дыхание), выделяя углекислый газ, что способствует поднятию теста (в тесте образуются пузырьки), что впоследствии придает тесту пышность.
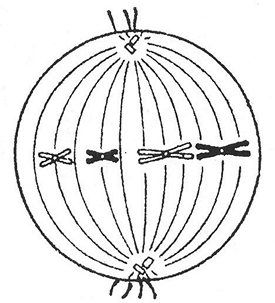
Задание №35.
Какое деление и какая его фаза изображены на рисунке? Укажите набор хромосом (n), число молекул ДНК (с) в этот период. Ответ обоснуйте.
Объяснение:
на рисунке пары гомологичных хромосом выстроены на экваторе клетки и готовы расходиться (то есть это период перед анафазой 1), а перед анафазой 1 - метафаза 1. Значит, в клетке диплоидный набор - 2n (так как мы видим пары хромосом), а число молекул ДНК - 4с, так как каждая хромосома состоит из двух хроматид (то есть из двух молекул ДНК).
Задание №36.
Найдите ошибки в приведенном тексте. Укажите номера предложений, в которых сделаны ошибки, исправьте их.
1. Митохондрии и пластиды представляют собой двумембранные органоиды. 2. На внутренней мембране митохондрий и пластид располагаются фоточувствительные пигменты. 3. В отличие от пластид митохондрии содержат собственную кольцевую молекулу нуклеиновой кислоты. 4. В хлоропластах происходит процесс фотосинтеза. 5. Основная функция митохондрий заключается в синтезе липидов клетки.
Объяснение:
2 - на мембране митохондрий нет пигментов (так как они не осуществляют процесс фотосинтеза). 3 - пластиды тоже содержат собственную нуклеиновую кислоту. 5 - основная функция митохондрий - синтез АТФ (универсальной энергетической молекулы), а не липидов.
Задание №37.
Как осуществляется нейрогуморальная регуляция отделения желудочного сока в организме человека? Ответ поясните.
Объяснение:
нервная регуляция осуществляется двумя путями: 1. При помощи условных рефлексов: при виде лимона (или пищи вообще) или звоне кастрюль в ротовой полости начинает выделяться слюна, то есть организм готовится к приему пищи, выделяя ферменты. 2. При раздражении рецепторов ротовой полости и желудка, то есть при помощи безусловных рефлексов. Гуморальная регуляция осуществляется только при попадании питательных веществ в кровь при всасывании. Начинают выделяться гормоны и разноситься к клеткам организма.
Задание №38.
Укажите какие критерии вида указаны в тексте.
Все особи вида прыткая ящерица имеют один и тот же кариотип. У самцов прыткой ящерицы окраска тела зеленая, а у самок - коричневая. Наиболее многочисленны эти животные в тропических и субтропических зонах земного шара.
Объяснение:
описание кариотипа - генетический критерий. Описание окраски тела (и отличий самок от самцов) - морфологический критерий. Описание ареала вида - географический критерий.
Задание №39.
В синтезе белка последовательно участвовали тРНК с антикодонами ЦЦА, ГУУ, ГАА. Определите состав молекулы ДНК и иРНК.
Объяснение:
начнем записывать состав молекул в обратном порядке, то есть сначала тРНК, затем иРНК, и, наконец, ДНК.
тРНК: ЦЦА ГУУ ГАА
иРНК: ГГУ ЦАА ЦУУ
ДНК: ЦЦА ГТТ ГАА
Задание №40.
Для хохлатой (А) зеленой (В) самки провели анализирующее скрещивание, в потомстве получилось четыре фенотипических класса. Получившихся хохлатых потомков скрестили между собой. Может ли в этом скрещивании получить потомство без хохолка? Если может, то какого оно будет пола, какого фенотипа? У канареек наличие хохолка зависит от аутосомного гена, окраска оперения (зеленое или коричневое) - от гена, сцепленного с Х-хромосомой. Гетерогаметным полом у птиц является женский пол.
Объяснение:
Первое скрещивание:
Р: АаХВУ х ааХвХв
Г: АХВ, аХВ, АУ, аУ х аХв
F1: АаХВХв - хохлатый зеленый самец
ааХВХв - зеленый самец без хохолка
АаХвУ - хохлатая коричневая самка
Скрещиваем самца и самку с хохолком:
Р: АаХВХв х АаХвУ
Г: АХВ, АХв, аХВ, аХв х АХв, АУ, аХв, аУ
F2: получаем 16 генотипов, среди которых можно выделить только 4 фенотипа.
Фенотипы особей без хохолка:
Самки: ааХВУ - зеленая самка без хохолка
ааХвУ - коричневая самка без хохолка
Самцы: ааХВХв - зеленый самец без хохолка
ааХвХв - коричневый самец без хохолка.
Если молекула вещества находится в невозбужденном состоянии, то электроны расположены на самом нижнем энергетическом уровне. Электронная оболочка
молекулы находится при этом в синглетном состоянии, т. е. таком состоянии, когда все электроны спарены и суммарный спиновый момент равен нулю.
Это состояние называется основным синглетным состоянием, а уровень, на котором в это время находятся электроны, называется основным энергетическим
уровнем. Обозначим его S 0 (рис. 1). Рассмотрим электронные переходы в молекулах на примере электронных переходов в молекуле тирозина. Если молекулы поглощают кванты света, то электроны
внешних оболочек молекул переходят на более высокий энергетический уровень S 2 * (переход 1 на рис. 1). При этом электронные
оболочки остаются в синглетном состоянии, хотя молекула становится возбужденной. Величина энергии поглощенного кванта равна разности двух энергетических уровней между которыми осуществляется переход электрона: hv погл. = Е 2 - E 0 (8) Таким образом, переход электрона с основного синглетного уровня на возбужденный синглетный уровень будет соответствовать поглощению света, которое
кратко записывается: S 0 -> S * Если молекула может поглощать свет другой длины волны, то электрон перейдет уже не на уровень S 2 * , а на другой уровень,
соответствующий энергии поглощаемого кванта. Если энергия этого кванта будет меньше, то энергетический уровень будет расположен ниже
S 2 * (на рис. 1 это уровень S 1 * и переход 2). Таких возбужденных синглетных уровней молекула может иметь
несколько. Каждому из них на спектре поглощения будет соответствовать свой максимум оптической плотности. На рис. 1 показаны только электронные уровни
молекулы и не показаны колебательные и вращательные подуровни. Если бы молекулы обладали только электронными уровнями, то количество энергетических
переходов было бы ограничено и молекулярные спектры имели бы линейчатый характер, а вещества обладали бы высокой избирательностью поглощения. В действительности из-за расщепления электронных уровней на колебательные и вращательные подуровни количество энергетических переходов молекул
значительно возрастает и молекулярные спектры являются сплошными. При этом наиболее вероятным электронным переходам в спектре поглощения соответствуют
максимумы. Кроме этого, большое значение в возникновении сплошных спектров молекул имеет взаимодействие молекул с растворителем, характер которого
различен для разных молекул. В возбужденном состоянии молекулы долго находиться не могут; обычно продолжительность периода, пока молекула находится в возбужденном состоянии, не
превышает 10 -8 с. Электронная энергия возбужденной молекулы может расходоваться в результате протекания нескольких процессов: может
передаваться другой молекуле - миграция энергии; может быть использована для увеличения колебательной (тепловой) энергии молекулы. Во всех этих случаях
электрон либо возвращается на основной энергетический уровень S 0 , либо переходит на какой-либо уровень, лежащий ниже данного возбужденного
уровня. Штрих-пунктирные стрелки 5 на рис. 1 изображают электронные безизлучательные переходы, сопровождающиеся растратой энергии в тепло. Кроме вышеназванных процессов, может происходить свечение молекул, сопровождающее их переход в невозбужденное состояние. Электроны при этом
возвращаются на основной энергетический уровень. Процесс свечения молекул, сопровождающий переход электронов с возбужденных уровней на основной,
называется, люминесценцией. Люминесценция делится на два вида: флюоресценцию и фосфоресценцию (послесвечение). Переход электронов с возбужденных уровней на основной всегда начинается с перехода электронов с верхних возбужденных уровней на самый нижний
возбужденный уровень. Это переходы Кванты при этом не высвечиваются и электронная энергия молекулы переходит в тепло. Этот процесс
растраты энергии происходит очень быстро - за 10 -13 - 10 -12 с. Следующий этап перехода электронов заключается в переходе с
нижнего возбужденного уровня S 0 * на основной уровень S 0 . При этом будет высвечиваться квант люминесценции. Так как часть запасенной при поглощении света энергии растратилась в тепло, то энергия кванта люминесценции всегда будет меньше энергии поглощенного
кванта. Она будет меньше на величину растраченной в тепло энергии Е тепл: hv люм = hv погл - Е тепл (9) Следовательно, излучаемый свет будет иметь меньшую частоту и большую длину волны, чем поглощаемый свет. Эта зависимость носит название закона
Стокса: длина волны, света, испускаемого при люминесценции, всегда больше длины волны света, который ее вызвал:
λ люм > λ пог
. Данная закономерность является отражением второго закона термодинамики, согласно которому переход
энергии из одной формы в другую сопровождается рассеиванием энергии в тепло. Интенсивность люминесценции оценивается с помощью специального понятия - квантового выхода. Под квантовым выходом люминесценции φ понимается
отношение количества квантов люминесценции n к количеству поглощенных квантов N: Так как люминесценция всегда наблюдается при переходе электронов с нижнего возбужденного уровня на основной, то интенсивность люминесценции не
будет зависеть от того, на какой уровень перед этим был заброшен электрон при поглощении кванта. Это положение носит название закона Вавилова:
квантовый выход (вероятность) люминесценции не зависит от длины волны света, вызвавшего люминесценцию
. Люминесценция, которая наблюдается при переходе электрона с нижнего возбужденного синглетного уровня на основной
S 0 * -> S 0 , называется флюоресценцией. Так как длительность жизни молекул в возбужденном состоянии составляет
10 -9 - 10 -8 с, то флюоресценция наблюдается только непосредственно во время освещения объекта. Однако давно обнаружено, что
многие вещества (особенно при низкой температуре) продолжают интенсивно светиться даже после выключения света. Это свечение обусловлено переходом
электронов с так называемого триплетного уровня. Выше уже говорилось о триплетном состоянии электронных оболочек, при котором имеются два неспаренных электрона. Триплетный уровень (Т на рис. 1)
расположен несколько ниже нижнего синглетного возбужденного уровня S 0 * . Триплетный уровень является запрещенным - сюда электрон
не может попасть с основного уровня (переходы S 0 -> Т маловероятны). На триплетный уровень электрон может попасть с возбужденного
синглетного уровня; тогда весь его путь будет S 0 -> S * -> Т. Электрон часть энергии расходует в тепло и переходит с нижнего возбужденного синглетного уровня на триплетный. При этом переходе спин электрона
меняется на противоположный, в результате чего два электрона становятся неспаренными, а молекула превращается в бирадикал. Продолжительность
жизни молекулы в триплетном состоянии составляет от 10 -3 с до нескольких секунд. Так как в триплетном состоянии молекула имеет два неспаренных
электрона, то она обладает высокой химической активностью и может вступать в химическое взаимодействие. Кроме того, электрон может переходить
с триплетного уровня на основной и освобождаемая при этом энергия или рассеивается в тепло, или высвечивается в виде кванта люминесценции. Люминесценция, которая сопровождает переход электронов с триплетного уровня на основной Т -> S 0 (переход 4 на рис. 1), называется
фосфоресценцией. Так как триплетный уровень находится ниже синглетного возбужденного уровня, то длина волны света, испускаемого при фосфоресценции,
еще больше, чем испускаемого при флюоресценции. Если по одной оси отложить длину волны излучаемого при люминесценции света, а по другой оси - интенсивность люминесценции, то получим кривую спектра
люминесценции. Спектры люминесценции делятся на спектры флюоресценции и спектры фосфоресценции. На рис. 1, А изображены спектры поглощения и
люминесценции тирозина. Уровень S 0 - основной синглетный уровень молекулы тирозина - условно обладает энергией, равной нулю. Тогда переход
электрона S 0 -> S 2 * при поглощении света требует энергии 5,7 эВ (электрон-вольт). Этому переходу будет соответствовать
максимум в спектре поглощения на длине волны 217 нм. Другому электронному переходу при поглощении кванта S 0 -> S 1 * соответствует запасание энергии 4,5 эВ и в спектре
поглощения соответствует максимум при λ = 275 нм. Флюоресценция происходит, когда электрон возвращается с нижнего возбужденного синглетного уровня на основной.
При этом выделяющийся квант обладает энергией 4,1 эВ. Эта энергия меньше энергии поглощенных квантов (5,7 и 4,5 эВ). Данному переходу соответствует
максимум в спектре флюоресценции при λ = 304 нм. Так как длина волны света, испускаемого при флюоресценции, больше длины волны поглощенного света,
то спектр флюоресценции смещен вправо по шкале длин волн относительно спектра поглощения. Фосфоресценции соответствует переход Т -> S 0 . При
этом излучается квант с энергией 3,2 эВ. Данному переходу в спектре фосфоресценции соответствует максимум при λ = 387 нм. Спектр фосфоресценции
смещен еще правее по шкале длин волн, чем спектр флюоресценции. Спектры люминесценции, как и спектры поглощения, получают с помощью спектрофотометров. Эти спектрофотометры имеют несколько иную конструкцию,
чем рассмотренные выше. В частности, они содержат ряд светофильтров. На основании данных о люминесценции можно судить о величине квантов энергии, запасаемой в молекуле. Наряду с данными о квантах поглощаемой энергии
это позволяет рассчитывать расположение энергетических уровней молекулы. На основании люминесцентного метода можно судить о времени жизни молекул в
возбужденном состоянии - по скорости возникновения и исчезновения люминесценции. Исходя из интенсивности люминесценции, можно делать заключения о
процессах растраты энергии молекулой. Наконец, с помощью люминесцентного метода очень удобно исследовать состояние вещества; даже его незначительное
изменение (агрегация, комплексообразование, изменение рН и т. д.) сказывается на люминесцентных свойствах. Расшифровка сведений, которые дают спектры, производится при помощи теории атома. Поэтому мы кратко напомним некоторые свойства атомов и их излучения. Атом представляет собой систему из ядра и электронов, сдерживаемую электростатическим притяжением. Энергия атома (точнее, его электронной оболочки) может иметь только определенные значения, которые называются термами
, или уровнями
. Состояние с самой низкой энергией называется основным
, остальные - возбужденными
. Схема уровней энергии атома водорода показана на рис. 4, где каждая черточка изображает уровень (нижняя - основной). Расстояния уровней от основного пропорциональны энергии атома, отсчитываемой от энергии основного состояния. Атом может изменять свою энергию, переходя из одного состояния в другое. Обычно это связано с изменением движения самого внешнего электрона. Переходы с более высоких уровней на более низкие могут происходить самопроизвольно, без внешнего воздействия, а разница энергии излучается с "порцией" светового излучения, называемой квантом
. Частота излучаемого света пропорциональна энергии кванта. Поскольку различным переходам соответствуют строго определенные изменения энергии, атом излучает кванты лишь определенных частот, которые и дают отдельные линии в спектре. Переходы "вверх", т. е. с нижних уровней на верхние, самопроизвольно совершаться не могут; для их осуществления необходим внешний источник энергии (например, кванты соответствующей частоты). Такой процесс называется поглощением
. Число уровней энергии атома бесконечно велико; они сгущаются у предела, который соответствует энергии, при которой электрон совсем отделяется от атома. Совокупность линий, образующихся при переходах на данный уровень со всех более высоких, называется спектральной серией
. Так, у водорода имеется серия Лаймана, соответствующая переходам на первый уровень, серия Бальмера, образующаяся при переходах на второй уровень, и т. д. Поскольку первый уровень отстоит очень далеко от остальных, переходы на него сопровождаются большим изменением энергии, и кванты Лаймановской серии лежат в далекой ультрафиолетовой области. Например, линия L α ;, образующаяся при переходе со второго уровня на первый, имеет длину волны 1216Å 1 , тогда как фиолетовой части спектра соответствует длина волны около 4000 Å. Линии серии Бальмера - Н α (6563 Å), Н β (4861 Å) и другие, лежат в видимой части спектра. Остальные серии водорода расположены в инфракрасной области. Уровни энергии других элементов более сложны. Чтобы представить их, нужно изобразить не одну колонку, как на рис. 4, а несколько, с общим верхним пределом. 1 (Å (ангстрем) - единица измерения длин волн в спектроскопии, равна 10 -8 см.
) У большинства атомов энергетические уровни расщепляются на несколько близко расположенных подуровней
. Поэтому линии часто состоят из двух или трех компонентов и более, вследствие чего они называются дублетами, триплетами и т. д. или в общем - мулътиплетами
. Одиночные линии называются сингулетами
. В сложных атомах расщепление уровней может быть очень сильным. Уровни атома водорода тоже состоят из двух подуровней, но энергии их практически одинаковы. Сопоставляя спектр и схему уровней атома какого-либо элемента, можно заметить, что не всем переходам соответствуют наблюдаемые линии; некоторые переходы вообще не происходят. Такие переходы называются запрещенными. Разрешенные
переходы соответствуют строго определенным соотношениям между энергетическими уровнями, называемым правилами отбора
. Следует отметить, что переходы, нарушающие правила отбора, не являются абсолютно запрещенными: при некоторых условиях соответствующие линии все же могут наблюдаться. "Степень" запрещенности лучше всего характеризовать тем временем, которое в среднем должно пройти, пока атом сможет" самопроизвольно совершить данный переход. Для разрешенного перехода это время составляет обычно 10 -7 - 10 -8 сек. Но чтобы совершить запрещенный переход, атом должен находиться в верхнем состоянии гораздо дольше - от 10 -3 сек до нескольких суток и более, в зависимости от степени запрещения. Если с некоторого уровня нет разрешенных переходов "вниз", то атом при определенных условиях может находиться там сравнительно долго. Такие уровни называются метастабилъными
. У большинства элементов и их ионов низкие уровни, близкие к основному, являются метастабильными. Запрещенные линии обычно обозначаются символом элемента в квадратных скобках, причем римская цифра указывает степень ионизации. Например, [ОН] означает запрещенную линию ионизованного кислорода, a - запрещенную линию дважды ионизованного кислорода. Для разрешенных линий квадратные скобки не ставятся. Чтобы атом мог излучить квант, он должен оказаться на каком-либо из возбужденных уровней, т. е. ему нужно сообщить энергию, соответствующую разности энергий рассматриваемого уровня и исходного. Эта энергия может быть сообщена атому или при поглощении им кванта, или при столкновении его с другой частицей, главным образом с электроном. При этом энергия электрона должна быть больше энергии соответствующего перехода. Средняя энергия частиц пропорциональна абсолютной температуре газа. Однако даже если средняя энергия недостаточна для возбуждения, в газе всегда есть электроны с необходимой энергией, но число их быстро уменьшается с ростом энергии. Поэтому число возбуждений уровня, энергия которого заметно больше средней, будет относительно мало 1 . 1 (Частота возбуждений зависит не только от числа электронов, энергия которых больше порога возбуждения, но и от свойств самого атома, точнее, от вероятности возбуждения данного уровня атома быстрым электроном.
) Удар иона или нейтрального атома также может перевести атом в возбужденное состояние, но для этого энергия иона должна быть в сотни или тысячи раз больше энергии уровня, потому что тяжелая частица, всегда передает легкому электрону атома только очень малую часть своей энергии. Поэтому возбуждение тяжелыми частицами обычно не имеет значения в астрофизических условиях, кроме тех случаев, когда энергия уровня исключительно мала. Если электрон столкнется с возбужденным атомом, последний может передать ему свою энергию. Тогда атом перейдет в более низкое состояние без излучения кванта, а столкнувшийся электрон отскочит с увеличенной энергией. Такой процесс называется ударом второго рода
, в отличие от процесса возбуждения атома при столкновении (удары первого рода
). Удары второго рода существенны в плотных газах, где промежуток времени между столкновениями атомов меньше, чем время жизни атома в возбужденном состоянии. В этом случае атомы сталкиваются прежде чем успевают излучить, так что удары второго рода заметно ослабляют излучение. Для метастабильных уровней, с которых нет разрешенных переходов "вниз" и на которых поэтому атом находится значительно дольше, удары второго рода могут быть существенны и при низкой плотности. Именно поэтому мы не наблюдаем в лаборатории линий, соответствующих запрещенным переходам: возбуждение обычно заканчивается ударом второго рода, а не излучением. В очень разреженном газе интервал между столкновениями может стать сравнимым со временем существования в метастабильном состоянии, и запрещенные линии появятся. Как будет видно из дальнейшего, именно такие условия осуществляются в туманностях. Если электрон приобретет большую энергию, чем предел термов, он оторвется от атома. Такой процесс называется ионизацией
. Ионизация атома может произойти И при поглощении кванта, и при столкновении с быстрым электроном. Свободный электрон, не связанный с атомом, может иметь любую энергию. Поэтому, в отличие от переходов внутри атома, где могут поглощаться кванты только определенной частоты, ионизация может быть произведена любым квантом, энергия которого больше необходимой для перехода от исходного уровня к энергии ионизации. Например, атом водорода, находящийся на первом уровне, может поглотить любой квант, длина волны которого меньше 912 А, а со второго уровня - квант с длиной волны меньше 3646 А. Если энергия кванта больше, чем необходимо для отрыва электрона, то избыток энергии переходит в кинетическую энергию вырванного электрона. Ионизация ударом возможна только в случае, если энергия ударяющего электрона больше необходимой для отрыва. Чем выше температура газа, тем большее число электронов имеет необходимую энергию, тем чаще происходят ионизации и тем больше при прочих равных условиях доля ионизованных атомов. Тяжелая частица может ионизовать атом только при больших энергиях, значительно превышающих энергию ионизации. Если газ имеет очень высокую температуру или находится в сильном поле излучения, то раньше чем он успеет поймать электрон обратно, от него может быть оторван второй, третий электрон и т. д. Так могут появиться многократно
ионизованные атомы. Однако отрыв каждого следующего электрона требует все большей энергии, так как заряд иона возрастает. Поэтому для многократной ионизации нужна очень высокая температура газа или источника ионизующего излучения. Процесс, обратный ионизации, называется рекомбинацией
. Он представляет собой захват электрона ионом. Электрон может быть захвачен атомом на любой уровень. Поэтому атом, образовавшийся в результате рекомбинации, может быть как возбужденным, так и невозбужденным. При рекомбинации должна выделиться энергия, равная разности энергий свободного и связанного электрона, обычно в виде кванта. Если рекомбинирует электрон с малой энергией, то частота кванта близка к пределу серии соответствующего уровня. Чем больше энергия рекомбинирующего электрона, тем больше частота излучаемого кванта. Поскольку свободные электроны могут иметь любую энергию, спектр, излучаемый при рекомбинациях, имеет вид сплошной полосы, начинающейся сразу за пределом серии и тянущийся, постепенно ослабевая, в сторону больших частот. Такой спектр называется континуумом
. Ослабление яркости вызвано тем, что доля быстрых электронов всегда падает с увеличением их энергии. Чем выше температура газа, тем больше средняя энергия рекомбинирующих электронов и тем медленнее спадает интенсивность за пределом серий. Выше мы уже говорили, что атом способен излучать свет не только при рекомбинации, но и при переходах с одного энергетического уровня на другой. Оказывается, что и свободный электрон, двигаясь в электрическом поле иона, также способен испускать излучение. Свободный электрон движется в поле иона по гиперболической орбите, причем разным энергиям соответствуют разные орбиты. Подобно тому как при переходе связанного в атоме электрона с одной эллиптической орбиты на другую излучается или поглощается квант, возможно излучение или поглощение кванта при переходе электрона с одной гиперболической орбиты на другую. Такой процесс называется свободно-свободным переходом
. Поскольку энергия обеих орбит может иметь любые значения, излучение и поглощение при свободно-свободных переходах происходят в непрерывном спектре. Изменение энергии при свободно-свободных переходах обычно составляет небольшую долю полной энергии электрона, так что энергия излучаемых квантов меньше средней энергии электронов. При не очень высокой температуре свободно-свободное излучение газа сосредоточено в области длинных волн - от инфракрасных лучей до радиоволн. До сих пор мы говорили об излучении и поглощении света отдельными атомами. В действительности же всегда наблюдается излучение целого слоя газа. Если слой газа прозрачен во всех частотах, излучение отдельных атомов будет просто суммироваться. Оно будет состоять из ярких линий на фоне менее яркого непрерывного спектра, образующегося при рекомбинациях на различные уровни и при свободно-свободных переходах. Но если увеличивать толщину слоя газа, то часть излучения будет им поглощаться. В первую очередь будут поглощаться кванты, образующие линии, и поэтому линии будут менее контрастны на фоне непрерывного спектра. Если однородный слой будет практически непрозрачен во всех частотах, то линии исчезнут. Излучение будет иметь непрерывный спектр, зависящий только от температуры, и максимум интенсивности в этом спектре будет смещаться в сторону коротких волн при возрастании температуры слоя газа. Одновременно будет увеличиваться общее количество энергии, излучаемой единицей поверхности. Излучение звезд усложнено тем, что слой не однороден - температура и плотность его растут с глубиной. Поэтому в спектре звезд имеются темные линии, и общий ход интенсивности в нем не совпадает со спектром непрозрачного слоя газа.

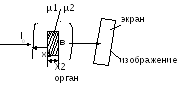

всего страниц:
6
где v погл. - частота поглощаемого света, Е 2 и Е 0 - энергия уровней, между которыми осуществляется переход.
где v люм - частота света, испускаемого при люминесценции.
Страница
3
всего страниц:
6






