Температура плавления и кипения воды равны соответственно. Удельная скрытая теплота плавления твердого вещества
1. СВОЙСТВА И СТРУКТУРА ВОДЫ
1.1. Аномальность свойств воды
Только в конце XVIIIначалеXIXв. стало известно, что представляет собой вещество, называемое водой. Опытами Г. Кавендиша, А. Лавуазье, А. Гумбольдта, Ж.Л. Гей-Люссака было доказано, что вода образуется из двух объемов водорода и одного объема кислорода, т.е. имеет химическую формулуН 2 О и молекулярную массу 18. Постепенно, однако, становилось ясно, что почти по всем физико-химическим параметрам это вещество уникальное, резко отличающееся от других природных соединений.
Температуры плавления и кипения воды
На них основываются принятые системы отсчета температур.
Избрание воды для создания температурных шкал.
Цельсий (1701-44). Шкала Цельсия –1741 г. Температуры кипения и плавления воды при атмосферном давлении соответственно равны 100 о С и 0 о С,
Реомюр (1683-1757). Шкала Реомюра 1730 г. Температура кипения воды принята за 80 о (1 о С = 5/4 о R).
Фаренгейт (1686-1736). Точка таяния льда принята 32 о F, точка кипения воды – 180 о F (t о С = 5/9 t о F - 32).
Открытие периодического закона Д.И.Менделеева (1869 г). Несоответствие физических параметров воды периодическому закону.
Несоответствие периодическому закону видно из сравнения температур кипения и плавления водородных соединений элементов группы кислорода. Данные для Н 2 Se cнимаются с графика. Для воды видно, что при соответствии периодическому закону температура плавления воды составляла бы около минус 90 о, а температура кипения – около -70 о. Вода при “нормальных” условиях была бы токсичным дурнопахнущим газом. Жизнь на Земле была бы невозможна.
Благодаря этим «аномальным» свойствам вода оберегает жизнь и регулирует тепловой и газовый режим нашей планеты.
Теплоемкость воды
Удельная теплоемкость воды – самая высокая из всех жидкостей. И здесь вода принята за эталон: для того, чтобы нагреть 1 г воды на 1 о С на до затратить 1 калорию тепловой энергии (calor – тепло, лат.). Для сравнения: гипс - 0,27, сухая глина 0,22 кал. (1 кал = 4,187 Дж.). Удельная теплоемкость льда и пара вдвое ниже – 0,5 кал/г. град. Необычайно велики и скрытые теплоты плавления и парообразования воды – 79 и 539 кал. Таким образом, чтобы перевести 1г льда с температурой 0 о С в пар надо затратить 79+100+539 = 718 калорий тепла. Благодаря такой чрезвычайно высокой теплоемкости вода является главным регулятором теплового режима на нашей планете. Влияние Мирового океана сказывается практически во всех точках Земли, даже наиболее удаленных от морских берегов, характеризующихся, так называемым, континентальным климатом. Крупные водоемы, и прежде всего, Мировой океан, – регуляторы теплового режима Земли. Для почвенного слоя годовой теплооборот 1,5-3 ккал/см 2 , для,например, Балтийского и Черного морей 48-52. При отсутствии водоемов летом температура поднималась бы, а зимой опускалась на несколько сот градусов ижизнь на Земле была бы невозможна; наоборот, если бы Земля полностью была бы покрыта океаном, годовая амплитуда воздуха изменялась бы от 0 на экваторе до 5-6 о С на полюсах. Влияние океана распространяется на всю планету, включая полюса холода в Антарктиде.
С высокой теплоемкостью воды связаны такие показатели, как скрытая теплота плавления, составляющая 333,7·10 3 Дж/кг, и скрытая теплота парообразования, составляющая 2258,10 3 Дж/кг, т.е. для превращения 1 кг льда в жидкость и 1 кг жидкой воды в пар нужны огромные затраты энергии. Это свидетельствует о высокой энергоемкости воды, предопределяющей ее исключительную роль как аккумулятора энергии при протекании природных процессов.
Диэлектрическая постоянная воды ( )
Величинадиэлектрической постоянной для воды является наиболее высокой из всех жидкостей и равна 80,1 при температуре 20 о С. при температуре около 0 о С составляет около 82. Это означает, что при растворении в воде солей, сила электрического взаимодействия между разноименно заряженными частицами уменьшается в 80 раз, в результате чего соли диссоциируют на ионы. У большинства растворителей не выше 50, у неполярных жидкостей (бензин, керосин) не более 3. Это свойство воды предопределяет явлениеэлектролитической диссоциации , т.е. способность солей, кислот, щелочей распадаться в водных растворах на разноименно заряженные ионы. Вода инертна как растворитель. Она привносит питательные вещества в живые организмы и выносит шлаки и заменить ее нечем. Т.о. и без этого свойства водыжизнь на Земле была бы невозможна.
Вода растворяет минералы, но они вновь возрождаются, если воду испарить. Эта особенность имеет колоссальное геологическое и биологическое значение, предопределяя водные круговороты самых разных порядков, которые проходят за несколько часов (в живых организмах) и длятся многие миллионы лет в недрах Земли (геологические). По-видимому, и появление жизни на Земле в значительной степени связано с этим удивительным свойством воды.
Плотность воды .
Все вещества обладают максимальной плотностью при температуре плавления, кроме воды.Максимальная плотность воды (1,0 г/см 3) соответствует т-ре 3,98 о; плотность льда 0,918 г/см 3 ; только вода не тонет в собственном расплаве; на это обратил внимание еще Фалес Милетский. При замерзании воды образуется тонкая защитная корка льда, обеспечивающая сохранение водоемов, прежде всего – Мирового океана – главного регулятора воздушного режима планеты. И без этого свойства водыжизнь обрела бы совсем другие формы.
1.2. Представления о скрытой структуре воды
Структура воды. Тридцатые годы ХХ века принесли новое крупное открытие, связанное с изучением воды: английские физики Дж. Бернал и Р. Фаулер на основании рентгенографических и спектроскопических исследований установили, что молекулы воды определенным образом упорядочены, каждая молекула воды окружена по тетраэдру четырьмя другими. Тем самым была подтверждена высказанная в конце XVIII в. В. Рентгеном мысль о сложном строении жидкой воды и существовании между отдельными молекулами дополнительных связей. Это явление ученые называют структурой воды, хотя понятно, что полностью отождествлять его с кристаллической решеткой твердых веществ нельзя, так как жидкая вода является смесью мономерных и полимерных молекул, связи между отдельными мономерами динамичны: они постоянно появляются, разрушаются, усиливаются, ослабевают.
Главной причиной существования структуры воды является особый тип связи между отдельными атомами – водородной. Эта связь имеет электростатическую природу, но она слабее нормальной валентной связи между атомами водорода и кислорода, образующими отдельные мономеры. В каждом мономере Н 2 О расстояние между атомами водорода и кислорода составляет 0,1 нм, а угол, образуемый между валентными связями, - около 105º. В водородной связи расстояние между атомами увеличивается до 0,176 нм, причем оно не является строго постоянным.
Существует несколько моделей структуры воды, основанных на идее соединения отдельных мономеров водородной связью. Дж. Бернал и Р. Фаулер предположили существование трех типов расположения молекул: а) структуры, приближающиеся к кристаллической решетке льда, существуют при температуре от 0 до 4ºС; б) структуры типа кварца, преобладают при температуре 4-200ºС; в) структуры с плотной упаковкой, характерной для нормальных жидкостей (почти лишенные водородных связей), возникают при температуре выше 200 ºС [Блох А.М. Структура воды и геологические процессы.Л., 1969, с.216].
Интересный подход к интерпретации структурных особенностей воды предложил итальянский физик М. Анджено (1967 г.). Согласно его представлениям, каждая молекула воды может участвовать не более чем в двух, но так называемых коллективных, водородных связях, в результате чего сочетание валентных и водородных связей образует звенья разных типов (рис.1).
Рис. 1. Молекулярные агрегаты в жидкой воде (по М. Аджендо).
Эти звенья могут формировать цепочки, кольца и более сложные системы, непрерывно образующиеся, разрушающиеся, обменивающиеся молекулами. При этом общее число водородных мостиков в системе остается постоянным и возможные типы агрегатов присутствуют в воде в разных пропорциях в статическом равновесии, определяемом температурой. Кольца из шести молекул, видимо, приближаются к структуре льда.
С позиций структурного строения жидкой воды объясняются все ее аномальные свойства. Необходимость разрушения водородных связей предопределяет высокую энергоемкость воды, в результате чего аномально высокими становятся точки плавления и кипения, теплоемкость и скрытые теплоты плавления и парообразования. При охлаждении воды в интервале температур от 4 до 0ºС происходит перестройка структуры от более плотной тетрагональной к гексагональной упаковке льда. Прочная связь между молекулами воды делает ее инертной по отношению к растворенным веществам. Поскольку структура воды формируется электростатическими связями, на нее воздействуют различные поля (температурное, геодинамическое, магнитное, электрическое).
С повышением температуры структура воды начинает разрушаться. Оценки разных авторов, подсчитывающих процент молекул с сохранившимися водородными связями, близки: в холодной воде структурировано около половины молекул, по достижении температуры 100ºС структурные связи сохраняются примерно у 30 % молекул, а при приближении к критической температуре (374 ºС) структурированные молекулы исчезают.
При приложении давления молекулы жидкостей сближаются и их вязкость повышается. Совсем по-иному ведет себя вода. Первые ступени нагрузок приводят к перестройке структуры воды, заполнению межмолекулярных пустот, сопровождающемуся уменьшением ее вязкости, и только начиная с давлений около 100 МПа (достаточно высоких для природных условий) начинается постепенное повышение вязкости.
1.3. Разновидности воды
Структурные свойства воды и существование нескольких изотопов кислорода и водорода являются причиной того, что вода может образовывать много физико-химических разновидностей. Вот некоторые из них.
Представления об активированной воде
Опыты новосибирских ученых (Ф.А.Летников и др.) по обработке воды в автоклавах при температурах 300-400 ºС и давлениях до 100 МПа показали, что при этом усиливается растворяющая способность воды по многим минералам (к сульфидам, гипсу, кварцу), уменьшается рН, увеличивается электропроводность. Влияние температуры и давления на изменение структур воды навели специалистов на мысль о возможности имитации свойств воды, находящейся на больших глубинах (т.е. при высоких температурах и давлениях), и привели к открытию так называемой активированной воды . После обработки воды в автоклавах Обнаружение активированного состояния у воды термальных минеральных источников наводит мысль о том, что целебные свойства некоторых типов минеральных вод могут быть связаны не только с их химическим составом, но и с повышением биологической активности воды при ее активации. Открытие явления активации не только позволяет объяснить некоторые свойства гидротермальных растворов, но и открывает перспективы искусственного приготовления минеральных вод.
Влияние электрического поля
При помещении воды в электрическое поле могут произойти определенные изменения ее структуры. Так, электрический ток ослабляет структурные связи, и после обработки воды переменным электрическим током скорость испарения увеличивается по имеющимся немногочисленным данным на 11-18 %). Замечено влияние электрических полей на интенсивность поглощения водой световых лучей.
Влияние магнитного поля
Положительное воздействие на человеческий организм воды, побывавшей в магнитном поле , было замечено еще в средние века. В 1945 г. бельгийский инженер Т. Вермайерн запатентовал простой способ уменьшения интенсивности образования накипи в паровых котлах с помощью предварительной магнитной обработки воды. В настоящее время этот метод борьбы с накипью находит очень широкое применение. Достаточно сослаться на опыт многих ТЭЦ (Ростовская, Астраханская и др.), ГРЭС (Симферопольская, Саратовская), заводов, шахт и других предприятий.
При замачивании семян многих сельскохозяйственных культур, цветов и фруктов омагниченной водой резко возрастает их всхожесть. В настоящее время отечественной промышленностью выпускаются даже специальные устройства для омагничивания воды, рекомендуемые сельскохозяйственным предприятиям и садоводам.
Вода- II . В начале 60-х годов XX в. Н.Н. Федякин обнаружил чрезвычайно интересное явление: при конденсировании паров воды в тонких кварцевых капиллярах диаметром 5-20 мкм) образуется жидкость, которая по свойствам значительно отличается от обычной воды. Позднее эта жидкость, названная вода-II, изучалась крупными российскими и зарубежными исследователями, в частности большим коллективом ученых во главе с Б.В. Дерягиным. Было обнаружено, что вода-II представляет собой вязкую жидкость с плотностью около 1 г/см 3 и показателем преломления 1,49 (против 1,33 для обычной воды). Эта жидкость переходит в твердое состояние при охлаждении до минус 35÷40 ºС без скачка объема. Температура кипения воды-II при атмосферном давлении примерно 250 ºС. Вода-II обладает уникальным инфракрасным спектром поглощения, не отвечающим ни одному из известных веществ. Модифицированное состояние полученного вещества устойчиво и сохраняется при перегонке (эта процедура была использована для укрупнения порций воды-II). Было доказано, что вновь полученное вещество строго отвечает формуле Н 2 О; кварц, видимо, выполняет роль катализатора при синтезе воды-II.
Исследование воды-II привело Б.В. Дерягина и его сотрудников к выводу о возможности существования особого типа прочной молекулярной связи между водородом и кислородом, формирующей полимеры, состоящие из 6-10 мономерных молекул Н 2 О. Пока трудно определить роль воды-II в природных системах, но ясно, что ее исследование сулит определенные перспективы в изучении глубинных геологических процессов.
Тяжелая вода. В настоящее время известно три изотопа водорода (1 Н-протий, 2 Н –дейтерий D, 3 Н- тритий Т) и три изотопа кислорода (16 О, 17 О, 18 О). Это означает, что может существовать значительное количество разновидностей воды с разными изотопными комбинациями. Наиболее устойчивой из них является так называемая тяжелая вода D 2 O, содержащаяся в виде примеси в обычной воде в сотых долях процента. По свойствам тяжелая вода существенно отличается от обычной: максимальная плотность отмечается при t=11,2 ºС и составляет 1,056 г/см 3 ; вязкость на 20 % выше; диэлектрическая постоянная на 0,3-0,5 % ниже. Температура плавления тяжелой воды 3,8 ºС; температура кипения 101,4 ºС. Судя по приведенным данным и ряду других данных, дейтериевая связь является еще более прочной, чем водородная.. Используется тяжелая вода как замедлитель нейтронов атомных реакторах. Тяжелая вода токсична, живые существа и растения в ней погибают. Некоторые ученые связывают эволюцию жизни на нашей планете с изменениями концентрации дейтерия в воде: в частности, пониженной по сравнению с современной концентрацией дейтерия в воде объясняют существование гигантских травоядных в мезозое. Впрочем, положения эти носят спорный характер.
Приведенные здесь примеры разновидностей воды, предопределяемых ее сложной структурой и изотопией, показывают, насколько неисчерпаемы перспективы появления новых открытий при изучении такого удивительного вещества, как вода.
РЕФЕРАТ
«Плавление тел»
Выполнила:
Присяжнюк Ольга 9-А
Проверила:
Невзорова Татьяна Игоревна
Введение
Расчет количества теплоты
Плавление
Удельная теплота плавления
Плавление металлов
Температура плавления и кипения воды
Расплавы
Интересное о плавлении
Заключение (выводы)
Список использованной литературы
Введение
Агрега́тное состоя́ние - состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состоянием причисляют плазму. Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе - Эйнштейна.
Изменения агрегатного состояния суть термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое - плавление; из жидкого в газообразное - испарение и кипение; из твёрдого в газообразное - сублимация; из газообразного в жидкое или твёрдое - конденсация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Твёрдое тело: Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия. Присутствует как дальний, так и ближний порядок.
Жидкость: Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Жидкость легко принимает форму сосуда, в который она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места. Присутствует только ближний порядок.
Газ: Состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Другие состояния: При глубоком охлаждении некоторые (далеко не все) вещества переходят в сверхпроводящее или сверхтекучее состояние. Эти состояния, безусловно, являются отдельными термодинамическими фазами, однако их вряд ли стоит называть новыми агрегатными состояниями вещества в силу их неуниверсальности. Неоднородные вещества типа паст, гелей, суспензий, аэрозолей и т. д., которые при определённых условиях демонстрируют свойства как твёрдых тел, так и жидкостей и даже газов, обычно относят к классу дисперсных материалов, а не к каким-либо конкретным агрегатным состояниям вещества.
Плавление
Рис. 1. Состояние чистого вещества (диаграмма)

Рис. 2. Температура плавления кристаллического тела

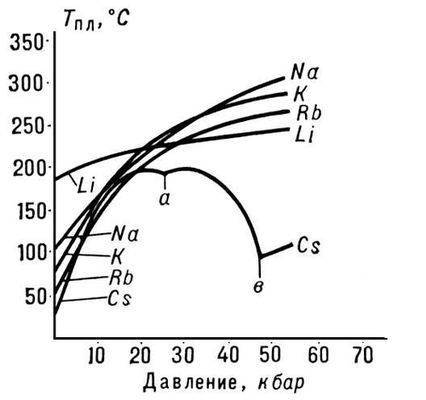
Рис. 3. Температура плавления щелочных металлов
Плавление - переход вещества из кристаллического (твёрдого) состояния в жидкое; происходит с поглощением теплоты (фазовый переход I рода). Главными характеристиками П. чистых веществ являются температура плавления (Тпл) и теплота, которая необходима для осуществления процесса П. (теплота плавления Qпл).
Температура П. зависит от внешнего давления р; на диаграмме состояния чистого вещества эта зависимость изображается кривой плавления (кривой сосуществования твёрдой и жидкой фаз, AD или AD" на рис. 1). П. сплавов и твёрдых растворов происходит, как правило, в интервале температур (исключение составляют эвтектики с постоянной Тпл). Зависимость температуры начала и окончания П. сплава от его состава при данном давлении изображается на диаграммах состояния специальными линиями (кривые ликвидуса и солидуса, см. Двойные системы). У ряда высокомолекулярных соединений (например, у веществ, способных образовывать жидкие кристаллы) переход из твёрдого кристаллического состояния в изотропное жидкое происходит постадийно (в некотором температурном интервале), каждая стадия характеризует определённый этап разрушения кристаллической структуры.
Наличие определённой температуры П.- важный признак правильного кристаллического строения твёрдых тел. По этому признаку их легко отличить от аморфных твёрдых тел, которые не имеют фиксированной Тпл. Аморфные твёрдые тела переходят в жидкое состояние постепенно, размягчаясь при повышении температуры (см. Аморфное состояние). Самую высокую температуру П. среди чистых металлов имеет вольфрам (3410 °С), самую низкую - ртуть (-38,9 °С). К особо тугоплавким соединениям относятся: TiN (3200 °С), HfN (3580 °С), ZrC (3805 °С), TaC (4070 °С), HfC (4160 °С) и др. Как правило, для веществ с высокой Тпл характерны более высокие значения Qпл. Примеси, присутствующие в кристаллических веществах, снижают их Тпл. Этим пользуются на практике для получения сплавов с низкой Тпл (см., например, Вуда сплав с Тпл = 68 °С) и охлаждающих смесей.
П. начинается при достижении кристаллическим веществом Тпл. С начала П. до его завершения температура вещества остаётся постоянной и равной Тпл, несмотря на сообщение веществу теплоты (рис. 2). Нагреть кристалл до Т > Тпл в обычных условиях не удаётся (см. Перегрев), тогда как при кристаллизации сравнительно легко достигается значительное переохлаждение расплава.
Характер зависимости Тпл от давления р определяется направлением объёмных изменений (DVпл) при П. (см. Клапейрона - Клаузиуса уравнение). В большинстве случаев П. вещества сопровождается увеличением их объёма (обычно на несколько %). Если это имеет место, то возрастание давления приводит к повышению Тпл (рис. 3). Однако у некоторых веществ (воды, ряда металлов и металлидов, см. рис. 1) при П. происходит уменьшение объёма. Температура П. этих веществ при увеличении давления снижается.
П. сопровождается изменением физических свойств вещества: увеличением энтропии, что отражает разупорядочение кристаллической структуры вещества; ростом теплоёмкости, электрического сопротивления [исключение составляют некоторые полуметаллы (Bi, Sb) и полупроводники (Ge), в жидком состоянии обладающие более высокой электропроводностью]. Практически до нуля падает при П. сопротивление сдвигу (в расплаве не могут распространяться поперечные упругие волны, см. Жидкость), уменьшается скорость распространения звука(продольных волн) и т.д.
Согласно молекулярно-кинетическим представлениям, П. осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки - вакансий; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др., см. Дефекты в кристаллах). В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Тпл в кристалле создаётся критическая концентрация дефектов, начинается П.- кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при П. теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах (см. Дальний порядок и ближний порядок). В самих же субмикроскопических областях ближний порядок в расположении атомов при П. существенно не меняется (координационное число расплава при Тпл в большинстве случаев остаётся тем же, что и у кристалла). Этим объясняются меньшие значения теплот плавления Qпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их П.
Процесс П. играет важную роль в природе (П. снега и льда на поверхности Земли, П. минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
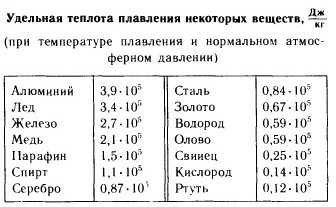
Удельная теплота плавления
Уде́льная теплота́ плавле́ния (также: энтальпия плавления; также существует равнозначное понятие уде́льная теплота́ кристаллиза́ции) - количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого (кристаллического) состояния в жидкое (то же количество теплоты выделяется при кристаллизации вещества). Теплота плавления - частный случай теплоты фазового перехода I рода. Различают удельную теплоту плавления (Дж/кг) и молярную (Дж/моль).
Удельная теплота плавления обозначается буквой (греческая буква лямбда) Формула расчёта удельной теплоты плавления:
где - удельная теплота плавления, - количество теплоты, полученное веществом при плавлении (или выделившееся при кристаллизации), - масса плавящегося (кристаллизующегося) вещества.
Плавление металлов
При плавлении металлов необходимо соблюдать известные правила. Положим, что собираются плавить свинец и цинк. Свинец быстро расплавится, имея температуру плавления 327°; цинк же еще долго будет оставаться твердым, так как его температура плавления выше 419°. Что произойдет со свинцом при таком перегреве? Он начнет покрываться пленкой радужного цвета, а потом его поверхность окажется скрытой под слоем неплавящегося порошка. Свинец угорел от перегрева, окислился, соединившись с кислородом воздуха. Этот процесс, как известно, происходит и при обычной температуре, но при нагревании он идет гораздо быстрее. Таким образом, к тому времени, когда начнет плавиться цинк, останется очень мало металлического свинца. Сплав получится совсем не того состава, как предполагался, и потеряется большое количество свинца в виде угара. Ясно, что надо сначала плавить более тугоплавкий цинк и затем класть в него свинец. То же самое произойдет, если сплавлять цинк с медью или латунью, разогревая сначала цинк. Цинк угорит к моменту расплавления меди. Значит, надо всегда сначала плавить металл с более высокой температурой плавления.
Но одним этим угара не избежать. Если правильно разогретый сплав долго держать на огне, опять образуется на поверхности жидкого металла пленка как следствие угара. Ясно, что опять обратится в окись более легкоплавкий металл и состав сплага изменится; значит, нельзя металл долго перегревать без надобности. Поэтому стараются всячески уменьшить угар металла, укладывая его компактной массой; мелкие куски, опилки, стружки сначала „пакетируют”, плавят куски более или менее одинаковой величины, ведут нагрев при достаточной температуре, оберегают поверхность металла от соприкосновения с воздухом. Для этой цели мастер может брать буру или просто прикрывать поверхность металла слоем золы, которая всегда будет плавать наверху (благодаря своему меньшему удельному весу) и при выливании металла не помешает. При застывании металла происходит еще одно явление, вероятно также знакомое юным мастерам. Металл, застывая, уменьшается в объеме, причем это уменьшение происходит за счет внутренних, еще не застывших частиц металла. На поверхности отливки или внутри нее образуется более или менее значительное воронкообразное углубление, так называемая усадочная раковина. Обычно форму делают так, чтобы усадочные раковины получились в тех местах отливки, которые впоследствии удаляются, стараясь по возможности предохранить самое изделие. Понятно, что усадочные раковины портят отливку и иногда могут сделать ее негодной. После расплавления металл несколько перегревают, чтобы он был жиже и горячее и поэтому лучше заполнил бы детали формы и не застыл бы преждевременно от соприкосновения с более холодной формой.
Так как температура плавления сплавов обычно ниже температуры плавления наиболее тугоплавкого из составляющих сплав металлов, то иногда выгодно поступать наоборот: сперва расплавить более легкоплавкий металл, а затем - более тугоплавкий. Однако это допустимо лишь для металлов, не сильно окисляющихся, или при условии предохранения этих металлов от излишнего окисления. Металла надо брать больше, чем требуется для самой вещи, чтобы он заполнил не только форму, но и литниковый канал. Ясно, что надо сначала рассчитать необходимое количество металла.
Температура плавления и кипения воды
Самое удивительное и благостное для живой природы свойство воды - это ее способность при "нормальных" условиях быть жидкостью. Молекулы очень похожих на воду соединений (например, молекулы H2S или H2Se) намного тяжелее, а образуют при тех же условиях газ. Тем самым вода как будто противоречит закономерностям таблицы Менделеева, которая, как известно, предсказывает, когда, где и какие свойства веществ будут близки. В нашем случае из таблицы следует, что свойства водородных соединений элементов (называемых гидридами), расположенных в одних и тех же вертикальных столбцах, с ростом массы атомов должны изменяться монотонно. Кислород - элемент шестой группы этой таблицы. В этой же группе находятся сера S (с атомным весом 32), селен Se (с атомным весом 79), теллур Te (с атомным весом 128) и поллоний Po (с атомным весом 209). Следовательно, свойства гидридов этих элементов должны меняться монотонно при переходе от тяжелых элементов к более легким, т.е. в последовательности H2Po → H2Te → H2Se → H2S → H2O. Что и происходит, но только с первыми четырьмя гидридами. Например, температуры кипения и плавления растут при увеличении атомного веса элементов. На рисунке крестиками отмечены температуры кипения этих гидридов, а кружочками - температуры плавления.

Как видно, при уменьшении атомного веса температуры снижаются совершенно линейно. Область существования жидкой фазы гидридов становится все более "холодной", и если бы гидрид кислорода Н2О был нормальным соединением, похожим на своих соседей по шестой группе, то жидкая вода существовала бы в диапазоне от -80° С до -95° С. При более высоких температурах Н2О всегда была бы газом. К счастью для нас и всего живого на Земле, вода аномальна, она не признает периодической закономерности а следует своим законам.
Объясняется это довольно просто - большая часть молекул воды соединена водородными связями. Именно этими связями отличается вода от жидких гидридов H2S, H2Se и H2Te. Если бы их не было, то вода кипела бы уже при минус 95 °C. Энергия водородных связей достаточно велика, и разорвать их можно лишь при значительно более высокой температуре. Даже в газообразном состоянии большое число молекул H2O сохраняет свои водородные связи, объединяясь в димеры (H2O)2. Полностью водородные связи исчезают только при температуре водяного пара 600 °C.
Напомним, что кипение заключается в том, что пузыри пара образуются внутри кипящей жидкости. При нормальном давлении чистая вода кипит при 100 "С. В случае подведения тепла через свободную поверхность будет ускоряться процесс поверхностного испарения, но объёмного парообразования, характерного для кипения, не возникает. Кипение может быть осуществлено и понижением внешнего давления, так как в этом случае давление пара, равное внешнему давлению, достигается при более низкой температуре. На вершине очень высокой горы давление и соответственно точка кипения настолько понижаются, что вода становится непригодной для варки пищи - не достигается требуемая температуры воды. При достаточно высоком давлении воду можно нагреть настолько, что в ней может расплавиться свинец (327 °С), и все же она не будет кипеть.
Помимо сверхбольших температур кипения плавления (причем последний процесс требует слишком большой для такой простой жидкости теплоты плавления), аномален сам диапазон существования воды - сто градусов, на которые разнятся эти температуры, - довольно большой диапазон для такой низкомолекулярной жидкости, как вода. Необычайно велики пределы допустимых значении переохлаждения и перегрева воды - при аккуратном нагревании или охлаждении вода остается жидкой от -40 °C до +200 °C. Тем самым температурный диапазон, в котором вода может оставаться жидкой, расширяется до 240 °C.
При нагревании льда сначала температура его повышается, но с момента образования смеси воды со льдом температура будет оставаться неизменной до того момента, пока не расплавится весь лёд. Это объясняется тем, что тепло, подводимое к тающему льду, прежде всего расходуется только на разрушение кристаллов. Температура тающего льда остаётся неизменной до тех пор, пока не произойдёт разрушение всех кристаллов (см. скрытую теплоту плавления).
Расплавы
Расплавы - жидкое расплавленное состояние веществ при температурах, в определённых границах удалённых от критической точки плавления и расположенных ближе к температуре плавления. Природа расплавов по своей сути определяется видом химических связей элементов в расплавленном веществе.
Расплавы находят широкое применение в металлургии, стекловарении и других областях техники. Обычно расплавы имеют сложный состав и содержат различные взаимодействующие компоненты (см. фазовая диаграмма).
Расплавы бывают
1.Металлические (Мета́ллы (название происходит от лат. metallum - шахта, рудник) - группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск);
2.Ионные (Ио́н (др.-греч. ἰόν - идущее) - одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов атомом или молекулой. Ионизация (процесс образования ионов) может происходить при высоких температурах, под воздействием электрического поля);
3.Полупроводниковые с ковалентными связями между атомами (Полупроводники́ - материалы, которые по своей удельной проводимости занимают промежуточное место между проводниками и диэлектриками и отличаются от проводников сильной зависимостью удельной проводимости от концентрации примесей, температуры и различных видов излучения. Основным свойством этих материалов является увеличение электрической проводимости с ростом температуры);
4.Органические расплавы с ван-дер-ваальсовыми связями;
5.Высокополимерные (Полимеры (греч. πολύ- - много; μέρος - часть) - неорганические и органические, аморфные и кристаллические вещества, получаемые путём многократного повторения различных групп атомов, называемых «мономерными звеньями», соединённых в длинные макромолекулы химическими или координационными связями)
Расплавы по типу химических соединений бывают:
1.Солевые;
2.Оксидные;
3.Оксидно-силикатные (шлаковые) и др.
Расплавы с особыми свойствами:
1.Эвтектические
Интересное о плавлении
Ледяные зёрна и звезды.
Внесите кусок чистого льда в тёплую комнату и понаблюдайте за тем, как он тает. Довольно быстро выяснится, что лёд, казавшийся монолитным и однородным, распадается на множество мелких зёрен - отдельных кристаллов. В объёме льда они расположены хаотично. Не менее интересную картину можно увидеть, когда лёд плавится с поверхности.
Поднесите к лампе гладкий кусок льда и подождите, пока он начнёт плавиться. Когда плавление затронет внутренние зёрна, там начнут появляться очень мелкие узоры. В сильную лупу видно, что они имеют форму шестиугольных снежинок. На самом же деле это протаявшие впадинки, заполненные водой. Форма и направление их лучей соответствуют ориентации монокристаллов льда. Эти узоры называются „звёздочками Тиндаля“ в честь английского физика, открывшего и описавшего их в 1855 году. "Звездочки Тиндаля", похожие на снежинки, на самом деле - впадинки на поверхности подтаявшего льда размером около 1,5 мм, заполненные водой. В их центре видны воздушные пузырьки, возникшие из-за разности объемов растаявшего льда и талой воды.
ЗНАЕТЕ ЛИ ВЫ?
Существут металл, так называемый, сплав Вуда, который можно запросто расплавить даже в теплой воде (+68 градусов Цельсия). Так при размешивании сахара в стакане металлическая ложка из этого сплава растает быстрее сахара!
Самое тугоплавкое вещество - карбид тантала ТаС0-88 плавится при температуре 3990°С.
В 1987 году немецкие исследователи смогли переохладить воду до температуры –700С, сохраняя ее в жидком состоянии.
Иногда, чтобы снег на тротуарах быстрее таял, их посыпают солью. Плавление льда происходит потому, что образуется раствор соли в воде, температура замерзания которого ниже температуры воздуха. Раствор просто стекает с тротуара.
Интересно, что ноги стынут больше на мокром тротуаре, так как температура раствора соли и воды ниже температуры чистого снега.
Если из чайника налить чай в две кружки: с сахаром и без сахара, то чай в кружке с сахаром будет холоднее, т.к. на растворение сахара (на разрушение его кристаллической решетки) тоже расходуется энергия.
При сильных морозах для восстановления гладкости льда поливку катка производят горячей водой.. Горячая вода расплавляет тонкий верхний слой льда, не так быстро замерзает, успевает растечься, и поверхность льда получается очень гладкой.
Заключение (выводы)
Плавление - переход вещества из твердого состояния в жидкое.
При нагревании увеличивается температура вещества, и возрастает скорость теплового движения частиц, при этом увеличивается внутренняя энергия тела.
Когда температура твердого тело достигает температуры плавления, кристаллическая решетка твердого вещества начинает разрушаться. Таким образом, основная часть энергия нагревателя, проводимая к твердому телу, идет на уменьшение связей между частицами вещества, т. е. на разрушение кристаллической решетки. При этом возрастает энергия взаимодействия между частицами.
Расплавленное вещество обладает большим запасом внутренней энергии, чем в твердом состоянии. Оставшаяся часть теплоты плавления расходуется на совершение работы по изменению объема тела при его плавлении.
При плавлении объем большинства кристаллических тел увеличивается (на 3-6%), а при отвердевании уменьшается. Но, существуют вещества, у которых при плавлении объем уменьшается, а при отвердевании - увеличивается. К ним относятся, например, вода и чугун, кремний и некоторые другие. . Именно поэтому лёд плавает на поверхности воды, а твердый чугун - в собственном расплаве.
Твердые тела, называемые аморфными (янтарь, смола, стекло) не имеют определенной температуры плавления.
Количество теплоты, необходимой для плавления вещества, равно произведению удельной теплоты плавления на массу данного вещества.
Удельная теплота плавления показывает, какое кол теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при темп плавления.
Единицей удельной теплоты плавления в СИ служит 1Дж/кг.
В процессе плавления температура кристалла остается постоянной. Эта температура называется температурой плавления. У каждого вещества своя температура плавления.
Температура плавления для данного вещества зависит от атмосферного давления.
Список использованной литературы
Данные электронной свободной энциклопедии «Викпедия»
ru./wiki/Заглавная_страница
Сайт «Класс!ная физика для любознательных» class-fizika.narod/8_11.htm
Сайт «Физические свойства воды»
all-about-water/boiling-temperature.php
Сайт «Металлы и конструкции»
metaloconstruction/osnovy-plavleniya-metallov/
Похожие рефераты:
Основное свойство жидкости: изменение формы под действием механического воздействия. Идеальные и реальные жидкости. Понятие ньютоновских жидкостей. Методика определения свойств жидкости. Образование свободной поверхности и поверхностное натяжение.
Камчатская Государственная Академия Рыболовецкого флота РЕФЕРАТ На тему: "Фазовое равновесие и фазовые превращения" Писал: Принял: Студент ИЭФ Исаков А.Я.
Это , которую иногда называют скрытой теплотой (Скрытой теплотой называют потому, что процесс плавления (и отвердевания) идет при постоянной температуре, нагревание (охлаждение) как бы отсутствует, хотя поглощение (выделение) теплоты идет). Удельная скрытая теплота плавления — это количество теплоты, необходимое для превращения единицы массы твердого вещества в жидкость без изменения температуры . Это также количество отдаваемой тепловой энергии, когда единица массы жидкости превращается в твердое вещество без изменения температуры.
Исследование. Определить удельную скрытую теплоту плавления льда
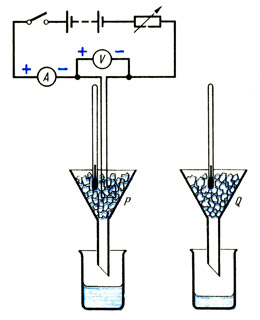 Положите равные количества битого льда в две одинаковые воронки Р и Q (см. рис.). Если лед был взят из морозилки, то следует подождать, пока он не приобретет температуру 0 o С и не начнет таять. Поместите в воронку Р иммерсионный нагреватель, соединенный с амперметром, вольтметром и реостатом, таким образом, чтобы он был полностью покрыт льдом.
Положите равные количества битого льда в две одинаковые воронки Р и Q (см. рис.). Если лед был взят из морозилки, то следует подождать, пока он не приобретет температуру 0 o С и не начнет таять. Поместите в воронку Р иммерсионный нагреватель, соединенный с амперметром, вольтметром и реостатом, таким образом, чтобы он был полностью покрыт льдом.
Сразу после включения нагревателя поместите под воронки Р и Q сухие лабораторные стаканы известной массы. Отметьте показания амперметра и вольтметра и в случае необходимости при помощи реостата поддерживайте их постоянными в ходе эксперимента. Через несколько минут, когда в стакане под воронкой Р соберется некоторое количество воды, отметьте время, уберите стаканы и выключите нагреватель. Определите массы стаканов с их содержимым.
В удельная скрытая теплота l имеет единицу Дж х кг -1 . Если вещество массой m переходит из твердого состояния в жидкое, то приобретение количества теплоты ΔQ определяется по формуле ΔQ = mƖ.
Предположим, что получены следующие результаты:
масса стакана под Р перед экспериментом = m 1 кг
масса стакана под Р после эксперимента = m 2 кг
масса льда, растаявшего в Р в ходе эксперимента = (m 2 -m 1) кг
масса стакана под Q перед экспериментом = m 3 кг
масса стакана под Q после эксперимента = m 4 кг
масса льда, растаявшего в Q в ходе эксперимента, = (m 4 - m 3) кг
показание амперметра = I, А
показание вольтметра = V, V
Время, в течение которого был включен нагреватель, = t мин = 60t с
Воронка Q контрольная. Она позволяет определить массу льда, растаявшего при комнатной температуре в ходе эксперимента. Логично было бы предположить, что лед такой же массы растает в Р. Таким образом, дополнительная масса льда, растопленного нагревателем, составляет:
(m 2 - m 1) - (m 4 - m 3) = m.
Если Ɩ — удельная скрытая теплота плавления
льда, то тепловая энергия, необходимая для того, чтобы лед растаял, составит ml Дж. Она должна быть равна электрической энергии, переданной нагревателем, которая составляет VI x 60t. Отсюда ml = VI x 60t Ɩ = Vl x 60t / m Дж х кг -1
Значение удельной теплоты плавления льда составляет 336 000 Дж х кг -1 , или 336 000 Дж тепловой энергии, необходимой для плавления 1 кг льда при 0 °С. То же самое количество теплоты освобождается при замерзании 1 кг воды при 0 °С.
Если исходная льда ниже 0 °С, то для повышения температуры до 0 °С понадобится дополнительная теплота перед тем, как лед начнет таять.
Многие дома имеют погреба, и на зиму туда часто складывают овощи. Благодаря изолирующему свойству земли погреб остается относительно холодным летом и относительно теплым зимой. Когда ожидается суровая зима, то в погреб ставится бочка с водой. Когда она замерзает, то высвободившаяся скрытая тепловая энергия помогает поддерживать в погребе температуру, близкую к 0 °С, что предохраняет овощи от замерзания.






