Tipuri de reacții chimice în exemple de chimie organică. Tipuri de reacții chimice în chimie organică plan de lecție la chimie (clasa a 10-a) pe tema. Clasificarea reacțiilor organice după mecanism. Exemple
Multe reacții de substituție deschid calea spre producerea unei varietăți de compuși care au aplicații economice. Substituția electrofilă și nucleofilă joacă un rol uriaș în știința chimică și în industrie. În sinteza organică, aceste procese au o serie de caracteristici cărora ar trebui să se acorde atenție.
Varietate de fenomene chimice. Reacții de substituție
Modificările chimice asociate cu transformarea substanțelor se disting printr-o serie de caracteristici. Rezultatele finale și efectele termice pot varia; Unele procese ajung la finalizare, în altele are loc o modificare a substanțelor, adesea însoțită de o creștere sau scădere a gradului de oxidare. La clasificarea fenomenelor chimice în funcție de rezultatul lor final, se acordă atenție diferențelor calitative și cantitative dintre reactivi și produse. Pe baza acestor caracteristici se pot distinge 7 tipuri de transformări chimice, inclusiv substituția, care urmează schema: A-B + C A-C + B. O notare simplificată a unei întregi clase de fenomene chimice dă ideea că printre substanțele inițiale există un așa-numitul „atac” o particulă care înlocuiește un atom, un ion sau o grupare funcțională într-un reactiv. Reacţia de substituţie este caracteristică de limitare şi
Reacțiile de substituție pot avea loc sub forma unui dublu schimb: A-B + C-E A-C + B-E. Una dintre subspecii este deplasarea, de exemplu, a cuprului cu fier dintr-o soluție de sulfat de cupru: CuSO 4 + Fe = FeSO 4 + Cu. Particula „atacatoare” poate fi atomi, ioni sau grupări funcționale

Substituție homolitică (radical, SR)
Cu mecanismul radical de rupere a legăturilor covalente, o pereche de electroni comună diferitelor elemente este distribuită proporțional între „fragmentele” moleculei. Se formează radicalii liberi. Acestea sunt particule instabile, a căror stabilizare are loc ca urmare a transformărilor ulterioare. De exemplu, când se produce etan din metan, apar radicali liberi care participă la reacția de substituție: CH4CH3. + .N; CH 3. +.CH3 → C2H5; N. + .N → N2. Scindarea legăturii homolitice conform mecanismului de substituție de mai sus este de natură în lanț. În metan, atomii de H pot fi înlocuiți succesiv cu clor. Reacția cu bromul are loc în mod similar, dar iodul nu poate înlocui direct hidrogenul în alcani; fluorul reacționează cu ei prea puternic.

Metoda de rupere a legăturii heterolitice
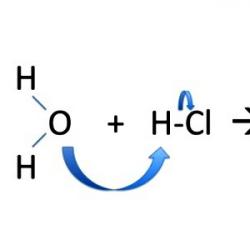
Cu mecanismul ionic al reacțiilor de substituție, electronii sunt distribuiți neuniform între particulele nou formate. Perechea de electroni de legătură merge în întregime către unul dintre „fragmente”, cel mai adesea către partenerul de legătură spre care a fost deplasată densitatea negativă din molecula polară. Reacțiile de substituție includ formarea de alcool metilic CH3OH. În brometanul CH3Br, scindarea moleculei este heterolitică, iar particulele încărcate sunt stabile. Metilul capătă o sarcină pozitivă, iar bromul capătă o sarcină negativă: CH 3 Br → CH 3 + + Br - ; NaOH → Na + + OH -; CH3 + + OH - → CH3OH; Na ++ Br - ↔ NaBr.

Electrofili și nucleofili
Particulele cărora le lipsesc electroni și îi pot accepta sunt numite „electrofile”. Acestea includ atomi de carbon conectați la halogeni din haloalcani. Nucleofilii au o densitate de electroni crescută; ei „donează” o pereche de electroni atunci când creează o legătură covalentă. În reacțiile de substituție, nucleofilii bogați în sarcini negative sunt atacați de electrofilii lipsiți de electroni. Acest fenomen este asociat cu mișcarea unui atom sau a unei alte particule - un grup ieșitor. Un alt tip de reacție de substituție este atacul unui electrofil de către un nucleofil. Este uneori dificil să distingem două procese și să atribui substituția unui tip sau altuia, deoarece este dificil de a indica cu exactitate care dintre molecule este substratul și care este reactivul. De obicei, în astfel de cazuri sunt luați în considerare următorii factori:
- natura grupului care părăsește;
- reactivitate nucleofilă;
- natura solventului;
- structura părții alchil.
Substituție nucleofilă (SN)
În timpul procesului de interacțiune într-o moleculă organică, se observă o creștere a polarizării. În ecuații, o sarcină parțială pozitivă sau negativă este indicată de o literă din alfabetul grecesc. Polarizarea legăturilor face posibilă aprecierea naturii rupturii sale și a comportamentului ulterioar al „fragmentelor” moleculei. De exemplu, atomul de carbon din iodmetan are o sarcină pozitivă parțială și este un centru electrofil. Atrage acea parte a dipolului de apă în care se află oxigenul, care are un exces de electroni. Când un electrofil interacționează cu un reactiv nucleofil, se formează metanol: CH 3 I + H 2 O → CH 3 OH + HI. Reacțiile de substituție nucleofilă au loc cu participarea unui ion sau a unei molecule încărcate negativ cu o pereche de electroni liberi care nu este implicată în crearea unei legături chimice. Participarea activă a iodometanului în reacțiile SN 2 se explică prin deschiderea sa la atacul nucleofil și mobilitatea iodului.

Substituție electrofilă (SE)
O moleculă organică poate conține un centru nucleofil, care se caracterizează printr-un exces de densitate electronică. Reacționează cu un reactiv electrofil lipsit de sarcini negative. Astfel de particule includ atomi cu orbitali liberi și molecule cu zone cu densitate electronică scăzută. Carbonul B, care are o sarcină „-”, interacționează cu partea pozitivă a dipolului de apă - cu hidrogen: CH 3 Na + H 2 O → CH 4 + NaOH. Produsul acestei reacții de substituție electrofilă este metanul. În reacțiile heterolitice, centrele încărcate opus ai moleculelor organice interacționează, ceea ce le face similare cu ionii din chimia substanțelor anorganice. Nu trebuie trecut cu vederea faptul că transformarea compușilor organici este rareori însoțită de formarea de cationi și anioni adevărați.

Reacții monomoleculare și bimoleculare
Substituția nucleofilă este monomoleculară (SN1). Acest mecanism este folosit pentru a hidroliza un produs important al sintezei organice - clorura de butil terțiar. Prima etapă este lentă; este asociată cu disocierea treptată în cation de carboniu și anion clorură. A doua etapă decurge mai repede, are loc reacția ionului de carboniu cu apa. înlocuirea halogenului din alcan cu o grupare hidroxi și obținerea unui alcool primar: (CH 3) 3 C—Cl → (CH 3) 3 C + + Cl - ; (CH3)3C + + H2O → (CH3)3C—OH + H+. Hidroliza într-o singură etapă a halogenurilor de alchil primare și secundare este caracterizată prin distrugerea simultană a legăturii carbon-halogen și formarea unei perechi C-OH. Acesta este un mecanism de substituție bimoleculară nucleofilă (SN2).
Mecanismul de înlocuire heterolitică
Mecanismul de substituție este asociat cu transferul de electroni și crearea de complexe intermediare. Cu cât reacția are loc mai repede, cu atât apar mai ușor produsele intermediare caracteristice. Adesea, procesul merge în mai multe direcții simultan. Avantajul se îndreaptă de obicei către calea care utilizează particule care necesită cea mai mică cantitate de energie pentru formarea lor. De exemplu, prezența unei duble legături crește probabilitatea apariției unui cation alilic CH2=CH—CH2+ în comparație cu ionul CH3+. Motivul constă în densitatea electronică a legăturii multiple, care afectează delocalizarea sarcinii pozitive dispersate în întreaga moleculă.
Reacții de substituție a benzenului
Grupul caracterizat prin substituție electrofilă este arenele. Inelul benzen este o țintă convenabilă pentru atacul electrofil. Procesul începe cu polarizarea legăturii în cel de-al doilea reactiv, rezultând în formarea unui electrofil adiacent norului de electroni al inelului benzenic. Ca urmare, apare un complex de tranziție. Nu există încă o legătură completă între particula electrofilă și unul dintre atomii de carbon; aceasta este atrasă de întreaga sarcină negativă a celor „șase” electroni aromatici. În a treia etapă a procesului, electrofilul și un atom de carbon al inelului sunt legați printr-o pereche comună de electroni (legatură covalentă). Dar în acest caz, „șase aromatice” sunt distruse, ceea ce este nefavorabil din punctul de vedere al obținerii unei stări energetice stabile, stabile. Se observă un fenomen care poate fi numit „ejecție de protoni”. Se elimină H+ și se restabilește un sistem stabil de comunicații caracteristic arenelor. Produsul secundar conține un cation de hidrogen din inelul benzenic și un anion din al doilea reactiv.

Exemple de reacții de substituție din chimia organică
Alcanii sunt caracterizați în special printr-o reacție de substituție. Exemple de transformări electrofile și nucleofile pot fi date pentru cicloalcani și arene. Reacții similare în moleculele de substanțe organice apar în condiții normale, dar mai des atunci când sunt încălzite și în prezența catalizatorilor. Procesele comune și bine studiate includ substituția electrofilă în inelul aromatic. Cele mai importante reacții de acest tip:
- Nitrarea benzenului în prezența H 2 SO 4 se desfășoară conform schemei: C 6 H 6 → C 6 H 5 -NO 2.
- Halogenarea catalitică a benzenului, în special clorurarea, conform ecuației: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl.
- Procesul aromatic se desfășoară cu acid sulfuric „afumant”, se formează acizi benzensulfonici.
- Alchilarea este înlocuirea unui atom de hidrogen din ciclul benzenic cu un alchil.
- Acilare - formarea de cetone.
- Formilarea este înlocuirea hidrogenului cu o grupare CHO și formarea de aldehide.
Reacțiile de substituție includ reacții în alcani și cicloalcani în care halogenii atacă o legătură C-H accesibilă. Formarea derivaților poate implica înlocuirea unuia, a doi sau a tuturor atomilor de hidrogen în hidrocarburi saturate și cicloparafine. Mulți dintre haloalcanii cu greutăți moleculare mici sunt utilizați în producerea de substanțe mai complexe aparținând unor clase diferite. Progresul realizat în studierea mecanismelor reacțiilor de substituție a dat un impuls puternic dezvoltării sintezelor pe bază de alcani, cicloparafine, arene și hidrocarburi halogenate.
CH 3 -CH 3 + Cl 2 – (hv) ---- CH 3 -CH 2 Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
Reacții de adaos
Astfel de reacții sunt tipice pentru compușii organici care conțin legături multiple (duble sau triple). Reacțiile de acest tip includ reacții de adăugare de halogeni, halogenuri de hidrogen și apă la alchene și alchine
CH3 -CH=CH2 + HCI ---- CH3 -CH(Cl)-CH3
Reacții de eliminare
Acestea sunt reacții care duc la formarea de legături multiple. La eliminarea halogenurilor de hidrogen și a apei se observă o anumită selectivitate a reacției, descrisă de regula lui Zaitsev, conform căreia un atom de hidrogen este eliminat din atomul de carbon la care există mai puțini atomi de hidrogen. Exemplu de reacție
CH3-CH(Cl)-CH2-CH3 + KOH →CH3-CH=CH-CH3 + HCI
Polimerizare și policondensare
n(CH 2 =CHCl) (-CH 2 -CHCl)n
Redox
Cea mai intensă dintre reacțiile oxidative este arderea, o reacție caracteristică tuturor claselor de compuși organici. În acest caz, în funcție de condițiile de ardere, carbonul este oxidat în C (funingine), CO sau CO 2, iar hidrogenul este transformat în apă. Cu toate acestea, pentru chimiștii organici, reacțiile de oxidare efectuate în condiții mult mai blânde decât arderea sunt de mare interes. Agenți oxidanți utilizați: soluții de Br2 în apă sau Cl2 în CCl 4 ; KMnO 4 în apă sau acid diluat; oxid de cupru; hidroxizi de argint(I) sau cupru(II) proaspăt precipitați.
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
Esterificare (și reacția sa de hidroliză inversă)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Cicloadiția
Y R Y-R
‖ + ‖ → ǀ ǀ
R Y R-Y
‖ + →
11. Clasificarea reacțiilor organice după mecanism. Exemple.
Mecanismul de reacție implică o descriere detaliată pas cu pas a reacțiilor chimice. În același timp, se stabilește ce legături covalente sunt rupte, în ce ordine și în ce fel. Formarea de noi legături în timpul procesului de reacție este de asemenea descrisă cu atenție. Când luați în considerare mecanismul de reacție, în primul rând, acordați atenție metodei de rupere a legăturii covalente din molecula care reacţionează. Există două astfel de moduri - homolitic și heterolitic.
Reacții radicale se procedează prin scindarea homolitică (radicală) a unei legături covalente:

Legăturile covalente nepolare sau cu polar scăzut (C–C, N–N, C–H) suferă clivaj radical la temperaturi ridicate sau sub influența luminii. Carbonul din radicalul CH 3 are 7 electroni exteriori (în loc de un înveliș octet stabil în CH 4). Radicalii sunt instabili; au tendința de a capta electronul lipsă (până la o pereche sau până la un octet). Una dintre modalitățile de a forma produse stabile este dimerizarea (combinația a doi radicali):
CH3 + CH3CH3 : CH 3,
N + N N : N.
Reacții radicale - acestea sunt, de exemplu, reacțiile de clorurare, bromurare și nitrare a alcanilor:

Reacții ionice apar cu clivajul legăturii heterolitice. În acest caz, se formează intermediar ionii organici de scurtă durată - carbocationi și carbanioni - cu sarcină pe atomul de carbon. În reacțiile ionice, perechea de electroni de legătură nu este separată, ci trece în întregime la unul dintre atomi, transformându-l într-un anion:

Legăturile puternic polare (H–O, C–O) și ușor polarizabile (C–Br, C–I) sunt predispuse la clivaj heterolitic.
Distinge reacții nucleofile (nucleofil– căutând nucleul, un loc cu lipsă de electroni) și reacții electrofile (electrofil– cautarea electronilor). Afirmația că o anumită reacție este nucleofilă sau electrofilă se referă întotdeauna la reactiv. Reactiv– o substanță care participă la reacție cu o structură mai simplă. Substratul– o substanță inițială cu o structură mai complexă. Grup ieșitor este un ion înlocuibil care a fost legat de carbon. Produs de reacție– substanță nouă care conține carbon (scrisă în partea dreaptă a ecuației reacției).
LA reactivi nucleofili(nucleofilii) includ ioni încărcați negativ, compuși cu perechi singure de electroni, compuși cu legături duble carbon-carbon. LA reactivi electrofili(electrofilii) includ ioni încărcați pozitiv, compuși cu învelișuri de electroni neumplute (AlCl 3, BF 3, FeCl 3), compuși cu grupări carbonil, halogeni. Electrofilii sunt orice atom, moleculă sau ion capabil să adauge o pereche de electroni în procesul de formare a unei noi legături. Forța motrice a reacțiilor ionice este interacțiunea ionilor încărcați opus sau a fragmentelor de molecule diferite cu o sarcină parțială (+ și –).
Exemple de diferite tipuri de reacții ionice.
Substituția nucleofilă :
Substituție electrofilă :
Adăugarea nucleofilă (CN – se adaugă mai întâi, apoi H +):

Conexiune electrofilă (Se adaugă mai întâi H +, apoi X –):

Eliminarea prin acțiunea nucleofililor (bazelor) :
Eliminare la acțiune electrofili (acizi) :
Reacțiile organice pot fi împărțite în două tipuri generale.
Reacții hemolitice. Aceste reacții au loc printr-un mecanism radical. Le vom analiza mai detaliat în capitolul următor. Cinetica și mecanismul reacțiilor de acest tip au fost discutate în Cap. 9.
Reacții heterolitice. Aceste reacții sunt în esență reacții ionice. Ele pot fi, la rândul lor, împărțite în reacții de substituție, adăugare și eliminare.
Reacții de substituție
În aceste reacții, un atom sau un grup de atomi este înlocuit cu un alt atom sau grup. Ca exemplu de reacții de acest tip, dăm hidroliza clormetanului cu formarea de metanol:
Ionul hidroxil este un nucleofil. Prin urmare, substituția în cauză se numește substituție nucleofilă. Este desemnat prin simbolul SN. Particula înlocuită (în acest caz, un ion de clor) se numește grup lasabil.
Dacă notăm nucleofilul cu simbolul și grupul părăsitor cu simbolul, atunci putem scrie ecuația generalizată pentru reacția de substituție nucleofilă la un atom de carbon saturat din gruparea alchil R după cum urmează:
Un studiu al vitezei de reacții de acest tip arată că reacțiile pot fi împărțite în
Reacții de tipul SN Pentru unele reacții de tip SN, ecuația cinetică a vitezei de reacție (vezi secțiunea 9.1) are forma
Astfel, aceste reacții sunt de ordinul întâi în substrat, dar de ordinul zero în reactant.Cinetica caracteristică unei reacții de ordinul întâi este o indicație sigură că etapa de limitare a vitezei a reacției este un proces unimolecular. Prin urmare, reacțiile de acest tip sunt indicate prin simbol.
Reacția are ordin zero față de reactiv, deoarece viteza sa nu depinde de concentrația reactivului. Prin urmare, putem scrie:
Deoarece nucleofilul nu participă la etapa de limitare a vitezei a reacției, mecanismul unei astfel de reacții trebuie să includă cel puțin două etape. Pentru astfel de reacții a fost propus următorul mecanism:

Prima etapă este ionizarea cu formarea unui carbocation.Această etapă este limitativă (lentă).
Un exemplu de acest tip de reacție este hidroliza alcalină a halogenurilor de alchil terțiar. De exemplu
În cazul în cauză, viteza de reacție este determinată de ecuație
Reacții de tipul Pentru unele reacții de substituție nucleofilă SN ecuația vitezei are forma
În acest caz, reacția este de ordinul întâi în nucleofil și de ordinul întâi în . În general, este o reacție de ordinul doi. Acesta este un motiv suficient pentru a crede că etapa de limitare a vitezei a acestei reacții este un proces bimolecular. Prin urmare, reacția tipului luat în considerare este notat cu simbolul Deoarece atât nucleofilul, cât și substratul participă simultan la etapa de limitare a vitezei a reacției, putem crede că această reacție se desfășoară într-o etapă printr-o stare de tranziție (vezi secțiunea 9.2):
Hidroliza halogenurilor de alchil primare într-un mediu alcalin are loc conform mecanismului

Această reacție are următoarea ecuație cinetică:
Până acum am considerat substituția nucleofilă doar la atomul de carbon saturat. Substituția nucleofilă este posibilă și la un atom de carbon nesaturat:

Reacțiile de acest tip se numesc substituție acil nucleofilă.
Substituție electrofilă. Reacțiile de substituție electrofilă pot apărea și pe inelele benzenice. În acest tip de substituție, inelul benzenic furnizează electrofilului doi dintre electronii săi delocalizați. În acest caz, se formează un compus intermediar - un complex instabil al unui electrofil și al unei grupări fugare. Pentru o reprezentare schematică a unor astfel de complexe, se utilizează un cerc deschis, indicând pierderea a doi electroni:

Un exemplu de reacții de substituție electrofilă este nitrarea benzenului:

Nitrarea benzenului se realizează într-o instalație cu un condensator de reflux la o temperatură de 55 până la 60 ° C folosind un amestec de nitrare. Acest amestec conține cantități egale de acizi azotic și sulfuric concentrați. Reacția dintre acești acizi duce la formarea unui cation nitroil
Reacții de adaos
În reacții de acest tip, la un atom de carbon nesaturat se adaugă un electrofil sau un nucleofil. Vom lua în considerare aici câte un exemplu de adiție electrofilă și adiție nucleofilă.
Un exemplu de adiție electrofilă este reacția dintre bromura de hidrogen și o alchenă. Pentru a obține bromură de hidrogen în laborator, se poate utiliza o reacție între acidul sulfuric concentrat și bromura de sodiu (vezi secțiunea 16.2). Moleculele de bromură de hidrogen sunt polare deoarece atomul de brom are un efect inductiv negativ asupra hidrogenului. Prin urmare, molecula de bromură de hidrogen are proprietățile unui acid puternic. Conform opiniilor moderne, reacția bromurii de hidrogen cu alchenele are loc în două etape. În prima etapă, un atom de hidrogen încărcat pozitiv atacă legătura dublă, care acționează ca o sursă de electroni. Ca rezultat, se formează un complex activat și un ion de bromură:

Ionul de bromură atacă apoi acest complex, ducând la formarea unei bromură de alchil:

Un exemplu de adiție nucleofilă este adăugarea de acid cianhidric la orice aldehidă sau cetonă. Mai întâi, aldehida sau cetona este tratată cu o soluție apoasă de cianură de sodiu, apoi se adaugă o cantitate în exces de orice acid mineral, ceea ce duce la formarea de acid cianhidric HCN. Ionul de cianura este un nucleofil. Atacă atomul de carbon încărcat pozitiv de pe gruparea carbonil a aldehidei sau cetonei. Sarcina pozitivă și polaritatea grupării carbonil se datorează efectului mezomer, care a fost descris mai sus. Reacția poate fi reprezentată prin următoarea diagramă:

Reacții de eliminare
Aceste reacții sunt inversul reacțiilor de adiție. Acestea duc la îndepărtarea oricăror atomi sau grupuri de atomi din doi atomi de carbon legați între ei printr-o legătură covalentă simplă, rezultând în formarea unei legături multiple între ei.
Un exemplu de astfel de reacție este eliminarea hidrogenului și halogenului din halogenurile de alchil:
Pentru a efectua această reacție, halogenura de alchil este tratată cu hidroxid de potasiu în alcool la o temperatură de 60 °C.
Trebuie remarcat faptul că tratamentul unei halogenuri de alchil cu hidroxid conduce, de asemenea, la substituție nucleofilă (vezi mai sus). Ca urmare, două reacții concurente de substituție și eliminare au loc simultan, ceea ce duce la formarea unui amestec de produse de substituție și eliminare. Care dintre aceste reacții va fi predominantă depinde de o serie de factori, inclusiv de mediul în care se desfășoară reacția. Substituția nucleofilă a halogenurilor de alchil se realizează în prezența apei. În schimb, reacțiile de eliminare se desfășoară în absența apei și la temperaturi mai ridicate.
Deci haideți să o spunem din nou!
1. În timpul clivajului hemolitic al unei legături, doi electroni împărtășiți sunt distribuiți uniform între atomi.
2. În timpul clivajului legăturii heterolitice, doi electroni împărtășiți sunt distribuiți inegal între atomi.
3. Un carbanion este un ion care conține un atom de carbon cu sarcină negativă.
4. Un carbocation este un ion care conține un atom de carbon cu sarcină pozitivă.
5. Efectele solvenților pot avea un impact semnificativ asupra proceselor chimice și asupra constantelor lor de echilibru.
6. Efectul mediului chimic al unei grupe funcționale din cadrul unei molecule asupra reactivității acelei grupe funcționale se numește efect structural.
7. Efectele electronice și efectele sterice sunt numite în mod colectiv efecte structurale.
8. Cele mai importante două efecte electronice sunt efectul inductiv și efectul mezomer (rezonant).
9. Efectul inductiv este deplasarea densității electronilor de la un atom la altul, ceea ce duce la polarizarea legăturii dintre cei doi atomi. Acest efect poate fi pozitiv sau negativ.
10. Particulele moleculare cu legături multiple pot exista sub formă de hibrizi rezonanți între două sau mai multe structuri rezonante.
11. Efectul mezomer (rezonanță) constă în stabilizarea hibrizilor rezonanți datorită delocalizării -electronilor.
12. O piedică sterică poate apărea atunci când grupările voluminoase dintr-o moleculă împiedică mecanic reacția.
13. Nucleofilul este o particulă care atacă un atom de carbon, furnizându-i perechea de electroni. Nucleofilul este o bază Lewis.
14. Un electrofil este o particulă care atacă un atom de carbon, acceptând perechea sa de electroni. Nucleofilul este un acid Lewis.
15. Reacțiile hemolitice sunt reacții radicale.
16. Reacțiile heterolitice sunt în principal reacții ionice.
17. Înlocuirea oricărei grupări dintr-o moleculă cu un reactiv nucleofil se numește substituție nucleofilă. Grupul care este înlocuit în acest caz se numește grup care părăsește.
18. Substituția electrofilă pe un inel benzenic implică donarea a doi electroni delocalizați unui electrofil.
19. În reacțiile de adiție electrofile, la un atom de carbon nesaturat se adaugă un electrofil.
20. Adăugarea de acid cianhidric la aldehide sau cetone este un exemplu de adiție nucleofilă.
21. În reacțiile de eliminare (eliminare), unii atomi sau grupuri de atomi sunt separați de doi atomi de carbon legați între ei printr-o legătură covalentă simplă. Ca rezultat, se formează o legătură multiplă între acești atomi de carbon.

Teoria substituției în compuși aromatici. Reacții de substituție electrofilă. Orientanți de al 2-lea fel (meta-orientanți).
Substituenții care au un efect inductiv negativ sau efecte negative atât inductive cât și mezorice direcționează substituția electrofilă către poziția meta a inelului benzenic și sunt numiți orientanți de al doilea fel.
Reacțiile organice, ca și cele anorganice, sunt împărțite în 3 tipuri principale:
1) reacţie de substituţie: CH4 + CI2 → CH3CI + HCI;
2) reacţia de eliminare: CH3CH2Br → CH2 = CH2 + HBr;
3) reacție de adiție: CH 2 = CH 2 + HBr → CH 3 CH 2 Br.( reacții de polimerizare)
Clasifica prin mecanismul ruperii legăturilor covalente în moleculele care reacţionează.
Două moduri de a rupe legăturile covalente.
1. Dacă o pereche de electroni comună este împărțită între atomi, formând radicali. Radicalii-particule cu electroni nepereche. Această deconectare se numește radical (homolitic).Particularitate Această legătură este că radicalii care se formează interacționează cu moleculele prezente în sistemul de reacție sau între ele.
Radicalii rezultați interacționează cu moleculele prezente în sistemul de reacție sau între ele: CH 3 + CI 2 → CH 3 CI + CI.
Conform mecanismului radicalilor, au loc reacții în care legăturile de polaritate scăzută (C-C, C-H, N-N) sunt rupte la temperaturi ridicate, sub influența luminii sau a radiațiilor radioactive.
2. Dacă, atunci când o legătură este ruptă, o pereche de electroni comună rămâne cu un atom, atunci ioni – cation și anion. Acest mecanism se numește ionic sau heterolitic. Aceasta duce la formarea de organice cationi sau anioni: 1) clorura de metil formează un cation metil și un anion clorură; 2) metil litiul formează cationi de litiu și anionul metil.
Ionii organici suferă transformări ulterioare. În acest caz, cationii interacționează cu nucleofil particule ("iubitoare de nucleu") și anioni organici - cu electrofilă particule ("iubitoare de electroni") (cationi metalici, halogeni etc.).
Mecanismul ionic se observă atunci când o legătură covalentă polară este ruptă (carbon – halogen, carbon – oxigen etc.).
Particulele ionice organice sunt similare cu ionii din chimia anorganică - au sarcini corespunzătoare. Cu toate acestea, ele sunt foarte diferite: ionii compușilor anorganici sunt prezenți în mod constant în soluții apoase, iar particulele ionice organice apar numai în momentul reacției.
Prin urmare, în multe cazuri este necesar să vorbim nu despre ioni organici liberi, ci despre molecule extrem de polarizate.
Mecanismul radicalilor se observă atunci când o legătură covalentă nepolară sau cu polar scăzut (carbon-carbon, carbon-hidrogen etc.) este ruptă.
Particulele ionice organice sunt similare cu ionii din chimia anorganică - au sarcini corespunzătoare.