Tipovi kemijskih reakcija u organskoj kemiji primjeri. Vrste kemijskih reakcija u organskoj kemiji plan lekcije iz kemije (10. razred) na temu. Podjela organskih reakcija prema mehanizmu. Primjeri
Mnoge supstitucijske reakcije otvaraju put proizvodnji niza spojeva koji imaju ekonomsku primjenu. Elektrofilna i nukleofilna supstitucija ima veliku ulogu u kemijskoj znanosti i industriji. U organskoj sintezi ti procesi imaju niz značajki na koje treba obratiti pozornost.
Raznolikost kemijskih pojava. Supstitucijske reakcije
Kemijske promjene povezane s pretvorbom tvari razlikuju se po nizu značajki. Konačni rezultati i toplinski učinci mogu varirati; Neki procesi idu do kraja, u drugima dolazi do promjene tvari, često praćene povećanjem ili smanjenjem stupnja oksidacije. Pri razvrstavanju kemijskih pojava prema njihovom konačnom rezultatu, pozornost se obraća na kvalitativne i kvantitativne razlike između reagensa i proizvoda. Na temelju ovih karakteristika može se razlikovati 7 tipova kemijskih transformacija, uključujući supstituciju, koja slijedi shemu: A-B + C A-C + B. Pojednostavljeni zapis cijele klase kemijskih pojava daje ideju da među polaznim tvarima postoji i takozvani "napad" čestica koja zamjenjuje atom, ion ili funkcionalnu skupinu u reagensu. Reakcija supstitucije karakteristična je za ograničavanje i
Reakcije supstitucije mogu se odvijati u obliku dvostruke izmjene: A-B + C-E A-C + B-E. Jedna od podvrsta je istiskivanje, na primjer, bakra sa željezom iz otopine bakrenog sulfata: CuSO 4 + Fe = FeSO 4 + Cu. "Napadajuća" čestica može biti atom, ioni ili funkcionalne skupine

Homolitička supstitucija (radikal, SR)
S radikalnim mehanizmom kidanja kovalentnih veza, elektronski par zajednički različitim elementima proporcionalno je raspoređen između "fragmenata" molekule. Nastaju slobodni radikali. To su nestabilne čestice, čija stabilizacija nastaje kao rezultat naknadnih transformacija. Na primjer, pri proizvodnji etana iz metana pojavljuju se slobodni radikali koji sudjeluju u reakciji supstitucije: CH 4 CH 3. + .N; CH 3. + .CH3 → C2H5; N. + .N → N2. Homolitičko cijepanje veze prema gornjem supstitucijskom mehanizmu je lančane prirode. U metanu se atomi H mogu sukcesivno zamijeniti klorom. Reakcija s bromom odvija se na sličan način, ali jod ne može izravno zamijeniti vodik u alkanima; fluor s njima reagira previše snažno.

Metoda heterolitičke veze
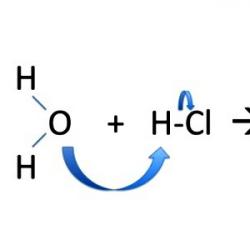
Kod ionskog mehanizma reakcija supstitucije elektroni su neravnomjerno raspoređeni između novonastalih čestica. Vezni par elektrona ide u cijelosti na jedan od “fragmenata”, najčešće na veznog partnera prema kojem je pomaknuta negativna gustoća u polarnoj molekuli. Reakcije supstitucije uključuju stvaranje metilnog alkohola CH 3 OH. U bromometanu CH3Br, cijepanje molekule je heterolitičko, a nabijene čestice su stabilne. Metil dobiva pozitivan, a brom negativan naboj: CH 3 Br → CH 3 + + Br - ; NaOH → Na + + OH - ; CH 3 + + OH - → CH 3 OH; Na + + Br - ↔ NaBr.

Elektrofili i nukleofili
Čestice kojima nedostaju elektroni, a mogu ih prihvatiti, nazivaju se "elektrofili". To uključuje atome ugljika povezane s halogenima u haloalkanima. Nukleofili imaju povećanu gustoću elektrona, oni "doniraju" par elektrona pri stvaranju kovalentne veze. U reakcijama supstitucije, nukleofile bogate negativnim nabojima napadaju elektrofili izgladnjeli. Ovaj fenomen je povezan s kretanjem atoma ili druge čestice – odlazeće skupine. Druga vrsta reakcije supstitucije je napad elektrofila nukleofilom. Ponekad je teško razlikovati dva procesa i pripisati supstituciju jednoj ili drugoj vrsti, jer je teško točno odrediti koja je od molekula supstrat, a koja reagens. Obično se u takvim slučajevima uzimaju u obzir sljedeći čimbenici:
- priroda grupe koja odlazi;
- reaktivnost nukleofila;
- priroda otapala;
- struktura alkilnog dijela.
Nukleofilna supstitucija (SN)
Tijekom procesa interakcije u organskoj molekuli uočava se povećanje polarizacije. U jednadžbama se djelomični pozitivni ili negativni naboj označava slovom grčke abecede. Polarizacija veze omogućuje procjenu prirode njezinog pucanja i daljnjeg ponašanja "fragmenata" molekule. Na primjer, ugljikov atom u jodometanu ima djelomično pozitivan naboj i elektrofilno je središte. Privlači onaj dio vodenog dipola gdje se nalazi kisik koji ima višak elektrona. Kada elektrofil stupa u interakciju s nukleofilnim reagensom, nastaje metanol: CH 3 I + H 2 O → CH 3 OH + HI. Reakcije nukleofilne supstitucije odvijaju se uz sudjelovanje negativno nabijenog iona ili molekule sa slobodnim elektronskim parom koji ne sudjeluje u stvaranju kemijske veze. Aktivno sudjelovanje jodometana u SN 2 reakcijama objašnjava se njegovom sklonošću nukleofilnom napadu i pokretljivošću joda.

Elektrofilna supstitucija (SE)
Organska molekula može sadržavati nukleofilni centar, koji je karakteriziran viškom elektronske gustoće. Reagira s elektrofilnim reagensom bez negativnih naboja. Takve čestice uključuju atome sa slobodnim orbitalama i molekule s područjima niske gustoće elektrona. B ugljik, koji ima "-" naboj, djeluje s pozitivnim dijelom vodenog dipola - s vodikom: CH 3 Na + H 2 O → CH 4 + NaOH. Produkt ove reakcije elektrofilne supstitucije je metan. U heterolitičkim reakcijama međusobno djeluju suprotno nabijeni centri organskih molekula, što ih čini sličnim ionima u kemiji anorganskih tvari. Ne treba zanemariti da je transformacija organskih spojeva rijetko popraćena stvaranjem pravih kationa i aniona.

Monomolekularne i bimolekularne reakcije
Nukleofilna supstitucija je monomolekularna (SN1). Taj se mehanizam koristi za hidrolizu važnog produkta organske sinteze — tercijarnog butil klorida. Prva faza je spora, povezana je s postupnom disocijacijom na karbonijev kation i kloridni anion. Druga faza se odvija brže, dolazi do reakcije karbonijevog iona s vodom. zamjena halogena u alkanu s hidroksi skupinom i dobivanje primarnog alkohola: (CH 3) 3 C—Cl → (CH 3) 3 C + + Cl - ; (CH 3) 3 C + + H 2 O → (CH 3) 3 C—OH + H + . Jednostupanjska hidroliza primarnih i sekundarnih alkilhalogenida karakterizirana je istodobnim razaranjem veze ugljik-halogen i stvaranjem para C-OH. Ovo je mehanizam nukleofilne bimolekularne supstitucije (SN2).
Mehanizam heterolitičke zamjene
Mehanizam supstitucije povezan je s prijenosom elektrona i stvaranjem međukompleksa. Što se reakcija brže odvija, to lakše nastaju njezini karakteristični međuprodukti. Često proces ide u nekoliko smjerova istovremeno. Prednost obično ima put koji koristi čestice koje za svoj nastanak zahtijevaju najmanju količinu energije. Na primjer, prisutnost dvostruke veze povećava vjerojatnost pojave alilnog kationa CH2=CH—CH 2 + u usporedbi s ionom CH 3 +. Razlog leži u gustoći elektrona višestruke veze, koja utječe na delokalizaciju pozitivnog naboja raspršenog po molekuli.
Reakcije supstitucije benzenom
Skupina koju karakterizira elektrofilna supstitucija su areni. Benzenski prsten pogodna je meta za elektrofilni napad. Proces počinje polarizacijom veze u drugom reagensu, što rezultira stvaranjem elektrofila uz elektronski oblak benzenskog prstena. Kao rezultat toga, pojavljuje se prijelazni kompleks. Još ne postoji potpuna veza između elektrofilne čestice i jednog od atoma ugljika, privlači je cjelokupni negativni naboj elektrona "aromatskih šest". U trećoj fazi procesa, elektrofil i jedan atom ugljika u prstenu povezani su zajedničkim parom elektrona (kovalentna veza). Ali u ovom slučaju, "aromatična šestica" je uništena, što je nepovoljno s gledišta postizanja stabilnog, stabilnog energetskog stanja. Opaža se fenomen koji se može nazvati "izbacivanje protona". H+ je eliminiran i uspostavljen je stabilan komunikacijski sustav karakterističan za arene. Nusprodukt sadrži vodikov kation iz benzenskog prstena i anion iz drugog reagensa.

Primjeri supstitucijskih reakcija iz organske kemije
Za alkane je posebno karakteristična reakcija supstitucije. Primjeri elektrofilnih i nukleofilnih transformacija mogu se dati za cikloalkane i arene. Slične reakcije u molekulama organskih tvari odvijaju se u normalnim uvjetima, ali češće pri zagrijavanju i u prisutnosti katalizatora. Uobičajeni i dobro proučeni procesi uključuju elektrofilnu supstituciju u aromatskom prstenu. Najvažnije reakcije ovog tipa:
- Nitriranje benzena u prisutnosti H 2 SO 4 odvija se prema shemi: C 6 H 6 → C 6 H 5 -NO 2.
- Katalitičko halogeniranje benzena, posebno kloriranje, prema jednadžbi: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl.
- Aromatski proces se odvija uz "dimljenje" sumporne kiseline, nastaju benzensulfonske kiseline.
- Alkilacija je zamjena atoma vodika iz benzenskog prstena alkilom.
- Acilacija-stvaranje ketona.
- Formilacija je zamjena vodika s CHO skupinom i stvaranje aldehida.
Reakcije supstitucije uključuju reakcije u alkanima i cikloalkanima u kojima halogeni napadaju dostupnu C-H vezu. Stvaranje derivata može uključivati zamjenu jednog, dva ili svih atoma vodika u zasićenim ugljikovodicima i cikloparafinima. Mnogi od haloalkana s malim molekulskim težinama koriste se u proizvodnji složenijih tvari koje pripadaju različitim klasama. Napredak postignut u proučavanju mehanizama supstitucijskih reakcija dao je snažan poticaj razvoju sinteza na bazi alkana, cikloparafina, arena i halogeniranih ugljikovodika.
CH 3 -CH 3 + Cl 2 – (hv) ---- CH 3 -CH 2 Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
Reakcije adicije
Takve reakcije tipične su za organske spojeve koji sadrže višestruke (dvostruke ili trostruke) veze. Reakcije ovog tipa uključuju reakcije adicije halogena, halogenovodika i vode na alkene i alkine
CH 3 -CH=CH 2 + HCl ---- CH 3 -CH(Cl)-CH 3
Reakcije eliminacije
To su reakcije koje dovode do stvaranja višestrukih veza. Pri eliminaciji halogenovodika i vode uočava se određena selektivnost reakcije, opisana Zaitsevljevim pravilom, prema kojem se atom vodika eliminira s atoma ugljika na kojem ima manje atoma vodika. Primjer reakcije
CH3-CH(Cl)-CH 2 -CH 3 + KOH →CH 3 -CH=CH-CH 3 + HCl
Polimerizacija i polikondenzacija
n(CH 2 =CHCl) (-CH 2 -CHCl)n
Redox
Najintenzivnija od oksidativnih reakcija je izgaranje, reakcija karakteristična za sve klase organskih spojeva. U ovom slučaju, ovisno o uvjetima izgaranja, ugljik se oksidira u C (čađ), CO ili CO 2, a vodik se pretvara u vodu. Međutim, za organske kemičare, reakcije oksidacije koje se provode pod mnogo blažim uvjetima od izgaranja su od velikog interesa. Korištena oksidacijska sredstva: otopine Br2 u vodi ili Cl2 u CCl4; KMnO 4 u vodi ili razrijeđenoj kiselini; bakreni oksid; svježe istaloženi hidroksidi srebra(I) ili bakra(II).
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
Esterifikacija (i njena reverzna reakcija hidrolize)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Cikloadicija
Y R Y-R
‖ + ‖ → ǀ ǀ
R Y R-Y
‖ + →
11. Podjela organskih reakcija prema mehanizmu. Primjeri.
Mehanizam reakcije uključuje detaljan opis kemijskih reakcija korak po korak. Pritom se utvrđuje koje se kovalentne veze kidaju, kojim redom i na koji način. Stvaranje novih veza tijekom reakcijskog procesa također je pažljivo opisano. Pri razmatranju mehanizma reakcije, prije svega, obratite pozornost na metodu prekida kovalentne veze u reagirajućoj molekuli. Postoje dva takva načina - homolitički i heterolitički.
Radikalne reakcije odvija se homolitičkim (radikalnim) cijepanjem kovalentne veze:

Nepolarne ili niskopolarne kovalentne veze (C–C, N–N, C–H) podvrgavaju se radikalnom cijepanju pri visokim temperaturama ili pod utjecajem svjetlosti. Ugljik u radikalu CH 3 ima 7 vanjskih elektrona (umjesto stabilne oktetne ljuske u CH 4). Radikali su nestabilni, teže uhvatiti elektron koji nedostaje (do para ili do okteta). Jedan od načina stvaranja stabilnih proizvoda je dimerizacija (kombinacija dvaju radikala):
CH 3 + CH 3 CH 3 : CH 3,
N + N N : N.
Radikalne reakcije - to su npr. reakcije kloriranja, bromiranja i nitriranja alkana:

Ionske reakcije nastaju heterolitičkim cijepanjem veze. U tom slučaju posredno nastaju kratkoživući organski ioni - karbokationi i karbanioni - s nabojem na ugljikovom atomu. U ionskim reakcijama, vezni elektronski par nije odvojen, već u potpunosti prelazi na jedan od atoma, pretvarajući ga u anion:

Jako polarne (H–O, C–O) i lako polarizirajuće (C–Br, C–I) veze sklone su heterolitičkom cijepanju.
razlikovati nukleofilne reakcije (nukleofil– traženje jezgre, mjesta s nedostatkom elektrona) i elektrofilne reakcije (elektrofil– traženje elektrona). Izjava da je određena reakcija nukleofilna ili elektrofilna uvijek se odnosi na reagens. Reagens– tvar koja sudjeluje u reakciji s jednostavnijom strukturom. Podloga– polazna tvar složenije strukture. Odlazna grupa je zamjenjivi ion koji je vezan za ugljik. Produkt reakcije– nova tvar koja sadrži ugljik (napisana na desnoj strani jednadžbe reakcije).
DO nukleofilni reagensi(nukleofili) uključuju negativno nabijene ione, spojeve s usamljenim parovima elektrona, spojeve s dvostrukim ugljik-ugljik vezama. DO elektrofilni reagensi(elektrofili) uključuju pozitivno nabijene ione, spojeve s nepopunjenim elektronskim ljuskama (AlCl 3, BF 3, FeCl 3), spojeve s karbonilnim skupinama, halogene. Elektrofili su svaki atom, molekula ili ion koji može dodati par elektrona u procesu stvaranja nove veze. Pokretačka snaga ionskih reakcija je međudjelovanje suprotno nabijenih iona ili fragmenata različitih molekula s djelomičnim nabojem (+ i –).
Primjeri različitih tipova ionskih reakcija.
Nukleofilna supstitucija :
Elektrofilna supstitucija :
Nukleofilna adicija (Prvo se dodaje CN –, a zatim H +):

Elektrofilna veza (Prvo se dodaje H +, a zatim X –):

Eliminacija djelovanjem nukleofila (baza) :
Eliminacija nakon akcije elektrofili (kiseline) :
Organske reakcije mogu se podijeliti u dvije općenite vrste.
Hemolitičke reakcije. Ove reakcije odvijaju se radikalnim mehanizmom. Pogledat ćemo ih detaljnije u sljedećem poglavlju. Kinetika i mehanizam reakcija ovog tipa razmatrani su u Pogl. 9.
Heterolitičke reakcije. Ove reakcije su u biti ionske reakcije. One se pak mogu podijeliti na reakcije supstitucije, adicije i eliminacije.
Supstitucijske reakcije
U tim reakcijama atom ili skupina atoma zamijenjena je drugim atomom ili skupinom. Kao primjer reakcija ovog tipa navodimo hidrolizu klorometana uz nastajanje metanola:
Hidroksilni ion je nukleofil. Stoga se supstitucija o kojoj je riječ naziva nukleofilna supstitucija. Označava se simbolom SN. Zamijenjena čestica (u ovom slučaju, ion klora) naziva se izlazna skupina.
Ako nukleofil označimo simbolom, a odlazeću skupinu simbolom, tada generaliziranu jednadžbu za reakciju nukleofilne supstitucije na zasićenom ugljikovom atomu u alkilnoj skupini R možemo napisati na sljedeći način:
Proučavanje brzine reakcija ove vrste pokazuje da se reakcije mogu podijeliti na
Reakcije tipa Za neke reakcije tipa SN, kinetička jednadžba za brzinu reakcije (vidi odjeljak 9.1) ima oblik
Prema tome, ove reakcije su prvog reda u supstratu, ali nultog reda u reaktantu. Kinetička karakteristika reakcije prvog reda pouzdana je indikacija da je korak koji ograničava brzinu reakcije unimolekulski proces. Stoga su reakcije ove vrste označene simbolom.
Reakcija ima nulti red s obzirom na reagens jer njezina brzina ne ovisi o koncentraciji reagensa, pa možemo napisati:
Budući da nukleofil ne sudjeluje u koraku koji ograničava brzinu reakcije, mehanizam takve reakcije mora uključivati najmanje dva koraka. Za takve reakcije predložen je sljedeći mehanizam:

Prva faza je ionizacija uz nastanak karbokationa.Ova faza je limitirajuća (spora).
Primjer ove vrste reakcije je alkalna hidroliza tercijarnih alkil halida. Na primjer
U slučaju koji se razmatra, brzina reakcije određena je jednadžbom
Reakcije tipa Za neke reakcije nukleofilne supstitucije SN jednadžba brzine ima oblik
U ovom slučaju, reakcija je prvog reda u nukleofilu i prvog reda u . Općenito, to je reakcija drugog reda. Ovo je dovoljan razlog za vjerovanje da je stupanj koji ograničava brzinu ove reakcije bimolekularni proces. Stoga je reakcija vrste koja se razmatra označena simbolom Budući da i nukleofil i supstrat istovremeno sudjeluju u fazi ograničenja brzine reakcije, možemo misliti da se ova reakcija odvija u jednoj fazi kroz prijelazno stanje (vidi odjeljak 9.2):
Hidroliza primarnih alkilhalogenida u alkalnom mediju odvija se prema mehanizmu

Ova reakcija ima sljedeću kinetičku jednadžbu:
Do sada smo razmatrali nukleofilnu supstituciju samo na zasićenom ugljikovom atomu. Nukleofilna supstitucija također je moguća na nezasićenom ugljikovom atomu:

Reakcije ovog tipa nazivaju se nukleofilna acilna supstitucija.
Elektrofilna supstitucija. Reakcije elektrofilne supstitucije također se mogu dogoditi na benzenskim prstenovima. U ovoj vrsti supstitucije, benzenski prsten opskrbljuje elektrofil s dva svoja delokalizirana -elektrona. U tom slučaju nastaje intermedijarni spoj - nestabilan kompleks elektrofila i izlazne skupine. Za shematski prikaz takvih kompleksa koristi se otvoreni krug koji označava gubitak dva -elektrona:

Primjer reakcija elektrofilne supstitucije je nitriranje benzena:

Nitriranje benzena provodi se u postrojenju s povratnim kondenzatorom na temperaturi od 55 do 60 ° C pomoću smjese za nitriranje. Ova smjesa sadrži jednake količine koncentrirane dušične i sumporne kiseline. Reakcija između ovih kiselina dovodi do stvaranja nitroil kationa
Reakcije adicije
U reakcijama ovog tipa, elektrofil ili nukleofil se dodaje nezasićenom ugljikovom atomu. Ovdje ćemo razmotriti po jedan primjer elektrofilne adicije i nukleofilne adicije.
Primjer elektrofilne adicije je reakcija između bromovodika i alkena. Za dobivanje bromovodika u laboratoriju može se koristiti reakcija između koncentrirane sumporne kiseline i natrijevog bromida (vidi odjeljak 16.2). Molekule bromovodika su polarne jer atom broma ima negativan induktivni učinak na vodik. Stoga molekula bromovodika ima svojstva jake kiseline. Prema suvremenim pogledima, reakcija bromovodika s alkenima odvija se u dvije faze. U prvoj fazi, pozitivno nabijeni atom vodika napada dvostruku vezu, koja djeluje kao izvor elektrona. Kao rezultat, formiraju se aktivirani kompleks i bromidni ion:

Bromidni ion tada napada ovaj kompleks, što rezultira stvaranjem alkil bromida:

Primjer nukleofilne adicije je adicija vodikovog cijanida na bilo koji aldehid ili keton. Najprije se aldehid ili keton obradi vodenom otopinom natrijeva cijanida, zatim se doda višak bilo koje mineralne kiseline, što dovodi do stvaranja cijanovodika HCN. Cijanidni ion je nukleofil. Napada pozitivno nabijeni atom ugljika na karbonilnoj skupini aldehida ili ketona. Pozitivni naboj i polaritet karbonilne skupine posljedica je mezomernog učinka, koji je gore opisan. Reakcija se može prikazati sljedećim dijagramom:

Reakcije eliminacije
Ove reakcije su obrnute od reakcija adicije. Oni dovode do uklanjanja bilo kojeg atoma ili skupine atoma iz dva atoma ugljika koji su međusobno povezani jednostavnom kovalentnom vezom, što rezultira stvaranjem višestruke veze između njih.
Primjer takve reakcije je eliminacija vodika i halogena iz alkilnih halogenida:
Za izvođenje ove reakcije, alkil halid se tretira s kalijevim hidroksidom u alkoholu na temperaturi od 60 °C.
Treba napomenuti da obrada alkil halida s hidroksidom također dovodi do nukleofilne supstitucije (vidi gore). Kao rezultat toga, istodobno se odvijaju dvije konkurentne reakcije supstitucije i eliminacije, što dovodi do stvaranja mješavine produkata supstitucije i eliminacije. Koja će od ovih reakcija biti dominantna ovisi o nizu čimbenika, uključujući okolinu u kojoj se reakcija odvija. Nukleofilna supstitucija alkil halida provodi se u prisutnosti vode. Nasuprot tome, reakcije eliminacije se provode u odsutnosti vode i na višim temperaturama.
Pa ponovimo!
1. Tijekom hemolitičkog cijepanja veze, dva zajednička elektrona ravnomjerno se raspoređuju između atoma.
2. Tijekom heterolitičkog cijepanja veze, dva zajednička elektrona su neravnomjerno raspoređena između atoma.
3. Karbanion je ion koji sadrži ugljikov atom s negativnim nabojem.
4. Karbokation je ion koji sadrži ugljikov atom s pozitivnim nabojem.
5. Učinci otapala mogu imati značajan utjecaj na kemijske procese i njihove konstante ravnoteže.
6. Učinak kemijskog okruženja funkcionalne skupine unutar molekule na reaktivnost te funkcionalne skupine naziva se strukturni učinak.
7. Elektronski efekti i sterički efekti zajednički se nazivaju strukturni efekti.
8. Dva najvažnija elektronska efekta su induktivni efekt i mezomerni (rezonantni) efekt.
9. Induktivni učinak je pomak gustoće elektrona s jednog atoma na drugi, što dovodi do polarizacije veze između dva atoma. Taj učinak može biti pozitivan ili negativan.
10. Molekularne čestice s višestrukim vezama mogu postojati u obliku rezonantnih hibrida između dvije ili više rezonantnih struktura.
11. Mezomerni (rezonantni) efekt sastoji se u stabilizaciji rezonantnih hibrida zbog delokalizacije -elektrona.
12. Sterička smetnja može se pojaviti kada glomazne skupine u molekuli mehanički ometaju reakciju.
13. Nukleofil je čestica koja napada ugljikov atom, opskrbljujući ga svojim elektronskim parom. Nukleofil je Lewisova baza.
14. Elektrofil je čestica koja napada ugljikov atom, prihvaćajući njegov elektronski par. Nukleofil je Lewisova kiselina.
15. Hemolitičke reakcije su radikalne reakcije.
16. Heterolitičke reakcije su uglavnom ionske reakcije.
17. Zamjena bilo koje skupine u molekuli nukleofilnim reagensom naziva se nukleofilna supstitucija. Grupa koja se u ovom slučaju zamjenjuje naziva se odlazeća grupa.
18. Elektrofilna supstitucija na benzenskom prstenu uključuje donaciju dva delokalizirana elektrona nekom elektrofilu.
19. U reakcijama elektrofilne adicije, elektrofil se dodaje nezasićenom ugljikovom atomu.
20. Adicija cijanovodika na aldehide ili ketone je primjer nukleofilne adicije.
21. U reakcijama eliminacije (eliminacije) neki se atomi ili skupine atoma odvajaju od dva atoma ugljika koji su međusobno povezani jednostavnom kovalentnom vezom. Kao rezultat, između tih ugljikovih atoma nastaje višestruka veza.

Teorija supstitucije u aromatskim spojevima. Reakcije elektrofilne supstitucije. Orijentanti 2. vrste (metaorijentanti).
Supstituenti koji imaju negativan induktivni učinak ili negativan i induktivni i mezomerni učinak usmjeravaju elektrofilnu supstituciju na meta položaj benzenskog prstena i nazivaju se orijentanti druge vrste.
Organske reakcije, poput anorganskih, dijele se u 3 glavne vrste:
1) reakcija supstitucije: CH 4 + CI 2 → CH 3 CI + HCI;
2) reakcija eliminacije: CH 3 CH 2 Br → CH 2 = CH 2 + HBr;
3) reakcija adicije: CH 2 = CH 2 + HBr → CH 3 CH 2 Br.( reakcije polimerizacije)
Klasificirati mehanizmom kidanja kovalentnih veza u reagirajućim molekulama.
Dva načina prekidanja kovalentnih veza.
1. Ako se zajednički elektronski par dijeli između atoma, tvoreći radikale. Radikali-čestice s nesparenim elektronima. Ovaj prekid veze se zove radikal (homolitički).Posebnost Ova veza je da radikali koji se formiraju djeluju u interakciji s molekulama prisutnim u reakcijskom sustavu ili međusobno.
Nastali radikali stupaju u interakciju s molekulama prisutnim u reakcijskom sustavu ili međusobno: CH 3 + CI 2 → CH 3 CI + CI.
Prema radikalskom mehanizmu nastaju reakcije u kojima se veze niske polarnosti (C-C, C-H, N-N) prekidaju na visokim temperaturama, pod utjecajem svjetlosti ili radioaktivnog zračenja.
2. Ako pri prekidu veze s jednim atomom ostane zajednički elektronski par, tada ioni – kation i anion. Ovaj mehanizam se zove ionski ili heterolitički. Dovodi do stvaranja organskih kationi ili anioni: 1) metil klorid tvori metil kation i klorid anion; 2) metil litij tvori litijev kation i metil anion.
Organski ioni prolaze dalje transformacije. U ovom slučaju kationi stupaju u interakciju s nukleofilni(“jezgre koje vole”) čestice, i organski anioni – sa elektrofilni(„ljubive elektrone”) čestice (metalni kationi, halogeni itd.).
Ionski mehanizam uočava se kada se prekine polarna kovalentna veza (ugljik - halogen, ugljik - kisik itd.).
Organske ionske čestice slične su ionima u anorganskoj kemiji – imaju odgovarajuće naboje. Međutim, oni su oštro različiti: ioni anorganskih spojeva stalno su prisutni u vodenim otopinama, a organske ionske čestice pojavljuju se samo u trenutku reakcije.
Stoga je u mnogim slučajevima potrebno govoriti ne o slobodnim organskim ionima, već o visoko polariziranim molekulama.
Radikalski mehanizam uočava se kada se prekine nepolarna ili niskopolarna kovalentna veza (ugljik-ugljik, ugljik-vodik itd.).
Organske ionske čestice slične su ionima u anorganskoj kemiji – imaju odgovarajuće naboje.