Энергия гиббса таблица стандартных значений. Стандартные энтальпии образования веществ, стандартные энтропии и стандартные энергии гиббса образования веществ
Стандартной молярной энтальпией образования вещества ΔH о6р, m (298 К) называется изменение энтальпии при образовании одного моля данного вещества из входящих в него элементов в их стандартных состояниях при температуре 298 К и давлении одна атмосфера.
Сопоставим это определение с приведенными выше примерами. Мы убедились,
что окисление водорода можно представить по меньшей мере тремя различными стехиометрическими уравнениями. Таким образом, нам известны по меньшей мере три разные стандартные молярные энтальпии:
а) ΔН°т {298 К, 2Н20(ж.)} = - 571,6 кДж/моль
б) ΔН°т {298 К, Н20(ж.)} = - 285,8 кДж/моль
в) ΔН°т{298 К, H2O(T.)} = - 241,8 кДж/моль
Какое же из этих значений соответствует стандартной молярной энтальпии образования воды? Значение (в) не может соответствовать ему, поскольку стандартным состоянием воды при 298 К не является парообразное (газообразное) состояние, соответствующее обозначению Н20(г.). Стандартная молярная энтальпия образования воды может иметь одно из двух оставшихся значений, различие между которыми определяется тем, как записано уравнение реакции. Однако, поскольку в приведенном выше определении стандартной молярной энтальпии образования указано, что оно соответствует изменению энтальпии в расчете на один моль образующегося вещества, следует выбрать вариант (б). Таким образом, стандартная молярная энтальпия образования воды = - 285,8 кДж/моль.
В табл. 5.1 указаны стандартные молярные энтальпии образования некоторых распространенных веществ в их стандартных состояниях. Обратим внимание, что в таблицу включены не только вещества, но и некоторые ионы. Ионы и многие соединения не могут быть получены прямым синтезом из образующих их элементов. Однако их стандартные энтальпии образования можно вычислить с помощью закона Гесса (с которым мы познакомимся в разд. 5.3).
Большинство соединений характеризуются отрицательными энтальпиями образования. Поэтому их называют экзотермическими соединениями. Лишь немногие соединения имеют положительную энтальпию образования. Они называются эндотермическими соединениями. Примером эндотермического соединения является бензол.
Следует обратить внимание на то обстоятельство, что энтальпии образования твердых соединений, как правило, имеют большие (по абсолютной величине) отрицательные значения, чем энтальпии образования газов. Стандартная молярная энтальпия образования какого-либо вещества или иона является мерой его устойчивости по сравнению с элементами, образующими данное соединение. Чем больше (по абсолютной величине) отрицательное значение энтальпии образования соединения, тем устойчивее это соединение.
По определению стандартная молярная энтальпия образования любого элемента в его стандартном состоянии при 298 К равна нулю. Например, ΔH {298 К, 02(г.)} = 0.
Таблица 5.1. Стандартные молярные энтальпии образования
Вещество |
ΔН(298 К), кДж/моль |
Вещество |
Д298 К), кДж/моль |
Групповые составляющие для расчета идеально-газовых свойств по Бенсону
Циклоалканы
Ацетиленовые углеводороды
Ароматические углеводороды
Энтальпия образования
Прогнозирование энтальпии образования
Прогнозирование органических соединений методом Бенсона по атомам с их первым окружением
Некоторые многовалентные группы метода Бенсона для идеально-газового состояния
ВВЕДЕНИЕ
Наилучшее решение вопросов разработки процессов химической технологии и аппаратуры для их проведения возможно лишь при наличии надежной информации по физико-химическим и термодинамическим свойствам химических соединений. Подобная информация часто составляет от 50 до 90% исходных данных при проектировании.
Для практики предпочтительными являются экспериментальные данные. На протяжении многих лет собрано и обработано огромное количество таких данных. Эти сведения имеются в многочисленных компиляциях и справочниках. В некоторых из них приводятся все известные в настоящее время значения термодинамических и физико-химических характеристик и дается их критический анализ. В других содержатся только рекомендованные авторами величины, часто являющиеся либо средними значениями, либо результатом статистической обработки всего массива накопленных сведений. Однако быстрый прогресс технологии и вовлечение в сферу деятельности все большего количества новых веществ и материалов обусловливают значительный разрыв между потребностью в данных и их наличием. Определение же экспериментальных величин в широких параметрах состояния и составов часто бывает затруднительным, а иногда и просто невозможным.
По этой причине инженер зачастую вынужден полагаться на разнообразные методы расчета и прогнозирования свойств веществ. Следует иметь в виду, что термины “расчет” и “прогноз” час то используются как синонимы, хотя второй из них несет в себе честное признание того факта, что результат может быть правильным только отчасти. Расчеты же могут основываться на теории, на корреляции экспериментальных значений или на комбинации того и другого.
Энтальпия образования
Энтальпия образования (enthalpy of formation ) является основным свойством, используемым при решении многих теоретических и практических задач. Знание энтальпий образования реагентов позволяет вычислить тепловые эффекты интересующих реакций, что необходимо при оценке адиабатического перепада температур в зоне реакции, формировании требований к конструкции реактора и технологическим особенностям химического процесса. Энтальпии образования веществ необходимы при выполнении количественного термодинамического анализа процессов, определении теоретической степени конверсии реагентов, выборе условий проведения химического превращения и т.п. Качество выполненного термодинамического анализа во многом зависит от надежности сведений по энтальпиям образования веществ.
Единицами измерения энтальпии являются кДж/моль и Дж/моль. В справочной литературе прежних лет энтальпии образования часто представлены в ккал/моль (1 кал = 4,184 Дж, 1 ккал = 4,184 кДж).
Энтальпия образования () соединения в узком смысле есть стандартное изменение энтальпии в реакции образования данного вещества из элементов или простых веществ. Простыми веществами являются химические элементы, находящиеся при рассматриваемой температуре в их естественном фазовом и химическом состояниях.
В качестве стандартного состояния вещества выбирается такое его состояние, при котором это вещество устойчиво при стандартном давлении, равном 1 атм (101325 Па). Конденсированное состояние вещества является стандартным вплоть до тех температур, при которых давление его насыщенного пара достигает 1 атм. Выше этих температур в качестве стандартного выбирается состояние идеального газа.
Для простых веществ, участвующих в формировании молекул большинства органических соединений, стандартным состоянием при 298,15 К является:
для углерода - графит;
для водорода, кислорода, азота, фтора и хлора - идеальный двухатомный газ;
для брома - двухатомная жидкость;
для иода и серы - кристаллическое состояние, двухатомное и одноатомное соответственно.
Абсолютные значения энтальпий не могут быть определены, поскольку они включают абсолютные значения внутренней энергии. Необходимость определения энтальпий образования соединений потребовала достижения международного соглашения, по которому были приняты равными нулю значения элементов и простых веществ, находящихся в стандартном состоянии.
Величина и знак веществ со сложным строением молекул могут быть различными. Объясняется это следующим. Образование вещества из свободных атомов всегда сопровождается выделением энергии, полученных при этом веществ отрицательна. Однако при образовании вещества из простых веществ, состоящих из двухатомных молекул (H 2 , О 2 , N 2 , Cl 2 и пр.) или находящихся в конденсированном состоянии (углерод, бром и т.п.), некоторое количество энергии требуется для разрыва связей в молекулах этих простых веществ или для перевода их в газообразное состояние. В результате этого энтальпия образования может быть и положительной, и отрицательной, и равной нулю величиной.
В общем случае значение и знак не дают оснований для каких-либо утверждений относительно термодинамической стабильности вещества, так как она зависит не только от энтальпийной, но и от энтропийной составляющей изменения свободной энергии при образовании этого вещества. Тем не менее, для сопоставления термодинамической стабильности представителей одной гомологической группы или соединений с близким строением молекул может быть достаточно информативным, в первом приближении, анализ их энтальпий образования. В этом случае вещество, имеющее меньшее значение энтальпии образования, обладает большей термодинамической стабильностью.
Для большинства соединений реакции их образования из простых веществ не могут быть осуществлены на практике. Основным источником фактической информации об энтальпиях образования органических соединений являются экспериментальные данные по энтальпиям их сгорания (), полученные калориметрическим методом. Накопленные к настоящему времени и рекомендуемые значения и содержатся в компиляциях . До настоящего времени справочные сведения об были представлены исключительно калориметрическими данными. Современные эмпирические методы прогнозирования также базируются только на калориметрических данных. При этом следует отметить, что информация, уникальная по спектру задействованных веществ, объему выполненных исследований и точности полученных термодинамических характеристик, содержится в результатах изучения химического равновесия. На наш взгляд, эффективное использование этих сведений позволит существенно расширить прогностические возможности методов массовых расчетов органических веществ.
ПРОГНОЗИРОВАНИЕ ЭнтальпиЙ образования
Основные методы прогнозирования энтальпий образования органических соединений относятся к , то есть характеризуют свойство вещества, находящегося в состоянии идеального газа при давлении 1 атм. и температуре 298,15 К, которую часто называют стандартной. Среди методов массовых расчетов особого внимания заслуживают методы молекулярной механики и аддитивные методы (лат. additio - прибавление). Большинство полуэмпирических методов не обеспечивает требуемого качества прогноза. Неэмпирические методы не дают прямого выхода на энтальпии образования веществ и к тому же до сих пор являются малодоступными для расчета свойств органических веществ со сложным строением молекул.
В группе методов молекулярной механики нами накоплен значительный опыт по использованию метода ММХ (на базе силового поля Эллинджера). Метод хорошо зарекомендовал себя в приложении к алканов. Однако уже для ароматических соединений его целесообразно использовать не для расчета энтальпий образования, а для оценки эффектов взаимодействия заместителей в молекуле, т.е. для разностей энтальпий образования изомеров. Для большинства галогенорганических, кислород-, азот- и серосодержащих соединений метод дает смещенные оценки . Тем не менее, этот метод следует применять во всех случаях для экспрессной оценки свойства. Как и любой другой метод, он требует подкрепления результатов сведениями, полученными другим методом прогнозирования. Метод молекулярной механики имеет прекрасный интерфейс и исключительно результативен как источник информации о строении молекул и их геометрических параметрах.
При отсутствии справочных данных для прогнозирования в настоящее время широко используются различные аддитивные методы. С момента создания основных аддитивных методов прогнозирования свойств органических веществ, находящихся в состоянии идеального газа, прошел значительный период времени, однако они сохраняют свою значимость, несмотря на становящиеся все более доступными методы молекулярного моделирования. Эти методы эффективны в тех случаях, когда свойство изменяется линейно при изменении количества однотипных фрагментов в молекуле. Строго аддитивной является, например, молекулярная масса вещества. Для энтальпий образования органических соединений аддитивный подход является во многих случаях лишь некоторым приближением в расчете. Дело в том, что даже в гомологической группе изменяется нелинейно с изменением числа углеродных атомов в молекуле (рис. 1.1).
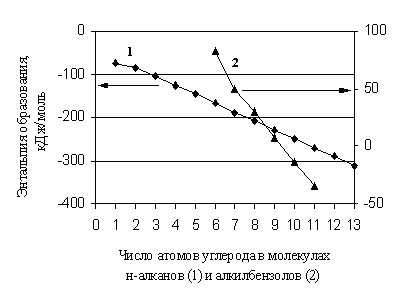
Рис. 1.1. Зависимость энтальпии образования н-алканов и алкил бензолов от числа атомов углерода в их молекулах
Таким образом, гомологическая разность не является величиной постоянной, особенно для первых членов гомологических групп. Точно так же при увеличении количества заместителей одного вида в молекулах органических веществ очень часто приходится говорить об отклонении от аддитивности в . Однако при введении поправок на неаддитивность методы данной группы работают вполне удовлетворительно, если степень и глубина их детализации достаточны и отвечают точности современного эксперимента.
В зависимости от принятой идеологии в качестве носителя структурной и количественной информации в аддитивных методах могут выступать составляющие молекулу атомы, группы атомов или связи. Большинство методов прогнозирования построено таким образом, что по мере расширения базы данных по энтальпиям образования относительно легко могут быть уточнены значения парциальных вкладов или введены новые поправки.
Общий подход к прогнозированию энтальпий образования веществ предполагает вычисление с последующим, при необходимости, переходом к идеально-газовым энтальпиям образования при других температурах или к , т.е. к свойству вещества в реальном состоянии.
Из всего разнообразия аддитивных методов расчета нами рассматриваются два; групповой метод Бенсона по атомам с их первым окружением и метод Татевского по связям.
Прогнозирование органических соединений методом Бенсона по атомам с их первым окружением
Следует признать, что из всего многообразия аддитивных схем для прогнозирования энтальпий образования органических веществ метод Бенсона в течение продолжительного периода применяется наиболее широко. Объясняется это, вероятно, тем, что этим методом охвачен наиболее широкий круг соединений. Для оперативной оценки абсолютного большинства соединений без привлечения каких-либо технических средств метод, пожалуй, не имеет себе равных. Совершенно очевидно, что ценой его универсальности является точность прогноза. Поэтому при использовании метода необходимо знать о неизбежных его ограничениях. На основные из них, являющиеся результатом нашей широкой апробации метода, мы постараемся обратить внимание потенциальных пользователей.
Метод Бенсона принято называть групповым, хотя в качестве структурной единицы в нем избран атом с его первым окружением . Метод разработан автором для расчета следующих идеально-газовых свойств веществ: теплоемкости при температурах, кратных 100 градусам, энтальпии образования и энтропии .
Энтальпия системы. Стандартные условия. Энтальпия образования вещества. Энтальпия реакции. Эндотермические и экзотермические реакции.
Энтальпия системы (от греч. enthalpo нагреваю) - ϶ᴛᴏ однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением H=U+PV, где V – объём системы.В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в данном случае называют изменением энтальпии системы или энтальпией процесса: Qр = ∆H; ∆H=∆U+P∆V. Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1.В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔH указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное. К примеру, при взаимодействии газообразных H2 и Cl2 образуются два моля газообразного HCl. Термохимическое уравнение записывается так: При взаимодействии газообразных H2 и O2 образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии: .Приведенные энтальпии образования веществ и энтальпии реакций отнесены к стандартным условиям (P = 101,325 кПа) и взяты для температуры T = 298 K. Стандартное состояние термодинамической функции, к примеру, энтальпии, обозначается нижним и верхним индексами: нижний индекс обычно опускают: Δ .
Энтальпия образования (теплота образования), энтальпия реакции образования данного вещества (или раствора) из заданных исходных веществ. Энтальпией образования химических соединения называют энтальпию реакции образования данного соединения из простых веществ. В качестве простых веществ выбирают химические элементы в их естественном фазовом и химическом состоянии при данной температуре. Так, при 298 К для хлора простым веществом служит газообразный хлор, состоящий из молекул С12, а для калия - металлический калий. Энтальпия образования твердого КСl при 298 К - это энтальпия реакции: К(тв.) + 1/2Сl2= КСl(тв.).Энтальпия образования КСl (тв.) при 500 К соответствует реакции: К(жидкий) + 1/2Cl2 = КСl(тв.), так как естественным фазовым состоянием (простым веществом) для калия становится уже не кристалл, а жидкость (т-ра плавления К 336,66 К).
Энтальпия образования должна быть определена при любой температуре. Стандартные энтальпии образования соответствуют реакциям образования, при которых и простые вещества, и получающееся соединение находятся придавлении 1 атм (1,01 x 105 Па). По определению, для всех простых веществ при любой температуре = 0. Для большинства хим. соед. энтальпия образования- отрицат. величины.
Единицы измерения энтальпии образования - Дж/г, Дж/моль.В термодинамике растворов (расплавов) под энтальпией образования понимают изменение энтальпии при изотермо-изобарном образовании 1 моля (1 г) раствора (расплава) данного состава из чистых компонентов. Так, в двухкомпонентной системе KF-A1F3 энтальпия образования расплава 50 %-ного молярного состава соответствует процессу: 1/2КF(жидкий) + 1/2А1F3(жидкий) = КF-А1F3(расплав, 50 мол. %).
Эндотерми́ческие реа́кции (от др.-греч. ἔνδον - внутри и θέρμη - тепло) - химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения (ΔH > 0, ΔU > 0), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.К эндотермическим реакциям относятся: реакции восстановления металлов из оксидов, электролиза (поглощается электрическая энергия),электролитической диссоциации (к примеру, растворение солей в воде),ионизации, фотосинтеза.Эндотермические реакции противоположны экзотермическим реакциям.
Экзотермическая реакция - химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится с энергией связи молекул следующим образом:ΔH = энергия, потраченная на разрыв связей - энергия, выделенная при образовании связей продуктов реакции.Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. При сгорании водорода, к примеру: 2H2 + O2 → 2 H2O изменение энтальпии равно ΔH = −483.6 кДж на один моль O2.
Горение топлива в кислороде воздуха.
Горение пороха.
Добавление концентрированной серной кислоты в воду.
Окисление жиров и углеводов в живых организмах.
Адиабатическое горение
Энтальпия системы. Стандартные условия. Энтальпия образования вещества. Энтальпия реакции. Эндотермические и экзотермические реакции. - понятие и виды. Классификация и особенности категории "Энтальпия системы. Стандартные условия. Энтальпия образования вещества. Энтальпия реакции. Эндотермические и экзотермические реакции." 2014, 2015.
Основные уравнения химической термодинамики и химического равновесия
1. Q = DE + W - уравнение первого начала термодинамики
2. W = PDV
3. Q v = DE v - теплота изохорного процесса
4. Q p = DH p - теплота изобарного процесса
5. DH p = DE + PDV - уравнение первого начала термодинамики для изобарных процессов
6. DH = å n DH 0 298 обр. прод. реак. - å n DH 0 298 обр. исх. веществ - первое следствие закона Гесса
7. DH = å n DH 0 298 сгор. исход. в. - å n DH 0 298 сгор. прод. реакции - в торое следствие закона Гесса
8. Q = W - уравнение первого начала термодинамики для биосистем
9. DS = ¾¾ - энтропия как функция состояния системы
10. DS ³ 0 - уравнение второго начала термодинамики
11 S = å n S 0 298 прод. р. - å n S 0 298 исх. в. - расчет энтропии реакции
12. DG 0 = DH 0 - TDS 0 - уравнения для расчета энергии Гиббса
13. DG 0 = å n DG 0 298 прод. р. - å n DG 0 298 исх. в. (x)
14. DG 0 = - 2,3RT lg Кс - уравнение изотермы химической реакции при стандартных условиях
15. - уравнение изотермы химической реакции
16. - константа химического равновесия, выраженная через равновесные концентрации вещества
17. - константа химического равновесия, выраженная через равновесные парциальные давления вещества
18. - уравнение изобары
19. - расчет теплового эффекта по значениям констант
Таблица 1
| Вещество | Стандартная энтальпия образования кДж/моль | Стандартная энтропия Дж/моль×К | Стандартная энергия Гиббса образования кДж/моль |
| Неорганические вещества | |||
| С (графит) | +6 | ||
| СО (г) | -110 | +198 | -137 |
| СО 2 (г) | -393,5 | +214 | -394 |
| Cl 2 (г) | +223 | ||
| Cl 2 O (г) | +76 | +266 | +94 |
| FeСО 3 (тв) | -753 | +96 | -680 |
| H 2 (г) | +131 | ||
| HCl (г) | -92 | +187 | -95 |
| HI (г) | +24 | +206 | -1 |
| HNO 2 (р-р) | -119 | +153 | -56 |
| HNO 3 (ж) | -174 | +156 | -81 |
| H 2 O (ж) | -286 | +70 | -237 |
| H 2 O 2 (ж) | -187 | +110 | -120 |
| H 2 S (г) | -21 | +206 | -34 |
| H 2 SO 4 (ж) | -814 | +157 | -690 |
| KNO 3 (тв) | -495 | +133 | -395 |
| KOH(р-р) | -477 | +92 | -441 |
| N 2 (г) | +192 | ||
| NH 3 (г) | -46 | +192 | -16 |
| H 2 O (г) | +82 | +220 | +104 |
| NO (г) | +91 | +211 | +87 |
| NO 2 (г) | +33 | +240 | +51 |
| N 2 O 3 (г) | +11 | +356 | +115 |
| Na 2 O 2 (тв) | -510 | +95 | -447 |
| Na 2 S 2 O 3 (тв) | -1117 | +225 | -1043 |
| O 2 (г) | +205 | ||
| SO 2 (г) | -297 | +248 | -300 |
| SO 3 (г) | -396 | +257 | -371 |
| Органические вещества | |||
| Метан (г) | -75 | +186 | -51 |
| Этан (г) | -85 | +229 | -33 |
| Этилен (г) | +52 | +219 | +68 |
| Ацетилен (г) | +227 | +201 | +209 |
| Бензол (ж) | +49 | +173 | +125 |
| Циклогексан (ж) | -156 | +204 | +27 |
| Хлорметан (г) | -86 | +234 | -63 |
| Дихлорметан (г) | -95 | +270 | -69 |
| Трихлорметан (г) | -101 | +296 | -69 |
| Тетрахлорметан (г) | -100 | +310 | -58 |
| Метанол (ж) | -239 | +127 | -166 |
| Этанол (ж) | -277 | +161 | -174 |
| Диэтиловый эфир (ж) | -279 | +253 | -123 |
| Ацетальдегид (г) | -166 | +264 | -133 |
| Ацетон (ж) | -247 | +199 | -154 |
| Пируват-ион (р-р) | + | -559 | |
| L-молочная кислота (р-р) | -686 | +222 | -539 |
| Сахароза (тв) | -2222 | +360 | -1545 |
| D-глюкоза (р-р) | -1264 | +269 | -917 |
| Нитробензол (ж) | +16 | +224 | +146 |
| Анилин (ж) | +31 | +191 | +149 |
| L-лейцин (р-р) | -643 | +208 | -362 |
| Глицин (р-р) | -523 | +159 | -380 |
| D,L-лейцилглицин (р-р) | + | -464 | |
| Глицилглицин (р-р) | -734 | +231 | -492 |
Стандартные энтальпии сгорания органических веществ, кДж/моль
Удельная теплота полного окисления веществ в условиях организма, кДж/г.
Обучающие задачи:
Задача 1 В организме человека реакция окисления этилового спирта протекает в две стадии. Первая - окисление этилового спирта до уксусного альдегида с участием фермента алкогольдегидрогеназы протекает по уравнению: С 2 H 5 OH + ½ O 2 = CH 3 COH + H 2 O.
Рассчитайте DH 0 реакции, используя первое следствие закона Гесса, если
DН 0 обр. (C 2 H 5 OH) = - 278 кДж/моль;
DН 0 обр. (CH 3 СOH) = - 166 кДж/моль;
DН 0 обр. (H 2 O) = - 286 кДж/моль.
Решение: DH 0 = å n DH 0 обр.пр.р. - å n DН 0 обр.исх.в.в; DH = (-166+ (-286)-(-278)) = - 174 кДж/моль
Ответ : тепловой эффект реакции DH = -174 кДж/моль, т.е. процесс экзотермический.
Задача 2. Теплота сгорания глюкозы равна -2810 кДж/моль, теплота сгорания этилового спирта равна -1366 кДж/моль. На основании этих данных вычислите тепловой эффект биохимического процесса брожения глюкозы:
С 6 Н 12 О 6 = 2С 2 Н 5 ОН + 2СО 2
Решение: Тепловой эффект данной реакции можно рассчитать, применяя второе следствие из закона Гесса:
DН = ån DН 0 сгор. исход. веществ - å n DH 0 сгор. прод. реакции
DН = -2810 - 2 ∙(-1366) = - 78 кДж/моль
Ответ: тепловой эффект процесса брожения равен - 78 кДж/моль.
Задача 3. Рассчитайте стандартную энтропию реакции:
NH 2 - CH 2 - COOH + NH 2 - CH 2 - COOH → NH 2 - CH 2 - CO - NH - CH 2 - COOH + H 2 O
глицин глицин глицилглицин
Если S 0 (глицилглицина) = 231 Дж/моль×К;
S 0 (глицина) = 159 Дж/ моль×К;
S 0 (H 2 O) = 70 Дж/моль×К;
Решение:
DS = S 0 298 (гл-гл) +S 0 298 (H 2 O)– 2 S 0 298 (глицина) = (231+70)-(159+159)= -17 Дж/моль×К
Ответ: DS 0 298 = - 17 Дж/моль×К, т.е. энтропия уменьшится.
Задача 4. Теплота сгорания углеводов, белков и жиров составляет 17, 17 и 39 кДж
соответственно. Среднесуточная потребность в белках, жирах и углеводах для студентов - мужчин составляет 113, 106 и 451г. Какова суточная потребность студентов - мужчин в энергии?
Решение: Рассчитываем сколько энергии выделяется при окислении углеводов, белков и жиров
DH = (451×17) + (113 × 17) + (106 × 39) = 13722 кДж.
Ответ: Суточная потребность в энергии равна 13722 кДж.
Задача 5. Почему процесс денатурации белка при 40 0 С является самопроизвольным, если реакция эндотермическая и тепловой эффект составляет 2830 Дж/моль? Значение DS для данной реакции равно 288 Дж/моль∙К
Решение: Для определения направления процесса необходимо знать величину изменения энергии Гиббса, рассчитываемой по уравнению: DG 0 = DH 0 - TDS 0 . Расчет показывает, что DG < 0 (DG 0 = 2830 Дж/моль - (313К × 288 Дж/моль∙К) = - 87314 Дж/моль или - 87,3 кДж/моль).
Ответ: Поскольку DG < 0, то процесс денатурации белка при 40 0 С протекает самопроизвольно, повышение температуры тела может представлять опасность для жизнедеятельности организма.
Задача 6. Вычислите энергию Гиббса, являющуюся критерием самопроизвольности процессов, для реакции гликолиза при стандартных условиях: С 6 H 12 О 6 (р-р) ® 2С 3 H 6 О 3 (р-р) (молочная кислота).
Решение:
Из таблицы термодинамических величин запишем стандартную энергию Гиббса для участников химического процесса: ∆G 0 (С 6 H 12 О 6) = -917 кДж/моль; ∆G 0 (С 3 H 6 О 3) = -539 кДж/моль. Используя 1 следствие из закона Гесса вычислим энергию Гиббса:
ΔG 0 = 2×ΔG 0 (C 3 H 6 O 3) - ΔG 0 (C 6 H 12 O 6)
ΔG 0 = 2(-539) – (-917) = -161 кДж/моль
Ответ: т.к. ΔG 0 < 0, то реакция протекает самопроизвольно в прямом направлении.
Задача 7. Вычислить изменение энергии Гиббса при 25 0 С по стандартным значениям энтальпий образования и абсолютных энтропий для данной реакции: СО + 2Н 2 = СН 3 ОН
DН 0 обр СН 3 ОН = -293 кДж/моль S 0 (СН 3 ОН) = 127 Дж/моль×К
DН 0 обр СО = - 110 кДж/моль. S 0 (CO) = 198 Дж/моль×К
S 0 (H 2) = 131 Дж/моль×К
Решение: DG 0 = DH 0 - TDS 0
DH 0 = ånDH 0 обр. пр. реак. - ånDН 0 обр. исх. веществ
DН 0 = - 293 - (-110) = - 183 кДж/моль
DS 0 = å n S 0 прод. р - å n S 0 исход. веществ
DS 0 = 127 - (198 + 2(131) = - 333 Дж/моль×К
DG 0 = - 183,5 кДж/моль - (298К × 0,333 кДж/моль×К) = - 83,8 кДж/моль
Ответ: DG 0 = - 83,8 кДж/моль
Задача 8. Рассчитайте константу равновесия при 310 К для реакции АТФ + АМФ ↔ 2АДФ, если свободная энергия Гиббса реакции ΔG°=-2,10кДж/моль.
Решение: в состоянии равновесия DG 0 = - 2,3RT lg Кс
K c = 10 0,354 =2,26
Ответ: Kc = 2,26
Задача 9. Константа равновесия реакции: PCl 5 (г) « PCl 3 (г) + Cl 2 (г) при 250 0 С равна 2. В каком направлении идет реакция при следующих концентрациях: С(PCl 5) = C(PCl 3) = 2 моль/л; С(Сl 2) = 4 моль/л?
Решение: Для определения направления протекания реакции воспользуемся уравнением изотермы
Рассчитаем Пс
Т.к. П с > К с, то DG > 0
Вывод: реакция самопроизвольно протекать в прямом направлении не может, т.к. DG>0.
Задача 10. Константа равновесия реакции 2SO 2 (г) + O 2 (г) Û 2SO 3 (г) при температуре 627 0 С равна 2,3∙10 -7 , DН 0 = 376,5 кДж/моль. Рассчитайте константу равновесия при 727 0 С.
Решение: воспользуемся уравнением изобары химической реакции:
T 1 = 273 + 627 = 900 K
T 2 = 273 + 727 = 1000K
Ответ: Константа равновесия при 727 0 С равна 3,56 × 10 -5 .
Задача 11. Для реакции Н 2 О(г) + СO(г) ® CO 2 (г) + H 2 (г) константы химического равновесия равны: при 800 0 С Кр = 2,87, при 1000 0 С Кр = 1,39. Вычислите тепловой эффект этой реакции.
Решение: Применив, уравнение изобары химической реакции, рассчитаем DН
Примем T 1 = 800 + 273 = 1073 K
T 2 = 1000 + 273 = 1273 K
Ответ: DН = -39,16 кДж/моль.
Задачи для самостоятельного решения:
Задача 1. На испарение 1 моля воды требуется 40 кДж. Сколько теплоты будет потеряно за день при выделении через кожу 720г воды?
Ответ: 1600 кДж
Задача 2. Пероксид водорода (Н 2 О 2) в виде раствора с массовой долей 3 %. используется в медицине для обработки ран. Докажите, что процесс разложения пероксида водорода в присутствии фермента каталазы является самопроизвольным, используя для расчёта значения стандартной энтропии образования исходных веществ и продуктов реакции:
S 0 298 (H 2 O 2) =110 Дж/моль×К; S 0 298 (Н 2 О) = 70 Дж/моль×К; S 0 298 (O 2) = 205 Дж/моль×К.
Ответ: Δ S = 62,5 Дж/моль × К
Задача 3. При сжигании метана объемом 2 м 3 выделяется 79600 кДж теплоты. Рассчитайте стандартную теплоту сгорания метана.
Ответ: 891,52 кДж/моль
Задача 4. Рассчитайте стандартную энергию Гиббса для процесса окисления глюкозы по следующим данным: DН 0 обр (С 6 Н 12 О 6) = - 1264,4 кДж/моль; DН 0 обр (СО 2) = - 393 кДж/моль;
DН 0 обр (Н 2 О) = - 286 кДж/моль. Изменение энтропии всей реагирующей системы равно 0,259 кДж/моль×K
Ответ: DG = - 2886,8 кДж/моль.
Задача5. Вычислите стандартную энтальпию образования этанола, воспользовавшись необходимыми для этого стандартными энтальпиями сгорания.
Ответ: DН 0 обр. = -273 кДж/моль
Задача 6. Константа равновесия реакции N 2 0 4 (г) ↔ 2N0 2 (г) при 25°С равна 0,1. В каком направлении будет идти реакция при следующих концентрациях веществ:
а) С(N0 2) = С(N 2 0 4) = 0,1 моль/л;
б) С(N0 2) = 0,01 моль/л; C(N 2 0 4) = 0,02 моль/л?
Задача 7. Для реакции H 2 + I 2 ® 2HI при 444 0 С константа равновесия равна 50. Определите направление процесса, если исходная смесь имеет следующий состав: С(H 2) = 2моль/л, С(HI) = 10моль/л.
Ответ: Состояние равновесия, т.к ∆G=0.
Задача 8 . Рассчитайте константу равновесия, если DG 0 298 для данной реакции равно 4,478 кДж/моль.
Ответ: 6,1
Задача 9. Константа равновесия разложения лекарственного вещества в автоклаве при 413К равна 0,396∙10 5 Па, а при 443К - 1,286∙10 5 Па. Вычислить тепловой эффект реакции.
Ответ: 59,6 кДж/моль.
Задача 10. Используя значение ΔG° установите, существует ли угроза отравления больного при использовании в качестве наркотического средства оксида азота(I), Токсичный оксид азота (II) может образовываться по реакции: 2N 2 O + O 2 = 4NO. Все вещества находятся в газообразном состоянии. Справочные данные см. в таблице.






