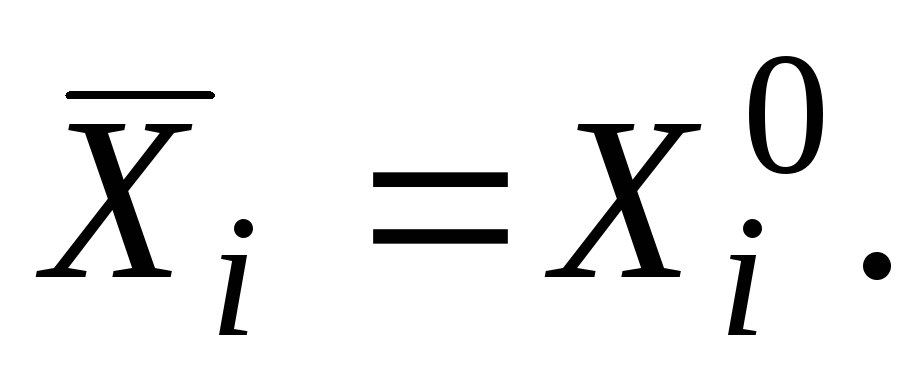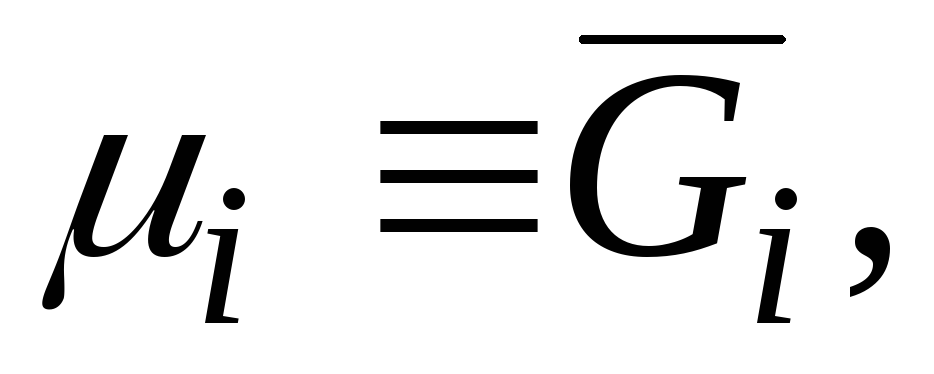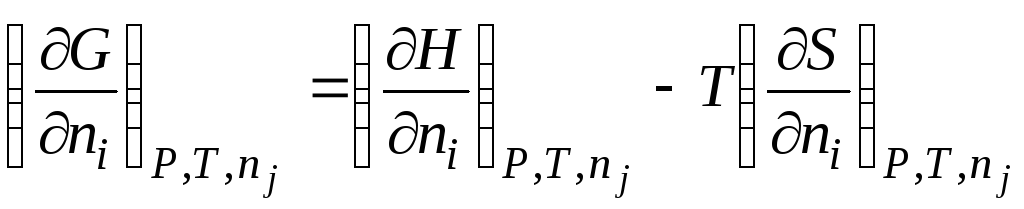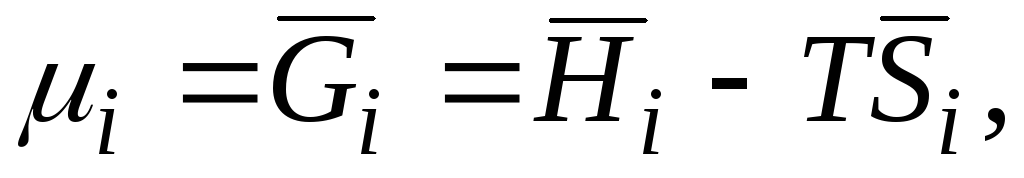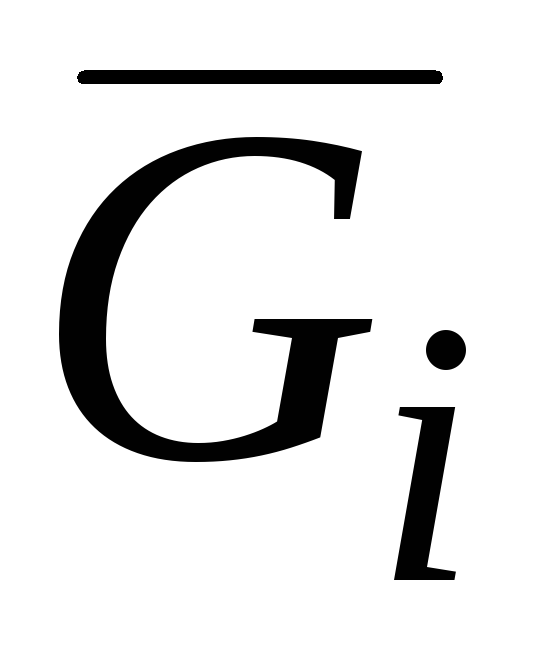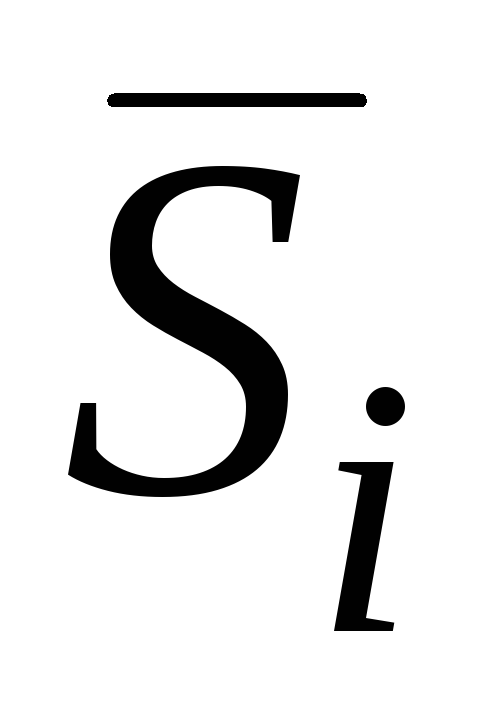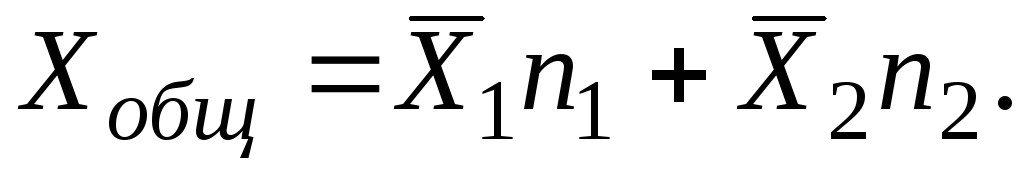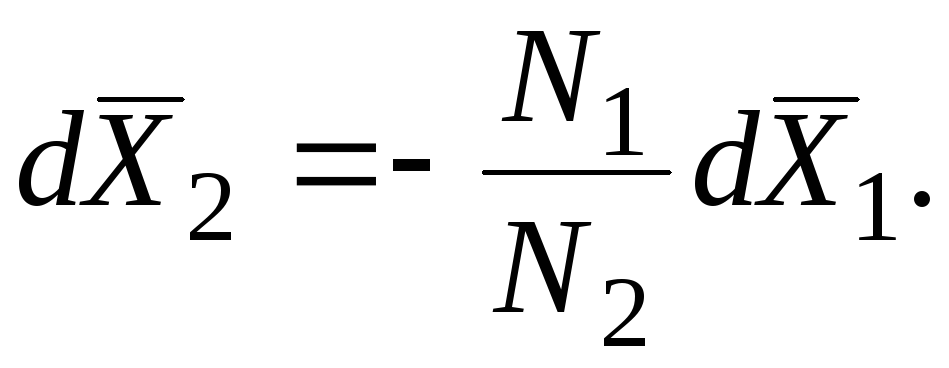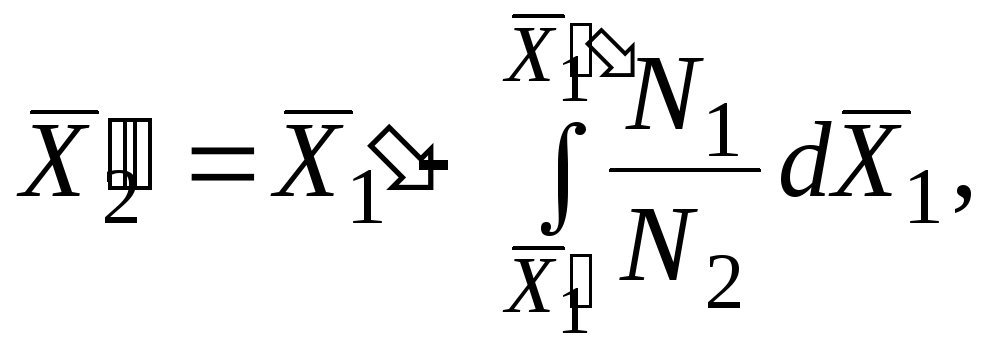Примеры задач. Физическая химия
Экстенсивные свойства пропорциональны количеству вещества. К ним относятся, например, объем, масса, внутренняя энергия, энтропия. Так, внутренняя энергия двух одинаковых кусков металла в два раза больше, чем энергия одного куска. Экстенсивные свойства системы аддитивно складываются из экстенсивных свойств составляющих ее частей. Такие свойства, как температура и давление, не зависящие от количества вещества, называются интенсивными . Для растворов интенсивные свойства определяются составом. Например, давление пара какого-либо компонента над раствором зависит от его концентрации. Величины интенсивных свойств в различных частях системы стремятся к выравниванию. Измерение интенсивной величины основано на том, что ее изменение всегда сопровождается изменением какой-либо экстенсивной величины. Так, для измерения температуры используют изменение объема вещества, например, ртути, т.е. экстенсивного свойства.
Г. Льюис назвал парциальной молярной величиной компонента g i частную производную от какой-либо экстенсивной величины g i по числу молей n i этого компонента раствора при постоянных давлении, температуре и числах молей остальных компонентов:
g i = (∂g /∂n i ) p.T.n j (j ≠ i ) . (V.1)Соблюдение условий, требуемых этим определением, может быть достигнуто, если, например, представить, что к очень большому объему раствора данной концентрации при постоянных р и Т добавляется 1 моль какого-либо компонента. В этом случае концентрация раствора практически не изменится и соответствующее изменение свойства раствора будет парциальной молярной величиной добавленного компонента.
Например, парциальный молярный объем V i , определяется уравнением:
V i = (∂V /∂n i ) p.T.n j (j ≠ i ) . (V.2)Если раствор образуется из компонентов без изменения объема, то очевидно, что парциальный молярный объем компонента равен его молярному объему, т.е. V i = V
| 0 |
| i |
раствора из компонентов соблюдается аддитивность объема, т.е. он не изменяется, то например, для бинарного раствора, состоящего из п 1 молей первого компонента и п 2 молей второго: V = n 1 V
| 0 |
| 1 |
| 0 |
| 2 |
| 0 |
| 1 |
| 0 |
| 2 |
Если, например, при образовании раствора энтальпия аддитивна, то ΔH = 0, и, следовательно, раствор образуется без теплового эффекта. Если же энтальпия исходных веществ больше энтальпии раствора, то при образовании раствора происходит выделение тепла. В противоположном случае будет происходить поглощение тепла.
Среди парциальных молярных величин особое значение имеет парциальная молярная энергия Гиббса:
G i = (∂G /∂n i ) p.T.n j (j ≠ i ) (V.3)которая, как отмечалось в гл. II, называется химическим потенциалом и обозначается μ.
Химический потенциал наряду с температурой и давлением является интенсивной величиной. Таким образом, равенство температур, давлений и химических потенциалов всех компонентов в различных частях системы выражает условия термического, механического и химического равновесий. Величина G i = μ i отражает тенденцию вещества покинуть данную фазу и является мерой его рассеиваемости.
Рассмотрим две соприкасающиеся фазы - раствор и пар над ним. В каждой из этих фаз присутствует данный компонент i . При равновесии G i pacтвop = G i пар.
Если бы, например, химический потенциал вещества в растворе был больше, чем в газовой фазе, то происходило бы испарение этого вещества, при котором G i раствор уменьшается, a G i пap увеличивается до тех пор, пока не установится равновесие. В обратном случае происходил бы переход компонента i из пара в раствор.
Примем, что парообразная фаза обладает свойствами идеальных газов. Так как в этом случае отсутствует взаимодействие между молекулами, то парциальная молярная энергия Гиббса компонента газа или его химический потенциал равны молярной энергии Гиббса чистого компонента G i при давлении, равном его парциальному давлению в смеси, т.е. μ i газ = G i газ = G i газ. Таким образом, согласно уравнению (II.28):
G i раствор = μ i раствор = G i = G
обычно обозначают μ + RT ln p i (V.4)Парциальные молярные величины характеризуют свойства растворов. Они играют такую же роль в термодинамических расчетах равновесий в растворах, как соответствующие функции U, H, F, G, S и т.д. при расчетах, относящихся к реакциям между чистыми веществами. В связи с этим целесообразным является составление таблиц парциальных молярных величин.
Введение
Тема 6. Растворы
Исследование растворов – важная область физической химии, поскольку как в природе, так и в технике нам постоянно приходиться иметь дело с растворами, а не с чистыми веществами. Например, получаемые в современной технике методами вакуумной и зонной плавок чистейшие металлы все же содержат ничтожные количества (10 –6 %) примесей, главным образом металлоидов, и по существу являются растворами.
Большая часть процессов, протекающих в природе, а также лежащих в основе различных технологических процессов, протекают в жидкой фазе. Так химические реакции при выплавке чугуна и стали происходят преимущественно в растворах. Жидкие чугун и сталь представляют собой растворы различных элементов в железе. В доменных и сталеплавильных печах они взаимодействуют с жидким шлаком – раствором оксидов.
Водные растворы солей, кислот и оснований широко используются в гидрометаллургии при извлечении цветных металлов из руд.
Раствором называется однородная, гомогенная система переменного состава, состоящая из двух или более компонентов. Растворы могут существовать в любом агрегатном состоянии – твердом, жидком или газообразном. Общим признаком их является однофазность.
Растворы весьма разнообразны по своей природе и по характеру взаимодействия между частицами их компонентов. Так, например, раствор серной кислоты в воде, образующийся с выделением большого количества тепла, характеризуется отчетливо выраженным химическим взаимодействием, а в растворе сжиженных благородных газов – аргона и неона – действуют физические силы. Во многих реальных растворах природа взаимодействия между частицами настолько сложна, что невозможно отделить ее химическую и физическую стороны.
Компонентами раствора являются растворитель (среда) и растворенное вещество (или несколько веществ), равномерно распределенных в растворителе в виде молекул, атомов или ионов. Под растворителем обычно понимают то вещество, которое находится в таком же агрегатном состоянии, что и раствор в целом. Если агрегатное состояние веществ, составляющих раствор, одинаковое, то растворителем называют то из них, которое преобладает в данной системе. Например, в 5%-ном растворе сахара в воде последняя является растворителем, а сахар – растворенным веществом. В целом понятия «растворитель» и «растворенное вещество» имеют до некоторой степени условный характер. Например, в концентрированных растворах различие между растворенным веществом и растворителем менее очевидно. Для 50%-ного раствора этилового спирта и воды понятия равноправны, а для раствора, в котором содержится 95 % спирта и 5 % воды, последняя является растворенным веществом. Поэтому понятия «растворитель» и «растворенное вещество» целесообразно использовать в применении к разбавленным (неконцентрированным) растворам. Для растворов электролитов вода всегда является растворителем, даже если ее и очень мало.
Состав раствора или его концентрацию выражают различными способами. Наиболее удобно выражать концентрацию раствора в мольных долях.
Молярная доля N i – отношение числа молей i -го вещества (n i ) к общему числу молей всех компонентов в данном количестве раствора Σn i :
В случае водных растворов концентрацию обычно выражают числом число молей растворенного вещества в 1 л раствора – молярная концентрация (С м):
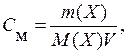 (6.2)
(6.2)
где V – объем раствора, дм 3 .
Однако, использование молярной концентрации не всегда удобно, так как концентрация раствора вследствие термического расширения зависит от температуры. В связи с этим часто также пользуются моляльностью. Моляльность (Cm ) – число молей растворенного вещества в 1000 г растворителя:
 (6.3)
(6.3)
где m 2 (X) – масса растворенного вещества, г; М(X) – молярная масса растворенного вещества, г/моль; m 1 – масса растворителя, г.
Между молярной долей и моляльностью в водных растворах существует соотношение
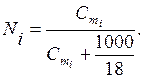 (6.4)
(6.4)
Вещество, переходя в раствор, становится компонентом раствора, теряет свою индивидуальность.
Свойства раствора могут быть охарактеризованы термодинамическими величинами V, H, U, F, G и т.д. Вследствие взаимодействия между молекулами компонентов раствора термодинамические характеристики имеет смысл относить к раствору как к целому, а не к составляющим его веществам. Так, раствор характеризуется вполне определенным, поддающимся простому измерению объемом, однако нельзя определить, какие объемы занимают в нем отдельные компоненты.
В каком либо растворе, например растворе серной кислоты в воде, наряду с энергией молекул серной кислоты и воды имеет место энергия взаимодействия между этими веществами, которая характеризует раствор и не может быть отнесена к какому-либо из компонентов. Однако все же важно охарактеризовать, какую долю вносит данный компонент в то или иное свойство раствора. Такая характеристика называется парциальной величиной.
Г. Льюис назвал парциальной молярной величиной компонента частную производную от какой-либо экстенсивной величины g по числу молей этого компонента раствора при постоянных давлении, температуре и числах молей остальных компонентов:
![]() (6.5)
(6.5)
Соблюдение условий, требуемых этим определением, может быть достигнуто, если, например, к весьма большому объему раствора данной концентрации при постоянных и Т добавить 1 моль какого-либо компонента. В этом случае концентрация раствора практически не изменится и соответствующее изменение свойства раствора будет парциальной молярной величиной добавленного компонента.
Например, парциальный молярный объем определяется уравнением
![]() (6.6)
(6.6)
Если раствор образуется из компонентов без изменения объема, то очевидно, что парциальный молярный объем равен его молярному объему, т. е. где индекс «нуль» означает, что вещество находится в чистом состоянии. В отличие от молярного объема парциальный молярный объем может быть отрицательной величиной, например, если вследствие молекулярного взаимодействия при добавлении компонента к раствору происходит уменьшение объема. Если при образовании раствора из компонентов соблюдается аддитивность, то, например, для бинарного раствора, состоящего из n 1 молей первого компонента и n 2 молей второго:
![]() (6.7)
(6.7)
где и – молярные доли чистых веществ.
Очевидно, в этом случае при образовании раствора
Если, например, при образовании раствора энтальпия аддитивна, то и, следовательно, раствор образуется без теплового эффекта. Если же энтальпия исходных веществ больше энтальпии раствора, то при образовании раствора происходит выделение тепла. В противоположном случае будет происходить поглощение тепла.
Среди парциальных молярных величин особое значение имеет парциальная молярная свободная энергия
![]() (6.8)
(6.8)
которая называется также часто химическим потенциалом и обозначается
Химический потенциал наряду с температурой и давлением является интенсивной величиной. Таким образом, равенство температур давлений и химических потенциалов всех компонентов в различных частях системы выражает условия термического, механического и химического равновесий (см.раздел 2.12).
Величина отражает тенденцию вещества покинуть данную фазу и является мерой его рассеиваемости. Рассмотрим две соприкасающиеся фазы – раствор и пар над ним. В каждой из этих фаз присутствует данный компонент i . При равновесии
Если бы, например, химический потенциал вещества в растворе был больше, чем в газовой фазе, то происходило бы испарение этого вещества, при котором ![]() уменьшается, а увеличивается, пока не установится равновесие. В обратном случае происходил бы переход компонента i
из пара в раствор.
уменьшается, а увеличивается, пока не установится равновесие. В обратном случае происходил бы переход компонента i
из пара в раствор.
Парциальные молярные величины характеризуют свойства растворов. Они играют такую же роль в термодинамических расчетах равновесий в растворах, как соответствующие функции (U, H, F, G, S и т. д.) при расчетах, относящихся к реакциям между чистыми веществами. В связи с этим целесообразно составление таблиц парциальных молярных величин. Чтобы определить парциальную молярную величину данного компонента, необходимо найти зависимость соответствующего экстенсивного свойства от состава раствора при постоянных р общ, T и числах молей остальных компонентов и произвести дифференцирование по числу молей этого компонента. Для бинарных растворов такое определение обычно производится графически при помощи метода отрезков. Для этого вычисляют свойство одного моля раствора.
Молем раствора называется такое его количество, при котором число молей каждого компонента равное его мольной доле. Например, один моль раствора углерода в жидком железе, в котором и содержит 0,1 моля углерода и 0,9 моля железа. Так как атомная масса углерода равна 12, а железа 55,85, то масса одного моля такого раствора составит 12×0,1+55,85×0,9=51,465 г.
Свойство раствора g , относящееся к одному молю, обозначается индексом . Например, объем одного моля раствора обозначается
Графический метод определения парциальных молярных величин представлен на рис. 6.1. По оси абсцисс откладывают молярные доли первого и второго компонентов (N 1 и N 2 ). Точка О соответствует первому чистому компоненту; в этой точке N 1 = 1 и N 2 = 0. Точка О 1 соответствует второму чистому компоненту; в этой точке N 1 = 0 и N 2 = 1. Каждая точка на прямой ОО 1 соответствует раствору определенного состава.
Величина какого-либо свойства одного моля раствора откладывается на оси ординат. Кривая АВ выражает зависимость свойства от состава раствора. Если при образовании раствора его свойство аддитивно складывается из свойств компонентов, то вместо кривой зависимость будет выражаться прямой линией. Отрезки ОА и О 1 В представляют собой соответственно мольные свойства чистых компонентов и
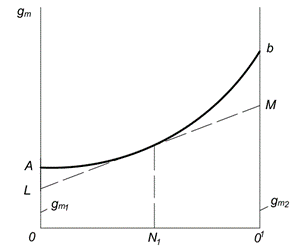
Рис. 6.1. Графический метод определения парциальных молярных величин
Для нахождения парциальных молярных величин компонентов в растворе данной концентрации, например , следует провести касательную LM к кривой АВ в точке, соответствующей ординате, восстановленной из Отрезки, отсекаемые касательной на осях ординат OL и О 1 M, равны парциальным величинам и
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Курсовая работа
Определение парциальных молярных величин
Введение
2.1 Аналитические методы
2.2 Графические методы
3. Экспериментальная часть
3.1 Приборы и реактивы
4. Результаты и обсуждение
Заключение
Список литературы
Приложение
Результаты
Введение
В природе существует бесчисленное количество систем, представляющих собой равномерную смесь одного вещества в другом или смеси нескольких веществ. Все существующие в природе смеси можно разделиться на две группы:
1) смеси, в которых имеется физическая граница раздела между компонентами. Такие смеси называют гетерогенными. Гетерогенные системы состоят из фаз, отличающихся друг от друга химическим составом и термодинамическими свойствами;
2) смеси, в которых нет физической границы раздела между компонентами. Поэтому во всех своих частях такие системы имеют одинаковые физико-химические свойства. Такие системы называют гомогенными или растворами.
Растворами называют гомогенную систему, состоящую из двух или большего числа компонентов, состав которой может в определенных пределах непрерывно изменяться.
Растворы могут быть в трех агрегатных состояниях: газообразном, жидком и твердом. На практике наиболее часто приходится встречаться с жидкими растворами. В жидком растворе различают растворитель и растворенное вещество, хотя с термодинамической точки зрения все компоненты раствора равноценны. Под растворителем понимают вещество, которое имеется в растворе в большем количестве. В данной работе рассматриваются жидкие растворы.
Структура и физические свойства жидкости зависят от химической индивидуальности образующих ее частиц и от характера и интенсивности сил, действующих между ними. В жидких системах проявляются различные виды взаимодействия.
По структуре жидкое состояние является промежуточным между твердым состоянием со строго определенной периодической структурой во всем кристалле и газом, в котором отсутствует какая-либо структура и движение частиц беспорядочно. Отсюда для жидкости характерно, с одной стороны, наличие определенного объема, а с другой стороны - отсутствие определенной формы. У жидкости вблизи температуры затвердевания упорядоченность внутренней структуры становится более выраженной. Напротив, по мере приближения жидкости к температуре кипения, усиливается беспорядок во взаимном расположении частиц.
Жидкие растворы могут быть получены при растворении газов, жидкостей, или твердых тел в соответствующем жидком растворителе. При образовании жидкого раствора, когда жидкий растворитель, характеризующийся определенной структурой, вводится растворяемое вещество, образуется новая структура с иным расположением частиц, чем в растворителе. При этом изменяются силы межмолекулярного взаимодействия.
В жидком растворе кроме взаимодействия, между одноименными молекулами появляется и взаимодействие между разноименными молекулами. Взаимодействие молекул может сопровождаться их распадом на ионы. Возможность и степень распада на ионы определяется природой растворенного вещества и природой растворителя. Распад на ионы связан либо с явлением диссоциации (разъединение), либо с явлением ионизации (образование ионов). Так при растворении ионных соединений имеет место диссоциация.
В результате взаимодействия между образовавшимися ионами и молекулами растворителя образуются сольваты (в водных растворах - гидраты). Совокупность молекул растворителя, окружающих ион, представляют собой сольватную оболочку. Различают первичную и вторичную сольватные оболочки. Первичной сольватной оболочкой называют оболочку, образующуюся в результате воздействия иона на ближайшие молекулы растворителя, которые теряют при этом независимое движение и перемещаются вместе с ионом. Например, первичная сольватная оболочка, содержит, согласно квантово-механическим расчётам, от 5 до 7 молекул воды на ион.
Взаимодействие между молекулами часто приводит к образованию других, более сложных молекул - комплексов.
Таким образом, растворы - это очень сложные системы, в которых растворённое вещество может находиться в виде отдельных молекул или ассоциатов, состоящих из нескольких молекул, либо частично или полностью диссоциированным на ионы. В связи с этим растворы подразделяются на растворы неэлектролитов и растворы электролитов.
Растворение сопровождается выделением или поглощением тепла. При растворении какого либо вещества разрушаются связи между молекулами (атомами или ионами) в растворенном веществе и растворителе, что связано с затратой энергии. Одновременно протекает процесс сольватации, т.е. возникают связи между частицами растворяемого вещества и растворителя. При этом энергия выделяется. Общий энергетический эффект растворения, в зависимости от соотношения количеств выделяемой и поглощаемой энергии, может быть как положительным, так и отрицательным.
Кроме энергетического эффекта, растворение сопровождается изменением объема смешиваемых компонентов. Например, при растворении спирта в воде объем раствора уменьшается примерно на 3,5% по отношению с общим объемом взятых веществ за счет образования сольватов.
При растворении иногда наблюдается изменение окраски раствора.
Целью данной работы является определение интегральных и парциальных молярных теплот растворения различных веществ и вывод интерполяционного уравнения для зависимости интегральной теплоты растворения от состава раствора.
Задачи работы:
1) С помощью калориметрических измерений определить значения интегральной теплоты растворения для различных концентраций образующегося раствора;
3) построить график зависимости теплоты растворения от состава раствора.
1. Парциальные молярные величины и их значение в термодинамике растворов
Парциальные мольные величины - термодинамические величины, которые используют для описания концентрационных зависимостей свойств растворов. Пусть M - некоторая экстенсивная функция состояния системы из h компонентов, т. е. свойство, зависящее от массы системы (объем, внутренняя энергия, энтальпия, энтропия, энергия Гиббса, энергия Гельмгольца, теплоемкость и т.п.). Для i-го компонента парциальная молярная величина Z определяется соотношением:
т.е. равна производной от величины M по числу молей компонента i при постоянных температуре T, давлении p и числах молей всех остальных компонентов. Так, парциальный молярный объем
где V - объем системы; парциальная молярная энергия Гиббса (химический потенциал)
где G - энергия Гиббса системы.
Парциальная молярная величина характеризует изменение величины M при добавлении к бесконечно большому количеству раствора 1 моля компонента i в условиях постоянства T, p и чисел молей всех остальных компонентов. Если молярная доля x i компонента равна единице, то парциальная молярная величина Z обращается в молярную величину M m для индивидуального вещества (например, парциальный молярный объем компонента - в молярный объем). Значение Z определяется не только природой i-го компонента, но и свойствами системы в целом, поскольку молекулы i-го компонента взаимодействуют со всеми другими молекулами; в неявном виде эта величина учитывает все изменения свойств системы при внесении i-го компонента.
В реальном растворе в общем случае все парциальные молярные величины зависят от состава, давления и температуры. Если раствор идеальный, то при заданных Т и p парциальные молярные объем, внутренняя энергия, энтальпия, теплоемкость во всей области концентраций постоянны и совпадают с соответствующими молярными величинами чистых компонентов. Химический потенциал m i ид и парциальная молярная энтропия S i ид связаны с соответствующими молярными величинами чистого вещества - энергией Гиббса и энтропией соотношениями:
где R - газовая постоянная.
Зависимость парциальных мольных величин от Т и p определяется теми же термодинамическими соотношениями, что и для соответствующих экстенсивных свойств. Так, для химического потенциала m i выполняются соотношения, аналогичные тем, которые справедливы для энергии Гиббса, а именно:
Функция M для системы в целом представляет собой сумму парциальных молярных величин компонентов, умноженных на соответствующие числа молей. B частности, энергия Гиббса системы. Молярное (удельное) значение: . Зависимости молярного значения M m от T, p, x 1 , ... , x n-1 служат для нахождения парциальных молярных величин:
Изменения парциальных мольных величин при изменении состояния системы связаны между собой уравнением Гиббса - Дюгема, которое в обобщённом виде записывается следующим образом:
При Т, p = const (изобарно-изотермические условия):
Согласно этому уравнению, в бинарной системе парциальные мольные величины M 1 и M 2 при изменении состава изменяются в противоположных направлениях. Экстремумы на кривых M 1 (x 1) и M 2 (x 1), если таковые имеются, наблюдаются при одном и том же составе и противоположны по типу. Например, для химических потенциалов
При T, p = const
Это соотношение служит для расчета химического потенциала компонента раствора на основании концентрационной зависимости химических потенциалов остальных компонентов, а также используется для проверки на термодинамическую согласованность экспериментальных данных о зависимостях химических потенциалов от состава, температуры и т.п.
2. Методы определения парциальных молярных величин
Для определения парциальных молярных величин необходимо зависимость общего экстенсивного свойства раствора от его состава или зависимости парциальной молярной величины одного из компонентов от состава раствора.
Методы определения парциальных молярных величин делятся на аналитические и графические.
2.1 Аналитические методы
Если известна зависимость общего экстенсивного свойства раствора от числа молей каждого компонента, например, в виде интерполяционного уравнения, то парциальные молярные величины определяются дифференцированием интерполяционного уравнения для экстенсивного свойства по числу молей данного компонента.
Подставляя соответствующее значение в полученное уравнение, вычисляют парциальную молярную величину данного компонента для раствора определенного состава.
В ряде случаев физико-химические методы позволяют найти только одну из функций - . Например, по давлению пара растворов нелетучих растворенных веществ можно найти только парциальную величину растворителя. Если известна зависимость парциальной молярной величины одного компонента от состава раствора, парциальную молярную величину второго компонента можно вычислить, пользуясь уравнением Гиббса - Дюгема.
Пусть для бинарного раствора молярная доля растворителя - x 1 , а молярная доля растворенного вещества - x 2 или x.
Пусть, например, известна во всем интервале значений x. Из уравнения
следует, что:
Интегрирование удобно производить от состава x = 1 до произвольного значения x = b:
Это молярное значение для чистого второго компонента, которое может быть измерено независимо от свойств изучаемого раствора. В данном случае необходимо знать предельное значение величины (0), т.е. при x>1.
2.2 Графические методы
Метод графического дифференцирования
Для определения парциальных молярных величин по опытным данным строят график зависимости общего экстенсивного свойства раствора от числа молей данного компонента.
Тангенс угла касательной к кривой в любой его точке будет соответствовать парциальной молярной величине данного компонента в растворе данного состава, так как
Данный метод не достаточно точен из-за возможных ошибок при проведении касательных и позволяет определить только одну из парциальных молярных величин.
Метод отрезков.
Метод отрезков используется для определения парциальных молярных величин бинарных растворов. Экспериментально определяют зависимость экстенсивного свойства Z от состава для одного моля раствора и строят график в координатах Z - x, где x - мольная доля второго компонента. Вид графика может быть любым. Задача состоит в том, чтобы по графику зависимости Z(x) найти значения и при всех значениях 0 ? x ? 1. Из определения = + = + . В уравнении имеется два неизвестных - и и известное из опыта значение. Необходимое для определения и второе уравнение получают дифференцированием по x.
С учетом прежних уравнений сумма двух последних слагаемых равна 0 и тогда
Качественный анализ графика зависимости показывает, что отрезки, отсекаемые касательной к кривой, и есть искомые величины и. Так как абсцисса - единый отрезок, то тангенс угла наклона равен отрезку, а это и есть разность величин.
Для раствора любого состава
Значения и можно найти из опытной кривой.
Графическое определение парциальной молярной величины одного компонента по известным значениям парциальных молярных величин второго компонента.
Уравнение
можно использовать для графического определения парциальных молярных величин. При графическом интегрировании удобно строить график в координатах. Тогда:
легко определяется по площади, ограничиваемой кривой зависимости от и осью абсцисс. Если из независимых источников известно, то можно найти полную величину
2.3 Вывод интерполяционной зависимости интегральной теплоты растворения от состава
Выразим зависимость интегральной теплоты растворения от числа молей растворенного вещества эмпирическим уравнение
где a,b,c - эмпирические постоянные. Тогда
Построим график в координатах, экстраполируем его точки. Отрезок, отсекаемый на оси ординат равен b, а тангенс угла наклона касательной к кривой точке, равен 2c. Зная интегральную теплоту растворения для раствора с данным числом молей растворенного вещества n 2 , находим постоянную a в уравнении.
3. Экспериментальная часть
3.1 Приборы и реактивы
1. Модуль УЛК «Термостат», подключенный к компьютеру.
2. Химический стакан на 100мл.
5. NaNO 3 х.ч.
7. NH 4 Cl х.ч.
3.2 Управление УЛК с помощью компьютера
1. Универсальный контролер подключается к персональному компьютеру через COM-порт с помощью специального соединительного шнура.
2. При включенном контролере необходимо запустить программу управления УЛК «Химия» - elsms2.exe.
3. В появившемся окне инициализации («Добро пожаловать в УЛК») необходимо выбрать вариант работы с УЛК - «Работа с контролером» или «Загрузить работу» и войти в программу управления УЛК путем нажатия кнопки «Вход». При выборе «Загрузить работу» можно загрузить сохраненную ранее лабораторную работу.
5. При проведении эксперимента измеряется температура, поэтому нужно установить в соответствующем окне интервал измерений и число измерений.
6. Так как измерение проводится при перемешивании, необходимо установить интенсивность перемешивания (например 3) и включить мешалку кнопкой «Мешалка».
7. В ходе проведения работы может проводиться несколько опытов, поэтому для каждого эксперимента необходимо указывать, например, массу навески. (Тогда в правом верхнем углу графика будет указана масса навески.) Для этого в группе элементов «Дополнительный параметр» необходимо выбрать пункт «Общий» и в поле «Значение» указать массу навески. Размерность указывается в поле «Размерность».
8. Измерение начинают включением кнопки «Измерение». При этом появится окно состояния измерения - «Обмен данными с контролером».
9. Измерение следует заканчивать после растворения соли тогда, когда изменение температуры будет незначительным и равномерным. Измерение заканчивается путем нажатия кнопки «СТОП». При этом экспериментальные данные автоматически запоминаются и установка переходит в режим управления. Для проведения следующих измерений необходимо нажать кнопку «Текущее состояние» и выполнять работу согласно пп. 5 - 8.
3.3 Методика выполнения работы
Определение интегральных теплот растворения начинают с определения постоянной калориметра. Для этого стакан, в который налито 100 см дистиллированной воды, устанавливают в калориметр и закрывают крышкой с укрепленным в ней датчиком температуры. В отверстие крышки вставляют специальную пробирку, в которую предварительно насыпано 2г измельченной соли с известной теплотой растворения (NH 4 Cl). Проводят калориметрический опыт и фиксируют изменение температуры. Затем выливают из стакана раствор, ополаскивают стакан, наливают в него 100 см дистиллированной воды и устанавливают в калориметр. Проводят растворение 2г исследуемой соли, фиксируя при этом изменение температуры. Аналогично проводят растворение 4, 6, 8, 10, 12, 16, 20 г исследуемой соли.
4. Результаты и обсуждение
Определение парциальных молярных теплот растворения проводят уравнением теплового баланса:
где и - масса воды и соли, соответственно, г;
c - теплоёмкость образующегося раствора, Дж/(гМК). При малых концентрациях, теплоемкость раствора можно приближенно принять равной теплоемкости воды. При больших концентрациях, теплоемкость раствора можно определить по справочным данным. Постоянная калориметра определяется по формуле:
Определение парциальной молярной теплоты KCl:
Определение парциальной молярной теплоты NaCl:
Определение парциальной молярной теплоты NaNO 3:
, (эксперимент проводился в тот же день)
Определение парциальной молярной теплоты KNO 3:
Заключение
С помощью калориметрических измерений определили значение интегральных теплот растворения для различных концентраций образующегося раствора, рассчитали парциальные теплоты растворения, построили графики зависимости теплоты растворения от состава раствора.
Список литературы
парциальный молярный интерполяционный интегральный
1. Стромберг А.Г., Семченко Д.П. Физическая химия. - М.: Химия, 1999г.
2. Краткий справочник физико-химических величин / под ред. А.А. Равделя, А.М. Пономеревой. - Л.: Химия, 1983г.
3. Физическая химия: И.А. Семиохин -- Москва, Издательство МГУ, 2001 г.
4. Термодинамические свойства электролитов: Васильев В.П. - М. Химия 1982г.
5. Физическая химия. Теоретическое и практическое руководство: Никольский Б.П. - 1987г.
6. Основы физической химии: Горшков В.И. - 1993г.
7. Краткий курс физической химии: Кочергин С.М. - 1978г.
8. Физическая химия: Жуховицкий А.А. - 1987г.
9. Физическая и коллоидная химия: Кузнецов В.В. - 1968г.
10. http://www.xumuk.ru
Приложение
Результаты
NH 4 Cl 2г (определение постоянной калориметра) ДT= -1,207
KCl 2г ДT= -0,9746
KCl 4г ДT= -2,333
KCl 6г ДT= -2,851
KCl 8г ДT= -3,843
KCl 10г ДT= -4,738
KCl 12г ДT= -5,706
KCl 16г ДT= -7,459
KCl 20г ДT= -9,314
NH 4 Cl 2г (определение постоянной колориметра) ДT= -1,098
NaCl 2г ДT= -0,2461
NaCl 4г ДT= -0,5072
NaCl 6г ДT= -0,6789
NaCl 8г ДT= -0,8499
NaCl 10г ДT= -1,008
NaCl 12г ДT= -1,125
NaCl 16г ДT= -1,303
NaCl 20г ДT= -1,397
NaNO 3 2г ДT= -0,7792
NaNO 3 4г ДT= -1,616
NaNO 3 6г ДT= -2,333
NaNO 3 8г ДT= -3,143
NaNO 3 10г ДT= -3,745
NaNO 3 12г ДT= -4,222
NaNO 3 16г ДT= -5,253
NaNO 3 20г ДT= -6,436
NH 4 Cl 2г (определение постоянной колориметра) ДT= -1.162
KNO 3 2г ДT= -1.164
KNO 3 4г ДT= -2.334
KNO 3 6г ДT= -3.415
KNO 3 8г ДT= -0,725
KNO 3 10г ДT= -4,878
KNO 3 12г ДT= -5,954
KNO 3 16г ДT= -7,369
NH 4 Cl (определение постоянной колориметра) ДT= -1.085
KNO 3 20г ДT= -4,575
График зависимости ДH от n i (KCl)
График зависимости ДH от n i (NaCl)
График зависимости ДH от n i (NaNO 3)
График зависимости ДH от n i (KNO 3)
Размещено на Allbest.ru
...Подобные документы
Основные направления в развитии теории растворов. Термодинамические условия образования растворов. Методы определения парциальных молярных величин. Закон Рауля, предельно разбавленные и неидеальные растворы. Азеотропные смеси и законы Гиббса-Коновалова.
курсовая работа , добавлен 24.12.2014
Определение объема воздуха необходимого для полного сгорания заданного количества пропана. Вычисление изменения энтальпии, энтропии и энергии Гиббса, при помощи следствий из закона Гесса. Определение молярных масс эквивалентов окислителя и восстановителя.
контрольная работа , добавлен 08.02.2012
Рассмотрение теоретических сведений о парциальных мольных свойствах компонентов раствора. Определение объема, энтропии, энтальпии и теплоемкости в бинарном растворе. Вычисление плотности масс водных растворов исследуемого вещества различной концентрации.
методичка , добавлен 24.05.2012
Взаимная связь парциальных катодных и анодных реакций на медном электроде в растворах с бескислородным окислителем при знакопеременной поляризации. Анодное растворение меди в хлоридных и сульфатных средах. Растворение в подкисленных сульфатных средах.
дипломная работа , добавлен 13.12.2015
Измерение электропроводимости разбавленных растворов тетрафторобората лития в пропиленкарбонате. Расчёт предельных молярных электрических проводимостей и констант ассоциации. Определение количественных характеристик ион-молекулярных взаимодействий.
курсовая работа , добавлен 28.10.2011
Приготовление растворов полимеров: процесс растворения полимеров; фильтрование и обезвоздушивание растворов. Стадии производства пленок раствора полимера. Общие требования к пластификаторам. Подготовка раствора к формованию. Образование жидкой пленки.
курсовая работа , добавлен 04.01.2010
Реактор идеального вытеснения. Реактор полного смешения. Изменение скорости окисления SO. Расчет изменения температуры через адиабатический коэффициент. Вычисление равновесных концентраций веществ, константы равновесия. Вычисление парциальных давлений.
курсовая работа , добавлен 20.11.2012
Определение растворов, их виды в зависимости от агрегатного состояния растворителя, по величине частиц растворенного вещества. Способы выражения концентрации. Факторы, влияющие на растворимость. Механизм растворения. Закон Рауля и следствие из него.
презентация , добавлен 11.08.2013
Расчёт константы равновесия процесса выращивания монокристаллов. Процесс сублимации компонентов Cd и Te. Расчёт парциальных давлений паров компонентов. Принципиальная схема реактора и распределение температуры. Оценка возможности окисления компонентов.
дипломная работа , добавлен 11.12.2016
Классификация погрешностей по способу выражения, источнику возникновения и в зависимости от условий проведения эксперимента. Оценивание генеральных параметров и распределение случайных величин. Методы исключения грубых ошибок. Сравнение двух дисперсий.
Образование раствора из компонентов – процесс самопроизвольный. Следовательно, термодинамическим условием образования раствора при P = const и T = const является убыль энергии Гиббса ΔG < 0. Такой процесс будет протекать самопроизвольно до тех пор, пока в системе не установится равновесие: растворяемый компонент (т, ж, г) растворяемый компонент (раствор). При равновесии ΔG = 0. Исключение составляют термодинамически неустойчивые пересыщенные растворы. С точки зрения термодинамики раствор называется насыщенным, когда химический потенциал чистого растворяемого вещества (твёрдого, жидкого, газообразного) равен химическому потенциалу этого вещества в растворе.
Уменьшение энергии Гиббса в процессе образования раствора может быть обусловлено и энтальпийным и энтропийным вкладом, так как ΔG = ΔH – T ΔS .
Особенность термодинамического подхода к растворам заключается в том, что здесь не требуется представлений о молекулярном механизме взаимодействия в растворах. Основным вопросом при таком подходе является установление зависимости свойств растворов от состава и свойств его компонентов. Для установления такой зависимости пользуются парциальными молярными величинами.
§ 5.5. Парциальные молярные величины
Большинство свойств поддающихся количественному выражению может быть разделено на две группы экстенсивные и интенсивные.
Экстенсивные свойства пропорциональны количеству веществ. К ним относятся, например, объем (V общ ), масса, внутренняя энергия (U общ ), энтропия (S общ ), энтальпия (H общ ), энергия Гиббса (G общ ) и др. Так, внутренняя энергия двух одинаковых кусков металла в два раза больше, чем энергия одного куска.Экстенсивные свойства системы аддитивно складываются из экстенсивных свойств составляющих ее частей.
Интенсивными называются свойства, не зависящие от количества вещества (такие как температура и давление). Для растворов интенсивные свойства определяются составом. Например, давление пара какого-либо компонента над раствором зависит от его концентрации.Величины интенсивных свойств в различных частях системы стремятся к выравниванию. Измерение интенсивной величины основано на том, что ее изменение всегда сопровождается изменением какой-либо экстенсивной величины. Так, для измерения температуры используют изменение объема вещества, например, ртути, т.е. экстенсивного свойства.
Рассмотрим двухкомпонентный раствор, состоящий из растворителя и растворённого вещества. Любое его экстенсивное свойство Х общ , зависит от числа молейп 1 растворителя, числа молейп 2 растворённого вещества, давленияР и температурыТ :
Обозначим
|
|
Парциальной
молярной величиной i
-го
компонента раствора ( )
называют частную производную от
какой-либо экстенсивной величины (Х
общ
)
по числу молей этого компонента (n
i
)
при постоянном давлении, температуре
и числе молей остальных компонентов.
)
называют частную производную от
какой-либо экстенсивной величины (Х
общ
)
по числу молей этого компонента (n
i
)
при постоянном давлении, температуре
и числе молей остальных компонентов.
Эту же мысль можно выразить в другой форме: парциальной молярной величиной i -го компонента называется изменение данного экстенсивного свойства раствора при добавлении одного моля i -го компонента к большому количеству раствора при постоянстве давления и температуры. Большое количество раствора означает, что добавление одного моля i -го компонента практически не изменяет состав раствора.
Для чистого вещества парциальная молярная величина равна свойству чистого вещества
|
|
где индекс «нуль» означает, что вещество находится в чистом состоянии.
Термодинамическим
свойствам раствора G
общ
,
H
общ
,
S
общ
,
V
общ
и т. п. соответствуют парциальные молярные
величины i
-го
компонента:  – парциальная молярная энергия Гиббса;
– парциальная молярная энергия Гиббса;
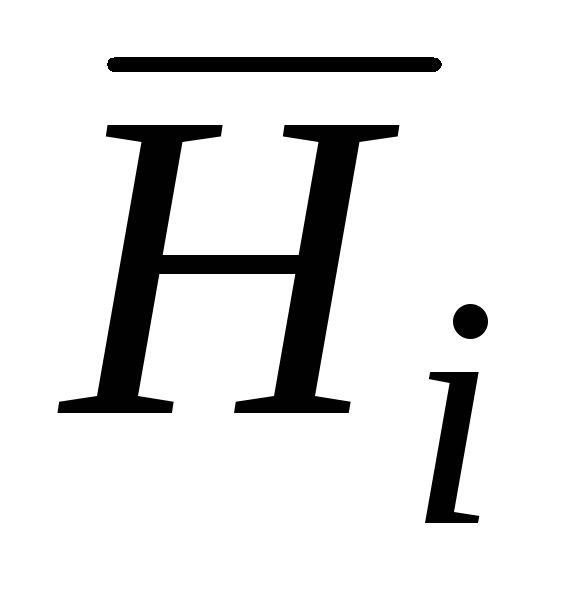 – парциальная молярная энтальпия;
– парциальная молярная энтальпия; 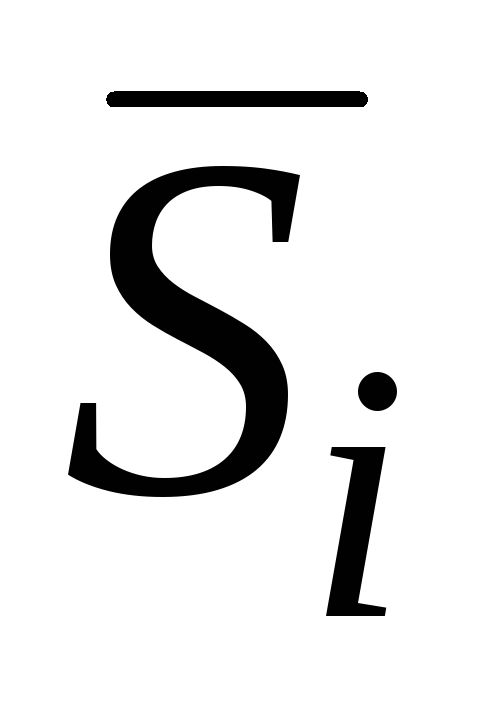 – парциальная молярная энтропия;
– парциальная молярная энтропия;  – парциальный молярный объём и т. п.
– парциальный молярный объём и т. п.
Среди парциальных молярных величин
наибольшее значение имеет парциальная
молярная энергия Гиббса
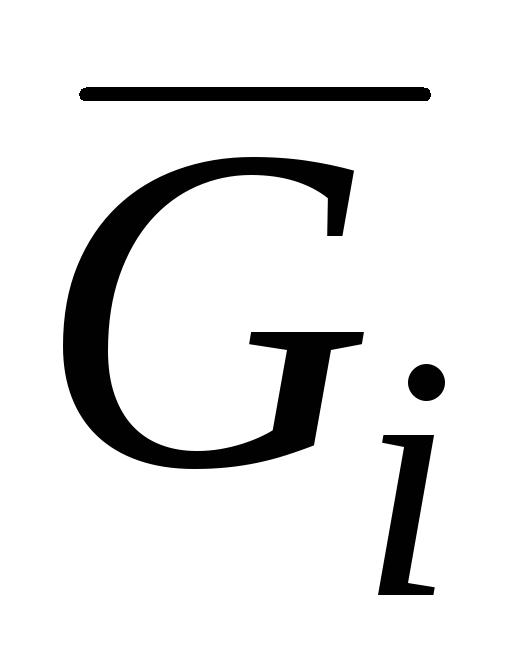 ,
которая тождественна химическому
потенциалу:
,
которая тождественна химическому
потенциалу:
|
|
что вытекает из сопоставления уравнений (3.3) и(5.6) .
Практическое значение парциальных молярных величин состоит в том, что между ними сохраняются те же по форме термодинамические соотношения, что и между обычными термодинамическими величинами.
Например, если от энергии Гиббса в уравнении () (G = H – TS ) взять производную по числу молей n i при постоянстве P , T и n j , получаем
|
| |||||
|
μ i
|
химический потенциал i -го компонента; парциальная молярная энергия Гиббса i -го компонента; парциальная молярная энтальпия i -го компонента; парциальная молярная энтропия i -го компонента. |
||||
Таким образом, при помощи парциальных молярных величин можно применить к растворам весь математический аппарат химической термодинамики для чистого вещества. Это даёт возможность выразить через термодинамические уравнения любые равновесные свойства раствора,к которым относятся давление пара компонентов над раствором, понижение температуры замерзания и повышение температуры кипения раствора, растворимость веществ, осмотическое давление, распределение вещества между двумя несмешивающимися растворителями и др.
Для вывода соотношений между парциальными молярными величинами компонентов раствора проинтегрируем уравнение (5.7) при постоянстве состава раствора. Такое условие означает, что оба компонента добавляются к раствору небольшими порциями и в таком соотношении, чтобы состав раствора не менялся (т.е. добавляются малые количества раствора такой же концентрации). Тогда парциальные молярные величины будут оставаться постоянными. При этом
|
|
Постоянная интегрирования в этом уравнении равна нулю, так как при п 1 = 0 ип 2 = 0 свойство раствораХ общ тоже равно нулю.
Таким образом, любое экстенсивное свойство может быть найдено из свойств компонентов для любого раствора путем аддитивного сложения, если использовать не молярные, а парциальные молярные величины.
Если же одновременно изменять и количество, и состав раствора, то изменение свойства Х общ можно найти дифференцированием уранения(5.10) :
Разделим обе части уравнений (5.10) и (5.12) на п 1 + п 2 . Учитывая, что
соответственно получаем
Молем раствора называется такое его количество, при котором число молей каждого компонента равно его молярной доле.
Для раствора из i компонентов суммирование нужно сделать по всем i компонентам:
Парциальные молярные величины, характеризующие изменение экстенсивных свойств раствора, могут быть, в отличие от самих свойств как положительными, так и отрицательными. Если раствор образуется из компонентов без изменения объема, то, очевидно, что парциальный молярный объем компонента равен его молярному объему. Если же вследствие сильного молекулярного взаимодействия при добавлении компонента к раствору происходит уменьшение объема, то парциальный молярный объем будет отрицательной величиной.
Парциальные молярные величины бинарных систем могут быть определены аналитическими и графическими методами. Наиболее часто используют графический метод отрезков. Для этого, по экспериментальным данным строят графическую зависимость экстенсивного свойства,например, молярного объёма раствора от состава (рис. 5.1.).
Затем при данном составе (например, в
точке А
) проводят касательную к
кривой. Пересечение этой касательной
с осями ординат в точкахВ
иС
даёт значения парциальных молярных
величин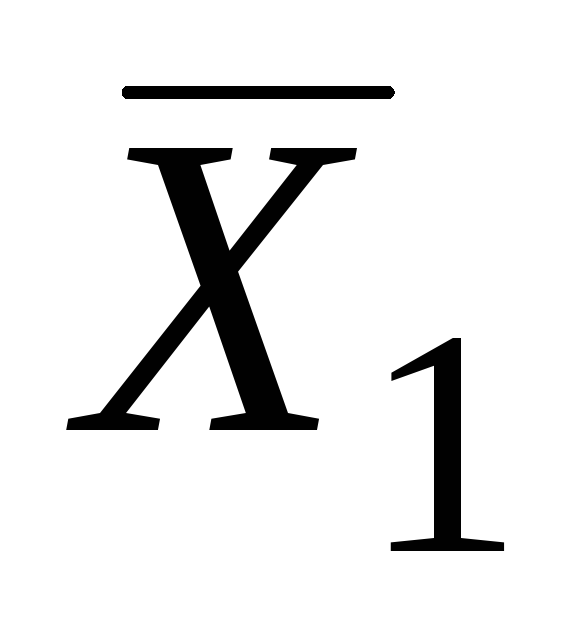 и
и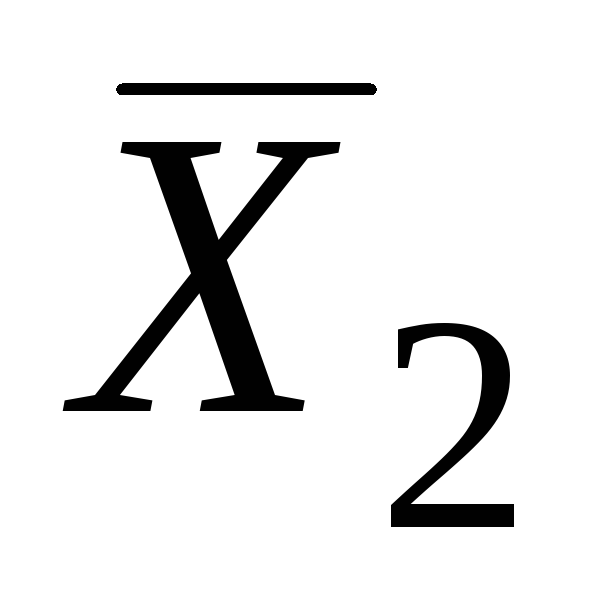 .
.
Парциальные молярные величины можно определить также по зависимости свойства раствора Х от числа молей растворённого компонента при постоянстве давления температуры и количестве растворителя. Тангенс угла наклона касательной к кривой на графикеХ общ = f (n 2) равен парциальной молярной величине.

Парциальную молярную величину одного компонента, можно вычислить из уравнения (5.14) , зная парциальную молярную величину другого:
|
При интегрировании этого уравнения получим
| ||||
|
|
парциальные молярные величины при разном составе системы. |
|||
Значение
интеграла находят из графика, построенного
в координатах  .
.