Сжатие и разрежение газов
Идеальных машин в реальной жизни не существует, это всего лишь мысленный конструкт. Каждая из таких гипотетических машин, среди которых двигатель Карно занимает немаловажное место, иллюстрирует какое-нибудь важное теоретическое заключение. (Даже воздушный замок под названием вечный двигатель служит, по сути, лишь для того, чтобы показать: нельзя получать энергию из ничего.) Двигатель Карно, лежащий в основе работы идеального теплового двигателя, был придуман французским инженером Сади Карно за двадцать лет до того, как были сформулированы основы термодинамики, однако он иллюстрирует важное следствие из второго начала термодинамики.
Рабочую часть двигателя Карно можно представить себе в виде поршня в заполненном газом цилиндре. Поскольку двигатель Карно - машина чисто теоретическая, то есть идеальная, силы трения между поршнем и цилиндром и тепловые потери считаются равными нулю. Поршень может свободно перемещаться между двумя тепловыми резервуарами - с высокой температурой и с низкой температурой. (Для удобства представим, что горячий тепловой резервуар нагревается посредством сжигания смеси бензина с воздухом, а холодный - остужается водой или воздухом комнатной температуры.) В этой тепловой машине происходит следующий идеальный четырехфазный цикл:
1. Сначала цилиндр вступает в контакт с горячим резервуаром, и идеальный газ расширяется при постоянной температуре. На этой фазе газ получает от горячего резервуара некое количество тепла.
2. Затем цилиндр окружается идеальной теплоизоляцией, за счет чего количество тепла, имеющееся у газа, сохраняется, и газ продолжает расширяться, пока его температура не упадет до температуры холодного теплового резервуара.
3. На третьей фазе теплоизоляция снимается, и газ в цилиндре, будучи в контакте с холодным резервуаром, сжимается, отдавая при этом часть тепла холодному резервуару.
4. Когда сжатие достигает определенной точки, цилиндр снова окружается теплоизоляцией, и газ сжимается за счет поднятия поршня до тех пор, пока его температура не сравняется с температурой горячего резервуара. После этого теплоизоляция удаляется и цикл повторяется вновь с первой фазы.
Двигатель Карно имеет много общего с реальными двигателями: он работает по замкнутому циклу (который называется, соответственно, циклом Карно ); он получает энергию извне благодаря высокотемпературному процессу (например, при сжигании топлива); часть энергии рассеивается в окружающую среду. При этом производится определенная работа (в случае двигателя Карно - за счет поступательного движения поршня). КПД, или эффективность двигателя Карно определяется как отношение работы, которую он производит, к энергии (в форме тепла), отнятой у горячего резервуара. Нетрудно доказать, что эффективность (E ) выражается формулой:
E = 1 - (T c /T h),
где Т c и Т h - соответственно температура холодного и горячего резервуаров (в кельвинах). Очевидно, что эффективность двигателя Карно меньше 1 (или 100%).
Великое прозрение Карно состоит в том, что он показал, что ни один тепловой двигатель, работающий при двух заданных температурах, не может быть эффективнее идеального двигателя Карно (это утверждение называют теоремой Карно ). В противном случае мы столкнулись бы с нарушением второго начала термодинамики, поскольку такой двигатель отбирал бы тепло от менее нагретого резервуара и передавал бы его более нагретому. (На самом деле, второе начало термодинамики является следствием теоремы Карно.) Таким образом, полученное Карно соотношение устанавливает предел эффективности реальных двигателей, работающих в реальном мире. К нему можно приблизиться, но достичь и, тем более превзойти его инженеры не смогут. Так что, чисто гипотетический двигатель Карно играет немаловажную роль в мире реальной, шумной и пахнущей разогретым машинным маслом техники, и это еще один пример прикладного значения чисто теоретических, на первый взгляд, изысканий.
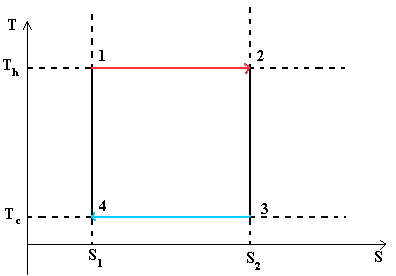
Рисунок 1 - Цикл Карно- идеальный термодинамический цикл.
На данной диаграмме представлен некий замкнутый цикл. Система последовательно переходит из точки 1 в 2 затем 3, 4 и снова в 1. Из графика видно что процесс 1® 2 является изотермическим (происходит при Т 1) и процесс 3® 4 также является изотермическим (происходит при T 2)
Процессы 2® 3 и 4® 1 являются адиабатными. Поскольку в них не происходит изменение энтропии то dS = 0 следовательно dQ = 0 или Q = const.
Количество тепла подводимое к системе:
Q 1 = T 1 ´ (S 2 -S 1) или площадь прямоугольника 1-2-S 2 -S 1 -1
Количество тепла отдаваемое системой:
Q 2 = T 2 ´ (S 2 -S 1) или площадь прямоугольника 3-S 2 -S 1 -4-3
Работа цикла L = Q 1 - Q 2
К.П.Д цикла h = (Q 1 - Q 2) / Q 1.
Важным следствием из формулы для КПД цикла Карно является то, что для увеличения КПД необходимо увеличивать температуру подвода тепла T 1 , и снижать температуру отвода тепла T 2 .
В тепловом двигателе, газ (реверсивно) нагревается (reversibly heated), а затем охлаждается. Модель цика следующая: Положение 1 --(изотермическое расширение) --> Положение 2 --(адиабатическое расширение) --> Положение 3 --(изотермическое сжатие) --> Положение 4 --(адиабатическое сжатие) --> Положение1
Положение 1 - Положение 2: Изотермическое расширение
Изотермическое расширение. В начале процесса рабочее тело имеет температуру T h , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q H . При этом объём рабочего тела увеличивается. Q H =∫Tds=T h (S 2 -S 1)=T h ΔS
Положение 2 - Положение 3: Адиабатическое расширение
Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Положение 3 - Положение 4: Изотермическое сжатие
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру T c , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Q c . Q c =T c (S 2 -S 1)=T c ΔS
Положение 4 - Положение 1: Адиабатическое сжатие
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
3. Цикл работы холодильной машины (к занятию №16)
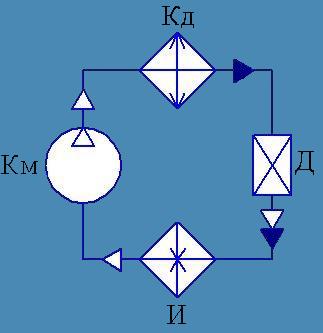
Холодильная машина – это машина, работающая по обратному циклу Карно . То есть если проводить цикл в обратном направлении, тепло будет забираться у холодильника и передаваться нагревателю (за счет работы внешних сил).
В холодильных установках перенос тепла от среды с более низкой температурой к среде с более высокой температурой осуществляется с помощью рабочего тела, называемого хладагентом.
Получение холода происходит по круговому процессу, или циклу, в котором процесс отнятия тепла от охлаждаемой среды сопровождается компенсирующим процессом – подводом энергии (например, при сжатии паров хладагента в компрессоре).
Процесс переноса тепла от менее нагретого тела к более нагретому при затрате механической работы называется обратным циклом Карно. Цикл состоит из следующих процессов:
1-2 – адиабатическое сжатие парообразного хладагента (конечная температура сжатия Т);
2-3 – изотермическая конденсация паров холодильного агента при температуре Т с отдачей окружающей среде (например, воде) теплоты конденсации Q;
3-4 – адиабатическое расширение жидкого хладагента (конечная температура расширения Т о);
4-1 – изотермическое испарение жидкого хладагента при температуре Т о с отнятием отохлаждаемой среды теплоты испарения Q о.
![]()
Такой цикл осуществим лишь при условии постоянства энтропии системы. Поэтому если при испарении хладагента энтропия охлаждаемой среды уменьшается на Q o /T о , то на такое же значение должна возрасти энтропия более нагретой среды (воды), которой передается тепло Q o , отнятое отохлаждаемой среды, и тепло, эквивалентное работе L к, затраченной на сжатие хладагента. В результате возрастание энтропии более нагретой среды составляет (Q о + L к)/T.
Согласно энергетическому балансу
Q o /T o = (Q о + L к)/T
Отсюда работа, которую необходимо затратить в холодильной установке, работающей по обратному циклу Карно
L к = Q o (Т – Т о)/ Т о
Тепло Q o , отнимаемое холодильным агентом отохлаждаемой среды при температуре Т о < Т, определяет холодопроизводительност ь цикла, или холодильной установки.
Таким образом, на примере обратного цикла Карно энергетический баланс любой холодильной машины:
где L – работа реального цикла.
Термодинамическая эффективность холодильных циклов выражается отношением холодопроизводительности Q o к затраченной работе, L причем это отношение называется холодильным коэффициентом и обозначается ε. Коэффициент ε выражается зависимостью
ε = Q o / L = Q/(Q – Q o) = Т о (S 1 – S 2) / [ Т (S 1 – S 2) – Т о (S 1 – S 2)] = Т о / Т – Т о
Холодильный коэффициент показывает, какое количество тепла воспринимается хладагентом от охлаждаемой среды на одну единицу затраченной работы.
Холодильный коэффициент, характеризующий степень использования механической работы на получение искусственного холода, как видно из выражения, не зависит от свойств холодильного агента или схемы действия холодильной установки, а является только функцией температур Т о и Т.При этом степень использования механической работы будет тем выше, чем меньше разность между температурами холодильного агента при отдаче Ти восприятии Т о тепла.
Изотермический процесс расширения 1 - 2 перегретого пара в координатах is показан на рис. 12.8. Определение начальной / и конечной 2 точек процесса понятно из ранее изложенного.
Изотермический процесс расширения или сжатия также можно осуществить обратимо в условиях быстрого теплообмена с внешней средой, необходимого для поддержания постоянной температуры.
В изотермическом процессе расширения воде сообщается количество тепла, равное теплоте парообразования / ч и в диаграмме s - Т графически определяемое площ.
В изотермическом процессе расширения п подводимое тепло целиком превращается в работу, а изменение внутренней энергии равно нулю.
Исключение составляет идеальный изотермический процесс расширения, когда все тепло переходит в работу, однако холодопроиз-водителыгость такого процесса равна нулю.
Итак, в изотермическом процессе расширения вся подведенная теплота расходуется на внешнюю работу, а при изотермическом процессе сжатия внешняя работа полностью превращается в тепло.
Таким образом, в изотермическом процессе расширения газа внутренняя энергия системы, преобразованная в работу против внешнего давления, восполняется за счет притока теплоты. В рассмотренном здесь случае обратимого проведения процесса совершенная работа идентична максимальной полезной работе, которая, как показано ниже, равна изменению функции состояния. При необратимом проведении процесса (потери на трение, Ар0) часть полезной работы теряется, переходя в теплоту.
На рис. 4 - 3 представлен изотермический процесс расширения идеального газа в системе ри.
Следует отметить, что полученное для частного случая изотермического процесса расширения измерение энтропии AS Q / T такое же, какое и раньше было получено из анализа цикла Карно. Таким образом, статистическая физика обосновывает существование функции состояния - энтропии, приращение которой при обратимых процессах равно приведенной теплоте, и положения о том, что энтропия замкнутой системы стремится к максимуму. Эта функция состояния позволяет с помощью измерений термических величин выяснить направление процессов и условия равновесия. С принципом возрастания энтропии в замкнутых системах связаны представления о тепловой смеси Вселенной, выдвинутые Клаузиусом, который утверждал: Энергия мира постоянна, энтропия мира стремится к максимуму. Отсюда - вывод о достижении в результате односторонних процессов, протекающих в природе, конечного состояния равновесия, в котором энтропия мира максимальна и Вселенная погибает от тепловой смерти.
Сравнивая (15.16) и (15.4), замечаем, что удельная работа теоретического пневмодвигателя при полном изотермическом процессе расширения равна такой же по величине удельной энергии воздуха. Это справедливо и для адиабатного и политропного процессов.
Сравнивая (288) и (272), замечаем, что удельная работа теоретического пневмодвигателя при полном изотермическом процессе расширения равна такой же по величине удельной энергии воздуха. Это справедливо и для адиабатного и политропного процессов расширения.
Из рис. 23 видно, что отрезок СВ, равный Asp - As0, одновременно представляет приращение энтропии в изотермическом процессе расширения СВ.
Совокупность рабочих процессов в детандере как и в компрессоре, не представляет собой замкнутый термодинамический процесс-цикл. Однако изотермический процесс расширения трудно осуществить, и процессы в детандерах близки к адиабатным.
На рис. 15.7 изображены теоретические индикаторные диаграммы при различных процессах расширения воздуха в двигателях. Для осуществления изотермического процесса расширения кривая 2 - 3, показатель политропы п 1) необходимо подводить тепло так, чтобы температура воздуха поддерживалась постоянной, а для адиабатного процесса (кривая 2 - 3, п К) следует исключить теплообмен с окружающей средой. Политропный процесс будет в том случае (кривая 2 - 3, 1 п k), если подвод тепла будет меньшим, чем при изотермическом процессе.
Осуществить обратимо цикл при таких условиях можно следующим образом. Сначала в изотермическом процессе расширения теплота обратимо подводится к рабочему телу от теплоотдат-чика с постоянной температурой.
Внутренняя энергия (см. табл. 1.1) состоит из энергии Гельмгольца F и связанной энергии TS. Убыль энергии F при изотермическом процессе расширения (S const) равна работе RT In (VVK2) - Поглощение системой теплоты (при V const) приводит к приращению связанной энергии на Т (S2 - Sx), поскольку dS 8Q / T. Если нет изменения объема при постоянной температуре, то убыль энергии Гельмгольца позволяет получить полезную работу.
Прямой цикл Карно состоит из гетырех процессов (фиг. Кри - ая А-В изображает изотермический процесс расширения газа при тостоянной температуре 7; кривая 3 - С изображает адиабатный процесс расширения газа при отсутствии теплообмена с внешней сре - 50Й; кривая C-D изображает изотермический процесс сжатия газа при постоянной температуре Tz; фивая D-A изображает адиабатный процесс сжатия газа при отсутствии теплообмена с окружающей средой. В про-лессах А-В и В-С газ, расширяясь, совершает внешнюю работу, 1 в процессах C-D и D-A газ сжимается и на его сжатие затрагивается внешняя работа. Применив уравнение первого закона термодинамики ко всему циклу, получим Qt - Q2A (L. Следовательно, в прямом цикле Карно подведенная теплота Qi частично расходуется на совершение полезной работы, равной численно площади A-B-C-D-A (фиг. КПД дикла Карно принципиально не может быть равным единице.
В общем случае значение а, зависит от температуры и давления. В то же время при изотермическом процессе расширения газа величина а, встречается как произведение ар.
Изображение реге - а процесс расширения 4 - / - сообщением ему. Несмотря на это свойство цикла Карно, в основу работы реальных двигателей, как это будет следовать из дальнейшего, положены другие циклы. Это в основном объясняется невозможностью осуществить в реальных условиях изотермические процессы расширения и сжатия.
Работа, совершаемая сжатым воздухом при наполнении и расширении, является положительной, а при выхлопе отрицательной. Как видно на рис. 93, а, максимальная работа будет при изотермическом процессе расширения, а минимальная - при адиабатическом.
Cтраница 2
На первый взгляд может показаться, что такой формулировке противоречит, например, процесс изотермического расширения идеального газа. Действительно, все полученное идеальным газом от какого-то тела тепло превращается полностью в работу. Однако получение тепла и превращение его в работу не единственный конечный результат процесса; кроме того, в результате процесса происходит изменение объема газа.
На первый взгляд может показаться, что формулировке Томсона противоречит, например, процесс изотермического расширения идеального газа. Действительно, в ходе этого процесса все полученное идеальным газом от некоторого тела количество теплоты превращается полностью в работу. Однако получение теплоты и превращение ее в работу не является единственным конечным результатом процесса; кроме того происходит изменение объема газа.
Зная, как изображаются изотермический и адиабатный процессы в Ts-диаграмме, можно построить в ней цикл Карно. Здесь 1 - 2 - процесс изотермического расширения, во время которого подводится количество тепла qv, измеряемое площадью 1 - 2 - 5 - 6 - 1; 2 - 3 - адиабатное расширение; 3 - 4 - изотермическое сжатие, при котором отводится количество тепла д %, измеряемое площадью 4 - 3 - 5 - 6 - 4; 4 - 1 - адиабата сжатия. Количество тепла 70, перешедшее в полезную работу w0, изобразится пл.
ДАВЛЕНИЕ КРИТИЧЕСКОЕ - см. состояние вещества критическое. ДАВЛЕНИЕ НАСЫЩЕНИЯ - максимальное давление, при котором в процессе изотермического расширения нефти или пластовой воды начинается выделение сорбированного ими газа. Однако достоверность этого метода пока не обоснована. Нефти в присутствии газовой шапки, как правило, насыщенные.
Как видно из уравнения (VI, 5) в процессе изотермического расширения энтропия возрастает. Так же как и в предыдущем примере плавления кристаллической ртути, в процессе изотермического расширения некоторое количество теплоты (которая берется из теплоисточника - термостата) при постоянной температуре обратимо сообщается расширяющемуся газу.
Рассмотрим особенности фазового перехода из жидкого состояния в газообразное - переход жидкости в пар. Если в результате аварии происходит разгерметизация, а температура по инерции сохраняет свое значение, то развивается процесс изотермического расширения dabe. Опыт показывает, что при переходе к изотермам с более высокими значениями температуры длина участка ab уменьшается, для более низких температур длина участка ab увеличивается.
Обратный цикл Карно изображается в s - Г - диаграмме также прямоугольником / - 2 - 3 - 4 (рис. 7.6, б), но все процессы в нем направлены против часовой стрелки. Цикл также состоит из двух изотерм и двух адиабат: / - 2 - процесс адиабатного расширения, 2 - 3 - процесс изотермического расширения, 3 - 4 - процесс адиабатного сжатия, 4 - / - процесс изотермического сжатия.
Так как данный газ изолирован от окружающей среды (Q О, А 0), то его внутренняя энергия U, как это следует из первого начала термодинамики, должна оставаться постоянной. Значит, в качестве обратимого процесса, переводящего газ в то же конечное состояние, что и данный процесс, можно рассматривать процесс обратимого изотермического расширения, в ходе которого объем газа увеличивается в два раза.
На практике процессы изотермического расширения осуществить обычно довольно трудно вследствие недостаточной теплопроводности; тем не менее интересно провести сравнение термодинамических свойств такого течения с более обычным адиабатическим течением. При этих условиях изотермическое расширение дает верхний предел коэффициента полезного действия процесса расширения. Процессы изотермического расширения в ракетных соплах были рассмотрены теоретически , но вследствие малого времени пребывания частиц газа в сопле практическое использование этих процессов, по-видимому, неосуществимо.
Из точки / с параметрами р1; ух, 7 рабочее тело адиабатно расширяется до состояния 2 (процесс / - 2) и соединяется с источником с низкой температурой. Дальнейшее расширение (процесс 2 - 3) происходит с подводом теплоты с / 2 к рабочему телу. Протекает процесс изотермического расширения.
Карно можно представить се бе следующим образом. В процессе изотермического расширения 1 - Г газ находится в тепловом контакте и равновесии с телом, имеющим температуру TV Таким телом. Это тело называют нагревателем. Ясно, что теплоемкость нагревателя должна быть, строго говоря, бесконечно большой. В противном случае отдача газу теплоты Q4 вызвала бы понижение температуры нагревателя, а следовательно, и нарушение изотермичное процесса расширения газа. В процессе I - - 2 газ полностью теплоизолируют и его расширение продолжает происходить адиабатически.
Тот же результат легко получить и непосредственно из уравнения (3 - 177), Так как мы условились, что рассматриваемый в этом примере источник работы обладает свойствами идеального газа и так как температура источника в состояниях 1 и 2 одинакова и равна Т0, то внутренняя энергия источника работы в состояниях 1 и 2 также одинаков а и первое слагаемое уравнения (3 - 177) равно нулю. Второе слагаемое уравнения представляет собой количество тепла, подведенное к источнику работы в изотермическом процессе при температуре Т0, равное работе в этом процессе (внутренняя энергия остается неизменной. Энтропия источника работы в процессе изотермического расширения увеличивается (тепло подводится. Slt и поэтому второе слагаемое уравнения (3 - 177) будет положительно. Последнее слагаемое уравнения будет отрицательно (F2 Fj), а численное значение его эквивалентно площади а-с-2 - Ъ - а. Таким образом, L ts (площадь l - 2 - b - a - l) - (площадь а-с-2 - Ь - а) (площадь l - 2 - c - l), что, как и следовало ожидать, совпадает с ранее полученным результатом.
Основными способами передачи энергии от одной части системы к другой являются теплота и работа. Например, изотермическое расширение идеальных газов не сопровождается выделением или поглощением теплоты, если процесс протекает без совершения газом работы. Если процесс изотермического расширения газа сопровождается работой, то происходит поглощение теплоты.
Процессы в ГХМ протекают в такой последовательности. Теплота сжатия в этом процессе отводится в окружающую среду. Затем сжатый газ при одновременном движении поршней влево проталкивается через охлажденный регенератор 2 (изохорный процесс), при этом температура и давление газа понижаются. В следующий момент происходит процесс изотермического расширения газа, при котором правый поршень неподвижен, а детандерный поршень идет влево.






