Hidrokarbonların kimyasal reaksiyon türleri. İlave reaksiyonları. Tolüenin kimyasal özellikleri
Hidrokarbonların karakteristik kimyasal özellikleri: alkanlar, alkenler, dienler, alkinler, aromatik hidrokarbonlar
Alkanlar
Alkanlar, moleküllerindeki atomların tekli bağlarla bağlandığı ve $C_(n)H_(2n+2)$ genel formülüne karşılık gelen hidrokarbonlardır.
Homolog metan serisi
Bildiğin üzere, homologlar- bunlar yapı ve özellik bakımından benzer olan ve bir veya daha fazla $CH_2$ grubu bakımından farklılık gösteren maddelerdir.
Doymuş hidrokarbonlar metanın homolog serisini oluşturur.
İzomerizm ve isimlendirme
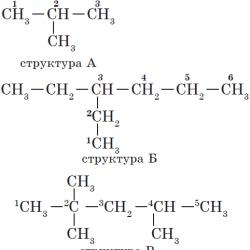
Alkanlar yapısal izomerizm olarak adlandırılan özelliklerle karakterize edilir. Yapısal izomerler karbon iskeletinin yapısında birbirinden farklıdır. Bildiğiniz gibi yapısal izomerlerle karakterize edilen en basit alkan bütandır:
Alkanlar için IUPAC isimlendirmesinin temellerine daha yakından bakalım:
1. Ana devrenin seçilmesi.
Bir hidrokarbon adının oluşumu, ana zincirin tanımıyla başlar - moleküldeki en uzun karbon atomu zinciri, sanki onun temelidir.
2.
Ana zincirin atomlarına numaralar verilmiştir. Ana zincirin atomlarının numaralandırılması, ikame edicinin en yakın olduğu uçtan (A, B yapıları) başlar. İkame ediciler zincirin ucundan eşit uzaklıkta bulunuyorsa, numaralandırma bunların daha fazla olduğu uçtan başlar (B yapısı). Farklı ikame ediciler zincirin uçlarından eşit uzaklıkta bulunuyorsa, numaralandırma kıdemli olanın en yakın olduğu uçtan başlar (yapı D). Hidrokarbon ikame edicilerinin kıdemi, adlarının başladığı harfin alfabede görünme sırasına göre belirlenir: metil (—$СН_3$), ardından propil ($—СН_2—СН_2—СН_3$), etil ($—СН_2) —СН_3$ ) vb.
İkame edicinin adının sonek değiştirilerek oluşturulduğunu lütfen unutmayın. -BİR sonek eklemek -il karşılık gelen alkan adına.
3. İsmin oluşumu.
İsmin başında sayılar belirtilir - ikame edicilerin bulunduğu karbon atomlarının sayıları. Belirli bir atomda birden fazla ikame edici varsa, isimdeki karşılık gelen sayı, virgülle ayrılarak iki kez tekrarlanır ($2,2-$). Numaradan sonra, ikame edicilerin sayısı kısa çizgi ile gösterilir ( di- iki, üç- üç, dörtlü- dört, penta- beş) ve vekilin adı ( metil, etil, propil). Daha sonra boşluk veya kısa çizgi olmadan ana zincirin adı. Ana zincire, homolog metan serisinin bir üyesi olan hidrokarbon adı verilir ( metan, etan, propan vb.).

Yukarıda yapısal formülleri verilen maddelerin isimleri aşağıdaki gibidir:
— A yapısı: $2$ -metilpropan;
— B yapısı: $3$ -etilheksan;
— B yapısı: $2,2,4$ -trimetilpentan;
— G yapısı: $2$ -metil$4$-etilheksan.
Alkanların fiziksel ve kimyasal özellikleri
Fiziki ozellikleri. Homolog metan serisinin ilk dört temsilcisi gazlardır. Bunlardan en basiti, renksiz, tatsız ve kokusuz bir gaz olan metandır (algıladığınızda gazın kokusu, 104$ olarak adlandırmanız gerekir), merkaptanların kokusuyla belirlenir - metan gazına özel olarak eklenen kükürt içeren bileşikler. ev ve endüstriyel gaz cihazlarının yanında bulunan kişilerin sızıntıyı koku yoluyla tespit edebilmeleri için).
$С_5Н_(12)$ ila $С_(15)Н_(32)$ arasındaki bileşime sahip hidrokarbonlar sıvıdır; Daha ağır hidrokarbonlar katıdır.
Alkanların kaynama ve erime noktaları, karbon zinciri uzunluğunun artmasıyla birlikte giderek artar. Tüm hidrokarbonlar suda az çözünür; sıvı hidrokarbonlar yaygın organik çözücülerdir.
Kimyasal özellikler.
1. Yer değiştirme reaksiyonları. Alkanlar için en karakteristik reaksiyonlar, bir hidrojen atomunun bir halojen atomu veya bir grup ile değiştirildiği serbest radikal ikame reaksiyonlarıdır.
En karakteristik reaksiyonların denklemlerini sunalım.
Halojenasyon:
$CH_4+Cl_2→CH_3Cl+HCl$.
Halojenin fazla olması durumunda, klorlama daha da ileri giderek tüm hidrojen atomlarının tamamen klor ile değiştirilmesine kadar gidebilir:
$CH_3Cl+Cl_2→HCl+(CH_2Cl_2)↙(\text"diklorometan (metilen klorür)")$,
$CH_2Cl_2+Cl_2→HCl+(CHСl_3)↙(\text"triklorometan(kloroform)")$,
$CHCl_3+Cl_2→HCl+(CCl_4)↙(\text"karbon tetraklorür(karbon tetraklorür)")$.
Ortaya çıkan maddeler, organik sentezlerde çözücüler ve başlangıç malzemeleri olarak yaygın şekilde kullanılmaktadır.
2. Dehidrojenasyon (hidrojenin ortadan kaldırılması). Alkanlar yüksek sıcaklıklarda ($400-600°C$) bir katalizör ($Pt, Ni, Al_2O_3, Cr_2O_3$) üzerinden geçirildiğinde, bir hidrojen molekülü elimine edilir ve bir alken oluşur:
$CH_3—CH_3→CH_2=CH_2+H_2$
3. Karbon zincirinin tahribatının eşlik ettiği reaksiyonlar. Tüm doymuş hidrokarbonlar yanıyor karbondioksit ve su oluşumu ile. Belirli oranlarda havayla karışan gaz halindeki hidrokarbonlar patlayabilir. Doymuş hidrokarbonların yanması, alkanları yakıt olarak kullanırken çok önemli olan serbest radikal bir ekzotermik reaksiyondur:
$СН_4+2О_2→СО_2+2Н_2O+880 kJ.$
Alkanların yanma reaksiyonları genel olarak şu şekilde yazılabilir:
$C_(n)H_(2n+2)+((3n+1)/(2))O_2→nCO_2+(n+1)H_2O$
Hidrokarbonların termal bölünmesi:
$C_(n)H_(2n+2)(→)↖(400-500°C)C_(n-k)H_(2(n-k)+2)+C_(k)H_(2k)$
Süreç serbest radikal mekanizması yoluyla gerçekleşir. Sıcaklıktaki bir artış, karbon-karbon bağının homolitik bölünmesine ve serbest radikallerin oluşumuna yol açar:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Bu radikaller birbirleriyle etkileşime girerek bir hidrojen atomu alışverişi yaparak bir alkan molekülü ve bir alken molekülü oluşturur:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Termal ayrışma reaksiyonları, endüstriyel hidrokarbon parçalama işleminin temelini oluşturur. Bu işlem petrol rafinasyonunun en önemli aşamasıdır.
Metan 1000°C$ sıcaklığa ısıtıldığında metan pirolizi başlar; basit maddelere ayrışma:
$CH_4(→)↖(1000°C)C+2H_2$
1500°C$ sıcaklığa ısıtıldığında asetilen oluşumu mümkündür:
$2CH_4(→)↖(1500°C)CH=CH+3H_2$
4. İzomerizasyon. Doğrusal hidrokarbonlar bir izomerizasyon katalizörü (alüminyum klorür) ile ısıtıldığında, dallanmış karbon iskeletine sahip maddeler oluşur:
5. Aromatizasyon. Zincirde altı veya daha fazla karbon atomu bulunan alkanlar, benzen ve türevlerini oluşturmak üzere bir katalizör varlığında siklikleşir:

Alkanların serbest radikal reaksiyonlarına girmelerinin nedeni nedir? Alkan moleküllerindeki tüm karbon atomları $sp^3$ hibridizasyon durumundadır. Bu maddelerin molekülleri, kovalent polar olmayan $C-C$ (karbon-karbon) bağları ve zayıf polar $C-H$ (karbon-hidrojen) bağları kullanılarak oluşturulur. Artmış veya azalmış elektron yoğunluğuna veya kolayca polarize olabilen bağlara sahip alanlar içermezler; bu tür bağlar, dış faktörlerin (elektrostatik iyon alanları) etkisi altında değişebilen elektron yoğunluğu. Sonuç olarak alkanlar yüklü parçacıklarla reaksiyona girmez çünkü Alkan moleküllerindeki bağlar heterolitik mekanizma tarafından kırılmaz.
Alkenler
Doymamışlar, moleküllerindeki karbon atomları arasında çoklu bağ içeren hidrokarbonları içerir. Sınırsız alkenler, alkadienler (polienler), alkinler. Halkada çift bağ içeren siklik hidrokarbonlar (sikloalkenler) ve ayrıca halkada az sayıda karbon atomu (üç veya dört atom) bulunan sikloalkanlar da doymamış bir karaktere sahiptir. Doymamışlığın özelliği, bu maddelerin doymuş veya doymuş hidrokarbonlar - alkanların oluşumu ile başta hidrojen olmak üzere ilave reaksiyonlara girme yeteneği ile ilişkilidir.
Alkenler, molekülde tekli bağlara ek olarak karbon atomları arasında bir çift bağ içeren ve $C_(n)H_(2n)$ genel formülüne karşılık gelen asiklik hidrokarbonlardır.
İkinci adı ise olefinler- alkenler, kalıntıları sıvı yağların - sıvı yağların (lat. yağ- yağ).
Homolog eten serisi
Dallanmamış alkenler, homolog eten (etilen) serisini oluşturur:
$С_2Н_4$ - eten, $С_3Н_6$ - propen, $С_4Н_8$ - büten, $С_5Н_(10)$ - penten, $С_6Н_(12)$ - heksen, vb.
İzomerizm ve isimlendirme
Alkanlar gibi alkenler de yapısal izomerlik ile karakterize edilir. Yapısal izomerler karbon iskeletinin yapısında birbirinden farklıdır. Yapısal izomerlerle karakterize edilen en basit alken bütendir:

Özel bir yapısal izomerizm türü, çift bağın konumunun izomerizmidir:
$CH_3—(CH_2)↙(büten-1)—CH=CH_2$ $CH_3—(CH=CH)↙(büten-2)—CH_3$
Tek bir karbon-karbon bağı etrafında karbon atomlarının neredeyse serbest dönüşü mümkündür, bu nedenle alkan molekülleri çok çeşitli şekiller alabilir. Çift bağın etrafında dönme imkansızdır, bu da alkenlerde başka bir tür izomerizmin ortaya çıkmasına neden olur - geometrik veya cis-trans izomerizm.

Cis- izomerler farklıdır trans izomerler, $π$ bağının düzlemine göre moleküler parçaların (bu durumda metil gruplarının) uzaysal düzenlemesine ve dolayısıyla özelliklerine göre belirlenir.
Alkenler sikloalkanlara izomerdir (sınıflar arası izomerizm), örneğin:

Alkenler için IUPAC isimlendirmesi alkanlarınkine benzer.
1. Ana devrenin seçilmesi.
Bir hidrokarbonun adlandırılması, moleküldeki en uzun karbon atomu zinciri olan ana zincirin tanımlanmasıyla başlar. Alkenlerde ana zincirde çift bağ bulunmalıdır.
2. Ana zincir atomlarının numaralandırılması.
Ana zincirdeki atomların numaralandırılması çift bağın en yakın olduğu uçtan başlar. Örneğin doğru bağlantı adı şöyledir:

Beklenebileceği gibi $2$-metilheksen-$4$ değil, $5$-metilheksen-$2$.
Çift bağın konumu zincirdeki atomların numaralandırmasının başlangıcını belirleyemezse, o zaman tıpkı doymuş hidrokarbonlarda olduğu gibi ikame edicilerin konumu tarafından belirlenir.

3. İsmin oluşumu.
Alkenlerin isimleri alkanların isimleriyle aynı şekilde oluşturulur. İsmin sonunda, çift bağın başladığı karbon atomunun numarasını ve bileşiğin alken sınıfına ait olduğunu gösteren bir son eki belirtin - -tr.
Örneğin:

Alkenlerin fiziksel ve kimyasal özellikleri
Fiziki ozellikleri. Homolog alken serisinin ilk üç temsilcisi gazlardır; $С_5Н_(10)$ - $С_(16)Н_(32)$ bileşimindeki maddeler - sıvılar; Daha yüksek alkenler katılardır.
Bileşiklerin moleküler ağırlığı arttıkça kaynama ve erime noktaları doğal olarak artar.
Kimyasal özellikler.
İlave reaksiyonları. Doymamış hidrokarbonların - alkenlerin temsilcilerinin ayırt edici bir özelliğinin ilave reaksiyonlara girme yeteneği olduğunu hatırlayalım. Bu reaksiyonların çoğu şu mekanizmaya göre ilerlemektedir:
1. Alkenlerin hidrojenasyonu. Alkenler, hidrojenasyon katalizörleri, metaller - platin, paladyum, nikel varlığında hidrojen ekleme yeteneğine sahiptir:
$CH_3—CH_2—CH=CH_2+H_2(→)↖(Pt)CH_3—CH_2—CH_2—CH_3$.
Bu reaksiyon atmosferik ve yüksek basınçta meydana gelir ve yüksek sıcaklık gerektirmez, çünkü ekzotermiktir. Sıcaklık yükseldiğinde, aynı katalizörler ters bir reaksiyona (dehidrojenasyon) neden olabilir.
2. Halojenasyon (halojenlerin eklenmesi). Bir alkenin bromlu su veya organik bir çözücü ($CCl_4$) içindeki bir brom çözeltisi ile etkileşimi, alkene bir halojen molekülünün eklenmesi ve dihalojen alkanların oluşması sonucunda bu çözeltilerin hızlı renk değiştirmesine yol açar:
$CH_2=CH_2+Br_2→CH_2Br—CH_2Br$.
3.
$CH_3-(CH)↙(propen)=CH_2+HBr→CH_3-(CHBr)↙(2-bromopropen)-CH_3$
Bu reaksiyon itaat eder Markovnikov'un kuralı:
Bir alkene bir hidrojen halojenür eklendiğinde, hidrojen daha fazla hidrojenlenmiş karbon atomuna eklenir; daha fazla hidrojen atomunun bulunduğu atom ve halojenden daha az hidrojenlenmiş olana.
Alkenlerin hidrasyonu alkol oluşumuna yol açar. Örneğin, etene su eklenmesi, etil alkol üretimine yönelik endüstriyel yöntemlerden birinin temelini oluşturur:
$(CH_2)↙(eten)=CH_2+H_2O(→)↖(t,H_3PO_4)CH_3-(CH_2OH)↙(etanol)$
Birincil alkolün (birincil karbon üzerinde bir hidrokso grubu bulunan) yalnızca eten hidratlandığında oluştuğunu unutmayın. Propen veya diğer alkenler hidratlandığında ikincil alkoller oluşur.

Bu reaksiyon aynı zamanda Markovnikov kuralına göre de ilerler - bir hidrojen katyonu daha fazla hidrojenlenmiş bir karbon atomuna, bir hidrokso grubu daha az hidrojenlenmiş bir karbon atomuna bağlanır.
5. Polimerizasyon.Özel bir ekleme durumu, alkenlerin polimerizasyon reaksiyonudur:
$nCH_2(=)↙(eten)CH_2(→)↖(UV ışığı, R)(...(-CH_2-CH_2-)↙(polietilen)...)_n$
Bu ekleme reaksiyonu serbest radikal mekanizması yoluyla gerçekleşir.
6. Oksidasyon reaksiyonu.
Herhangi bir organik bileşik gibi, alkenler de oksijende yanarak $СО_2$ ve $Н_2О$ oluşturur:
$СН_2=СН_2+3О_2→2СО_2+2Н_2О$.
Genel olarak:
$C_(n)H_(2n)+(3n)/(2)O_2→nCO_2+nH_2O$
Çözeltilerdeki oksidasyona dirençli alkanların aksine alkenler, potasyum permanganat çözeltileri tarafından kolayca oksitlenir. Nötr veya alkalin çözeltilerde, alkenler diollere (dihidrik alkoller) oksitlenir ve oksidasyondan önce aralarında bir çift bağın bulunduğu atomlara hidroksil grupları eklenir:

Alkadienler (dien hidrokarbonlar)
Alkadienler, molekülde tekli bağların yanı sıra karbon atomları arasında iki çift bağ içeren ve $C_(n)H_(2n-2)$ genel formülüne karşılık gelen asiklik hidrokarbonlardır.
Çift bağların göreceli düzenine bağlı olarak üç tip dien ayırt edilir:
- alkadienler ile kümülatifçift bağların düzenlenmesi:
- alkadienler ile konjugeçift bağlar;
$CH_2=CH—CH=CH_2$;
- alkadienler ile yalıtılmışçift bağlar
$CH_2=CH—CH_2—CH=CH_2$.
Bu üç tip alkadien, yapı ve özellikler bakımından birbirinden önemli ölçüde farklılık gösterir. Alkadienlerde kümülatif bağlara sahip merkezi karbon atomu (iki çift bağ oluşturan atom) $sp$-hibridizasyon durumundadır. Aynı çizgi üzerinde bulunan ve zıt yönlere doğru uzanan iki $σ$-bağı ve birbirine dik düzlemlerde bulunan iki $π$-bağı oluşturur. $π$-Bağlar, her karbon atomunun melezleşmemiş p-orbitalleri nedeniyle oluşur. İzole edilmiş çift bağa sahip alkadienlerin özellikleri çok spesifiktir çünkü eşlenik $π$ bağları birbirini önemli ölçüde etkiler.
Konjuge $π$-bağlarını oluşturan p-orbitalleri pratik olarak tek bir sistem oluşturur (buna $π$-sistemi denir), çünkü Komşu $π$ bağlarının p-orbitalleri kısmen örtüşüyor.
İzomerizm ve isimlendirme
Alkadienler hem yapısal izomerizm hem de cis-, trans-izomerizm ile karakterize edilir.
Yapısal izomerizm.
— karbon iskelet izomerizmi:

— çoklu bağların konumunun izomerizmi:
$(CH_2=CH—CH=CH_2)↙(butadien-1,3)$ $(CH_2=C=CH—CH_3)↙(butadien-1,2)$
Cis-, trans- izomerizm (uzaysal ve geometrik)
Örneğin:
Alkadienler, alkinler ve sikloalkenler sınıfının izomerik bileşikleridir.
Bir alkadienin adını oluştururken çift bağların sayısı belirtilir. Ana zincir mutlaka iki çoklu bağ içermelidir.
Örneğin:

Alkadienlerin fiziksel ve kimyasal özellikleri
Fiziki ozellikleri.
Normal koşullar altında propandien-1,2, bütadien-1,3 gaz, 2-metilbutadien-1,3 ise uçucu bir sıvıdır. İzole edilmiş çift bağa sahip alkadienler (bunlardan en basiti pentadien-1,4'tür) sıvıdır. Daha yüksek dienler katılardır.
Kimyasal özellikler.
İzole edilmiş çift bağa sahip alkadienlerin kimyasal özellikleri alkenlerin özelliklerinden çok az farklıdır. Konjuge bağlı alkadienlerin bazı özel özellikleri vardır.
1. İlave reaksiyonları. Alkadienler hidrojen, halojenler ve hidrojen halojenürler ekleme yeteneğine sahiptir.
Konjuge bağlarla alkadienlere ilavenin özel bir özelliği, moleküllerin hem 1 ve 2 pozisyonlarına hem de 1 ve 4 pozisyonlarına eklenebilmesidir.

Ürünlerin oranı, karşılık gelen reaksiyonların gerçekleştirilme koşullarına ve yöntemine bağlıdır.
2.Polimerizasyon reaksiyonu. Dienlerin en önemli özelliği katyonların veya serbest radikallerin etkisi altında polimerleşebilme yeteneğidir. Bu bileşiklerin polimerizasyonu sentetik kauçukların temelini oluşturur:
$nCH_2=(CH—CH=CH_2)↙(bütadien-1,3)→((... —CH_2—CH=CH—CH_2— ...)_n)↙(\text"sentetik bütadien kauçuk")$ .
Konjuge dienlerin polimerizasyonu 1,4 ilavesi şeklinde ilerler.
Bu durumda, çift bağın ünitede merkezi olduğu ortaya çıkar ve temel ünite de her ikisini de üstlenebilir. cis-, Bu yüzden trans konfigürasyon

Alkinler
Alkinler, molekülde tekli bağlara ek olarak karbon atomları arasında bir üçlü bağ içeren ve $C_(n)H_(2n-2)$ genel formülüne karşılık gelen asiklik hidrokarbonlardır.
Homolog etin serisi
Düz zincirli alkinler, homolog etin (asetilen) serisini oluşturur:
$С_2Н_2$ - etin, $С_3Н_4$ - propin, $С_4Н_6$ - bütin, $С_5Н_8$ - pentin, $С_6Н_(10)$ - heksin, vb.
İzomerizm ve isimlendirme
Alkinler, alkenler gibi yapısal izomerizmle karakterize edilir: karbon iskeletinin izomerliği ve çoklu bağın konumunun izomerliği. Alkin sınıfının çoklu bağ pozisyonunun yapısal izomerleri ile karakterize edilen en basit alkin, bütindir:
$СН_3—(СН_2)↙(butine-1)—С≡СН$ $СН_3—(С≡С)↙(butine-2)—СН_3$
Alkinlerde karbon iskeletinin izomerizmi pentin ile başlayarak mümkündür:

Üçlü bir bağ karbon zincirinin doğrusal bir yapısını varsaydığından geometrik ( cis-, trans-) alkinler için izomerizm imkansızdır.
Bu sınıftaki hidrokarbon moleküllerinde üçlü bağın varlığı son ek ile yansıtılmaktadır. -içinde ve zincirdeki konumu karbon atomunun sayısıdır.
Örneğin:

Diğer bazı sınıfların bileşikleri alkinlere izomerdir. Dolayısıyla, $C_6H_(10)$ kimyasal formülü heksin (alkin), heksadien (alkadien) ve sikloheksen (sikloalken) içerir:

Alkinlerin fiziksel ve kimyasal özellikleri
Fiziki ozellikleri. Alkinlerin ve alkenlerin kaynama ve erime noktaları, bileşiklerin moleküler ağırlığının artmasıyla doğal olarak artar.
Alkinlerin kendine has bir kokusu vardır. Suda alkan ve alkenlere göre daha fazla çözünürler.
Kimyasal özellikler.
İlave reaksiyonları. Alkinler doymamış bileşiklerdir ve katılma reaksiyonlarına girerler. Çoğunlukla tepkiler elektrofilik ekleme.
1. Halojenasyon (bir halojen molekülünün eklenmesi). Bir alkin iki halojen molekülünü (klor, brom) bağlayabilir:
$CH≡CH+Br_2→(CHBr=CHBr)↙(1,2-dibromoetan),$
$CHBr=CHBr+Br_2→(CHBr_2-CHBr_2)↙(1,1,2,2-tetrabromoetan)$
2. Hidrohalojenasyon (hidrojen halojenürün eklenmesi). Elektrofilik bir mekanizma aracılığıyla meydana gelen hidrojen halojenürün katılma reaksiyonu da iki aşamada gerçekleşir ve her iki aşamada da Markovnikov kuralı sağlanır:
$CH_3-C≡CH+Br→(CH_3-CBr=CH_2)↙(2-bromopropen),$
$CH_3-CBr=CH_2+HBr→(CH_3-CHBr_2-CH_3)↙(2,2-dibromopropan)$
3. Hidrasyon (su ilavesi). Ketonların ve aldehitlerin endüstriyel sentezi için büyük önem taşıyan su ekleme reaksiyonu (hidrasyon) olarak adlandırılır. Kucherov'un tepkisi:
4. Alkinlerin hidrojenasyonu. Alkinler, metal katalizörlerin ($Pt, Pd, Ni$) varlığında hidrojen ekler:
$R-C≡C-R+H_2(→)↖(Pt)R-CH=CH-R,$
$R-CH=CH-R+H_2(→)↖(Pt)R-CH_2-CH_2-R$
Üçlü bağ iki reaktif $π$ bağı içerdiğinden, alkanlar adım adım hidrojen ekler:
1) trimerizasyon.
Etin aktif karbon üzerinden geçirildiğinde, biri benzen olan bir ürün karışımı oluşur:

2) dimerizasyon.
Asetilenin trimerizasyonuna ek olarak dimerizasyonu da mümkündür. Tek değerlikli bakır tuzlarının etkisi altında vinil asetilen oluşur:
$2HC≡CH→(HC≡C-CH=CH_2)↙(\text"büten-1-in-3(vinilasetilen)")$
Bu madde kloropren üretmek için kullanılır:
$HC≡C-CH=CH_2+HCl(→)↖(CaCl)H_2C=(CCl-CH)↙(kloropren)=CH_2$
kloropren kauçuğun elde edildiği polimerizasyon ile:
$nH_2C=CCl-CH=CH_2→(...-H_2C-CCl=CH-CH_2-...)_n$
Alkinlerin oksidasyonu.
Etin (asetilen) oksijende yanarak çok büyük miktarda ısı açığa çıkarır:
$2C_2H_2+5O_2→4CO_2+2H_2O+2600kJ$ Oksijen-asetilen torçunun hareketi, alevi çok yüksek bir sıcaklığa (3000$°C$'ın üzerinde) sahip olan ve kesme için kullanılmasına olanak tanıyan bu reaksiyona dayanmaktadır. ve metallerin kaynaklanması.
Asetilen havada dumanlı bir alevle yanar, çünkü molekülündeki karbon içeriği etan ve eten moleküllerinden daha yüksektir.
Alkinler, alkenler gibi, asitleştirilmiş potasyum permanganat çözeltilerinin rengini bozar; Bu durumda çoklu bağ bozulur.
Organik kimyada iyonik (V.V. Markovnikov kuralı) ve radikal reaksiyon mekanizmaları
Organik kimyada kimyasal reaksiyon türleri
Organik maddelerin reaksiyonları resmi olarak dört ana türe ayrılabilir: ikame, ekleme, eliminasyon (eliminasyon) ve yeniden düzenleme (izomerizasyon). Organik bileşiklerin çeşitli reaksiyonlarının tamamının önerilen sınıflandırmaya (örneğin yanma reaksiyonları) indirgenemeyeceği açıktır. Bununla birlikte, böyle bir sınıflandırma, inorganik kimya dersinden zaten aşina olduğunuz inorganik maddeler arasında meydana gelen reaksiyonlarla analojiler kurmaya yardımcı olacaktır.
Tipik olarak, bir reaksiyonda yer alan ana organik bileşiğe substrat adı verilir ve reaksiyonun diğer bileşeni geleneksel olarak reaktan olarak kabul edilir.
İkame reaksiyonları
Orijinal moleküldeki (substrat) bir atomun veya atom grubunun başka atom veya atom gruplarıyla değiştirilmesiyle sonuçlanan reaksiyonlara ikame reaksiyonları denir.
İkame reaksiyonları alkanlar, sikloalkanlar veya arenler gibi doymuş ve aromatik bileşikleri içerir.
Bu tür reaksiyonlara örnekler verelim.
Işığın etkisi altında, metan molekülündeki hidrojen atomlarının yerini halojen atomları, örneğin klor atomları alabilir:
$CH_4+Cl_2→CH_3Cl+HCl$
Hidrojeni halojenle değiştirmenin başka bir örneği benzenin bromobenzene dönüştürülmesidir:

Bu reaksiyonun denklemi farklı şekilde yazılabilir:

Bu gösterim biçiminde reaktifler, katalizör ve reaksiyon koşulları okun üstüne, inorganik reaksiyon ürünleri de onun altına yazılır.
İlave reaksiyonları
İki veya daha fazla reaksiyona giren madde molekülünün bir araya gelerek oluşturduğu reaksiyonlara katılma reaksiyonları denir.
Alkenler veya alkinler gibi doymamış bileşikler ilave reaksiyonlarına girer.
Hangi molekülün reaktif olarak görev yaptığına bağlı olarak, hidrojenasyon (veya indirgeme), halojenasyon, hidrohalojenasyon, hidrasyon ve diğer ekleme reaksiyonları ayırt edilir. Her biri belirli koşulları gerektirir.
1. Hidrojenasyon- çoklu bağ yoluyla bir hidrojen molekülünün eklenmesi reaksiyonu:
$CH_3(-CH=)↙(\text"propene")CH_2+H_2(→)↖(Pt)CH_3(-CH_2-)↙(\text"propan")-CH_3$
2.Hidrohalojenasyon- hidrojen halojenür ekleme reaksiyonu (hidroklorlama):
$(CH_2=)↙(\text"eten")CH_2+HCl→CH_3(-CH_2-)↙(\text"kloroetan")-Cl$
3.Halojenasyon- halojen ekleme reaksiyonu:
$(CH_2=)↙(\text"eten")CH_2+Cl_2→(CH_2Cl-CH_2Cl)↙(\text"1.2-dikloroetan")$
4. Polimerizasyon- küçük moleküler ağırlığa sahip bir maddenin moleküllerinin, çok yüksek moleküler ağırlığa sahip bir maddenin moleküllerini oluşturmak üzere birbirleriyle birleştiği özel bir tür katılma reaksiyonu - makro moleküller.
Polimerizasyon reaksiyonları, düşük molekül ağırlıklı bir maddenin (monomer) birçok molekülünün bir polimerin büyük molekülleri (makromolekülleri) halinde birleştirilmesi işlemleridir.
Bir polimerizasyon reaksiyonunun bir örneği, ultraviyole radyasyonun ve bir radikal polimerizasyon başlatıcısının etkisi altında etilenden (eten) polietilen üretimidir $R:$
$(nCH_2=)↙(\text"eten")CH_2(→)↖(\text"UV ışığı, R")((...-CH_2-CH_2-...)_n)↙(\text" polietilen ")$
Organik bileşiklerin en karakteristik özelliği olan kovalent bağ, atomik yörüngeler örtüştüğünde ve paylaşılan elektron çiftleri oluştuğunda oluşur. Bunun sonucunda iki atom için ortak bir elektron çiftinin yer aldığı bir yörünge oluşur. Bir bağ koptuğunda, bu paylaşılan elektronların kaderi farklı olabilir.
Organik kimyada reaktif parçacık türleri
Bir atoma ait eşlenmemiş elektrona sahip bir yörünge, yine eşlenmemiş bir elektron içeren başka bir atomun yörüngesiyle örtüşebilir. Bu durumda kovalent bağ oluşur. değişim mekanizması:
$H + H→H:H,$ veya $H-H$
Değişim mekanizması Kovalent bağ oluşumu, farklı atomlara ait eşleşmemiş elektronlardan ortak bir elektron çifti oluşması durumunda gerçekleşir.
Değişim mekanizmasıyla kovalent bağ oluşumunun tersi olan süreç, her atoma bir elektronun kaybolduğu bağın bölünmesidir. Bunun sonucunda eşlenmemiş elektronlara sahip iki yüksüz parçacık oluşur:
Bu tür parçacıklara denir serbest radikaller.
Serbest radikaller- eşlenmemiş elektronlara sahip atomlar veya atom grupları.
Serbest radikallerin etkisi altında ve katılımıyla meydana gelen reaksiyonlara serbest radikal reaksiyonları denir.
İnorganik kimya dersinde bunlar hidrojenin oksijen, halojenler ve yanma reaksiyonları ile reaksiyonlarıdır. Lütfen bu tür reaksiyonların yüksek hız ve büyük miktarda ısı salınımı ile karakterize edildiğini unutmayın.
Verici-alıcı mekanizmasıyla da kovalent bir bağ oluşturulabilir. Yalnız bir elektron çifti içeren bir atomun (veya anyonun) yörüngelerinden biri, boş bir yörüngeye sahip başka bir atomun (veya katyonun) boş bir yörüngesi ile örtüşür ve bir kovalent bağ oluşur, örneğin:
$H^(+)+(:O-H^(-))↙(\text"alıcı")→(H-O-H)↙(\text"bağışçı")$
Kovalent bir bağın kırılması, pozitif ve negatif yüklü türlerin oluşmasına neden olur; bu durumda ortak bir elektron çiftindeki her iki elektron da atomlardan birinde kaldığından, ikinci atomun doldurulmamış bir yörüngesi vardır:
$R:|R=R:^(-)+R^(+)$
Asitlerin elektrolitik ayrışmasını ele alalım:
$H:|Cl=H^(+)+Cl^(-)$
Yalnız elektron çifti $R:^(-)$'ye sahip bir parçacığın, yani negatif yüklü bir iyonun, pozitif yüklü atomlar veya üzerinde en azından kısmi veya etkili bir pozitif yük bulunan atomlar tarafından çekileceği kolayca tahmin edilebilir. Yalnız elektron çifti taşıyan parçacıklara denir nükleofilik ajanlar (çekirdek- çekirdek, atomun pozitif yüklü kısmı), yani çekirdeğin “arkadaşları”, pozitif yük.
Nükleofiller ($Nu$)- moleküllerin etkili bir pozitif yüke sahip kısımlarıyla etkileşime giren yalnız bir elektron çiftine sahip anyonlar veya moleküller.
Nükleofil örnekleri: $Cl^(-)$ (klorür iyonu), $OH^(-)$ (hidroksit anyonu), $CH_3O^(-)$ (metoksit anyonu), $CH_3COO^(-)$ ( asetat anyonu ).
Doldurulmamış bir yörüngeye sahip parçacıklar ise tam tersine, onu doldurma eğiliminde olacak ve dolayısıyla moleküllerin artan elektron yoğunluğuna, negatif yüke ve yalnız elektron çiftine sahip kısımları tarafından çekilecektir. Bunlar elektrofiller, elektronun "arkadaşları", negatif yük veya elektron yoğunluğu artan parçacıklardır.
Elektrofiller- doldurulmamış bir elektron yörüngesine sahip olan ve onu elektronlarla doldurma eğiliminde olan katyonlar veya moleküller, çünkü bu, atomun daha uygun bir elektronik konfigürasyonuna yol açar.
Elektrofil örnekleri: $NO_2$ (nitro grubu), -$COOH$ (karboksil), -$CN$ (nitril grubu), -$SON$ (aldehit grubu).
Doldurulmamış bir yörüngeye sahip her parçacık bir elektrofil değildir. Örneğin alkali metal katyonları inert gaz konfigürasyonuna sahiptir ve düşük elektron ilgisine sahip olduklarından elektron alma eğiliminde değildirler. Bundan, doldurulmamış bir yörüngenin varlığına rağmen, bu tür parçacıkların elektrofil olmayacağı sonucuna varabiliriz.
Temel reaksiyon mekanizmaları
Üç ana reaksiyona giren tür türünü (serbest radikaller, elektrofiller, nükleofiller) ve bunlara karşılık gelen üç reaksiyon mekanizması türünü belirledik:
- serbest radikal;
- elektrofilik;
- nükleofilik.
Reaksiyona giren parçacıkların türüne göre reaksiyonları sınıflandırmanın yanı sıra, organik kimyada moleküllerin bileşimini değiştirme ilkesine dayanan dört tip reaksiyon vardır: ekleme, ikame, ayırma veya eliminasyon (Lat. ortadan kaldırmak- kaldırma, bölme) ve yeniden düzenlemeler. Ekleme ve ikame, her üç tip reaktif türün etkisi altında meydana gelebildiğinden, birkaç temel reaksiyon mekanizması ayırt edilebilir.
1.Serbest radikal ikamesi:
$(CH_4)↙(\text"metan")+Br_2(→)↖(\text"UV ışığı")(CH_3Br)↙(\text"bromometan")+HBr$
2. Serbest radikal ilavesi:
$nCH_2=CH_2(→)↖(\text"UV ışığı,R")(...-CH_2-CH_2-...)_n$
3. Elektrofilik ikame:

4. Elektrofilik bağlantı:
$CH_3-(CH=)↙(\text"propene")CH_2+HBr(→)↖(\text"çözüm")(CH_3-CHBr-CH_3)↙(\text"2-bromopropan")$
$CH_3(-C≡)↙(\text"propin")CH+Cl_2(→)↖(\text"çözelti")(CH_3-CCl=CHCl)↙(\text"1,2-dikloropropen")$
5. Nükleofilik ekleme:

Ek olarak, nükleofilik parçacıkların - bazların etkisi altında meydana gelen eliminasyon reaksiyonlarını da ele alacağız.
6. Eliminasyon:
$СH_3-CHBr-CH_3+NaOH(→)↖(\text"alkol çözeltisi")CH_3-CH=CH_2+NaBr+H_2O$
V.V. Markovnikov'un kuralı
Alkenlerin (doymamış hidrokarbonlar) ayırt edici bir özelliği, katılma reaksiyonlarına girebilme yetenekleridir. Bu reaksiyonların çoğu şu mekanizmaya göre ilerlemektedir: elektrofilik ekleme.
Hidrohalojenasyon (hidrojen halojen eklenmesi):
$СH_3(-CH-)↙(\text"propene")CH_2+HBr→CH_3(-CHBr-CH_3)↙(\text"2-bromopropane")$
Bu reaksiyon itaat eder V.V. Markovnikov'un kuralı: Bir alkene bir hidrojen halojenür eklendiğinde, daha fazla hidrojenlenmiş karbon atomuna hidrojen eklenir; daha fazla hidrojen atomunun bulunduğu atom ve halojenden daha az hidrojenlenmiş olana.
) başka bir kimyasal bileşiğin bağları. Bağlantı, bağlantı yoluyla gerçekleştirilebilir karbon-karbon ve iletişim yoluyla karbon heteroatomu. İlave reaksiyonları İngilizce harflerle gösterilir "Reklam".
Bağ katılma reaksiyonlarına genel bakış karbon-karbon:
Bağ katılma reaksiyonlarına genel bakış karbon-oksijen:
Tipik olarak, eklemenin gerçekleştiği reaktife denir alt tabaka, ve diğer ( "X-Y") - saldıran reaktif.
Ekleme reaksiyonunun bir örneği etilenin brominasyonudur:

Ekleme reaksiyonları, eliminasyon reaksiyonları ile eşleştirildiğinde sıklıkla tersine çevrilebilir, dolayısıyla böyle bir "eşleştirilmiş" ekleme-eliminasyon reaksiyonunun mekanizmasının genel olduğu akılda tutulmalıdır.
Saldıran parçacığın doğasına ve reaksiyon mekanizmasına bağlı olarak nükleofilik, elektrofilik, radikal veya senkronize ekleme ayırt edilir.
Nükleofilik katılma reaksiyonları
Nükleofilik katılma reaksiyonlarında saldıran parçacık bir nükleofildir, yani negatif yüklü bir parçacık veya serbest elektron çiftine sahip bir parçacıktır.
Nükleofilik katılma reaksiyonlarına genel bakış:
Nükleofilik katılma reaksiyonları belirlenir "Reklam N".
Nükleofilik bağ katılma reaksiyonları C=C oldukça nadirdir, en yaygın ve pratik önemi iletişim yoluyla bağlantı kurmaktır C=O :
Nükleofilik katılma reaksiyonları arasında yukarıdaki iki aşamalı bimoleküler mekanizma en yaygın olanıdır. Reklam N 2: İlk olarak, nükleofil çoklu bağ boyunca yavaş yavaş eklenerek bir karbanyon oluşturur, ikinci aşamada ise elektrofilik türler tarafından hızla saldırıya uğrar.
Elektrofilik katılma reaksiyonları
Elektrofilik katılma reaksiyonlarında saldıran parçacık elektrofil yani pozitif yüklü bir parçacık, çoğunlukla bir proton H+ veya elektron eksikliği olan bir parçacık.
Elektrofilik katılma reaksiyonlarına genel bakış:
Elektrofilik katılma reaksiyonları belirlenir "Reklam E".
Doymamış hidrokarbonlar arasında elektrofilik katılma reaksiyonları yaygındır: alkenler, alkinler ve dienler.
Bu tür reaksiyonlara bir örnek alkenlerin hidrasyonudur:
Elektrofilik bağlanma karbon heteroatomu aynı zamanda oldukça yaygındır ve çoğu zaman böyle bir bağlantı C=O:



Elektrofilik katılma reaksiyonları arasında yukarıdaki iki aşamalı bimoleküler mekanizma en yaygın olanıdır. Reklam E 2: İlk olarak, elektrofil, ikinci aşamada nükleofilik saldırıya uğrayan bir karbokatyon oluşturmak için çoklu bir bağda yavaş yavaş eklenir.
Radikal katılma reaksiyonları
Radikal katılma reaksiyonlarında saldıran parçacık serbest radikallerdir.
Radikal katılma reaksiyonları belirlenir "Reklam R".
Serbest radikal kaynağının varlığında elektrofilik katılma reaksiyonları yerine genellikle radikal katılma reaksiyonları meydana gelir:

Senkron birleştirme reaksiyonları
Bazı durumlarda çoklu bağ yoluyla birleşme, her iki atoma da eş zamanlı saldırıyla gerçekleşir ve bu da saldırının önceliğinin belirlenmesini imkansız hale getirir. Bu mekanizmaya denir senkron bağlantı. Eşzamanlı katılma reaksiyonları döngüsel ürünlerin oluşumuna yol açar, bu yüzden bunlara sıklıkla denir. siklo katılma.
Notlar
| Organik kimyada kimyasal reaksiyonlar | |
|---|---|
| İkame reaksiyonları | Nükleofilik ikame reaksiyonları Elektrofilik ikame reaksiyonları Radikal ikame reaksiyonları |
| İlave reaksiyonları | Nükleofilik katılma reaksiyonları Elektrofilik katılma reaksiyonları Radikal katılma reaksiyonları Senkronize katılma reaksiyonları |
| Eliminasyon reaksiyonları | Heterolitik eliminasyon reaksiyonları Perisiklik eliminasyon reaksiyonları Radikal eliminasyon reaksiyonları |
| Reaksiyonların yeniden gruplandırılması | Nükleofilik yeniden düzenlemeler Elektrofilik yeniden düzenlemeler Radikal yeniden düzenlemeler |
| Oksidasyon ve redüksiyon reaksiyonları | Oksidasyon reaksiyonları İndirgenme reaksiyonları |
| Diğer | Organik kimyada adlandırılmış reaksiyonlar |
Wikimedia Vakfı. 2010.
Diğer sözlüklerde "Ekleme reaksiyonları"nın ne olduğuna bakın:
ekleme reaksiyonuyla üretilen polimer- — EN ilave polimeri Olefinler gibi doymamış monomer moleküllerinin, su gibi bir yan ürün oluşmadan birbirlerine zincir halinde eklenmesiyle oluşan bir polimer;… … Teknik Çevirmen Kılavuzu
- (İngilizce ekleme elektrofilik reaksiyonu) başlangıç aşamasındaki saldırının pozitif yüklü veya elektron eksikliği olan bir elektrofil parçacık tarafından gerçekleştirildiği ekleme reaksiyonları. Son aşamada ortaya çıkan sonuç... ... Vikipedi
- (İngilizce ekleme nükleofilik reaksiyonu) başlangıç aşamasındaki saldırının, negatif yüklü veya serbest bir elektron çiftine sahip bir nükleofil parçacığı tarafından gerçekleştirildiği ekleme reaksiyonları. Son aşamada ortaya çıkan sonuç... ... Vikipedi
- (İngilizce ekleme radikal reaksiyonu) saldırının serbest radikaller, bir veya daha fazla eşleşmemiş elektron içeren parçacıklar tarafından gerçekleştirildiği ekleme reaksiyonları. Aynı zamanda radikaller hem diğer radikallere hem de... ... Vikipedi'ye saldırabilirler.
Çoklu bağın her iki atomunun aynı anda saldırıya uğradığı katılma reaksiyonları. Bu tür reaksiyonların bir diğer adı siklokatılma reaksiyonudur çünkü bu tür reaksiyonların son ürünü siklik substratlardır. İki tane var... ... Vikipedi
- (İng. nükleofilik ikame reaksiyonu) saldırının, yalnız bir elektron çifti taşıyan bir nükleofilik reaktif tarafından gerçekleştirildiği ikame reaksiyonları. Nükleofilik yer değiştirme reaksiyonlarında ayrılan gruba nükleofüj adı verilir. Herşey... Vikipedi
Hidrokarbonlar
13 Nolu Ders
Bir alkinin hidrasyonu sırasında oluşan enol izole edilemez çünkü tautomerik denge her zaman güçlü bir şekilde keto formuna doğru kayar.
Enolün keto formuna yeniden düzenlenmesi, O-H bağının yüksek polaritesinden dolayı meydana gelir ve bu, hidroksil grubunun protonunun kolayca çıkarılmasına yol açar.
Proton daha sonra ya enolat anyonun oksijenine ya da karbona geri bağlanabilir. Bir karbon atomuna bağlanırsa protonun belirgin bir ayrışma eğilimi göstermediği daha az asidik bir bileşik oluşur. Keto formu reaksiyon karışımında bu şekilde birikmektedir.
Kucherov reaksiyonunda bir aldehitin oluştuğu tek bir durum vardır - asetilenin hidrasyonu. Diğer tüm reaksiyonlar keton üretir.
Propinin hidrasyonu propiyonaldehit yerine asetona neden olur.
Nükleofilik katılma reaksiyonları. Alkinler, bir katalizör varlığında nükleofilik reaktifler ekleme yeteneğine sahiptir. Sonuç olarak farklı sınıflara ait vinil türevleri oluşur. Bu reaksiyonlara vinilasyon reaksiyonları denir.
Alkinlere bazı nükleofilik katılma reaksiyonları yukarıda gösterilmiştir. Genellikle BMC sentezinde monomer görevi gören bileşiklerin hazırlanmasında kullanılırlar. Örneğin asetilenin reaksiyonu N-butanol, polimerizasyonuyla bütil vinil etere yol açar. vinilin (Shostakovsky melisa) değerli bir ilaçtır.
Oksidasyon. Çoklu karbon-karbon bağları içeren tüm organik bileşikler gibi alkinler de, potasyum permanganat veya potasyum dikromat gibi çeşitli oksitleyici maddeler tarafından kolayca oksitlenir. Reaksiyon, üçlü bağın tamamen bölünmesi ve karboksilik asitlerin oluşmasıyla ilerler (terminal üçlü bağa sahip alkinler, karboksilik asit ve karbon dioksit oluşturur).
Bu reaksiyonlar alkinlerin yapısını belirlemek için kullanılabilir.
Selenyum dioksit gibi bazı oksitleyici maddeler alkinlerin seçici oksidasyonuna izin verir ve bu sırada yalnızca p-bağları ayrılır. Bu durumda, iki ikameli alkinler a-diketonlara, tek ikameli alkinler ise a-keto asitlere dönüştürülür.
Alkinlerin polimerizasyonu. Alkin serisinde en çok ilgi duyulan reaksiyonlar di-, trimerizasyon ve siklotri- ve siklotetramerizasyondur.
Endüstriyel önemi büyük olan asetilenin doğrusal di- ve trimerleri, tek değerlikli bakır tuzlarının varlığında elde edilebilir.
Vinilasetilen, polimerizasyonu kloropren kauçuğu üreten kloropren (2-klorobutadien-1,3) sentezi için başlangıç bileşiğidir.
Asetilenin benzene dönüşen siklotrimerizasyonu 1866'da M. Berthelot tarafından keşfedildi ve N.D. Zelinsky ve B.A. Kazansky (1922).
Siklotetramerizasyon W. Reppe (1949) tarafından keşfedilmiştir.
; bu durumda bir p-bağı kırılır ve bir veya iki s-bağı oluşur. Katılmayı belirtmek için reaksiyonlar Reklam sembolünü kullanın (İngilizce ekten - katılımdan); Döngüsel eklemeler için böyle bir sembol kullanılmaz.
Doğaya bağlı olarak alt tabaka katılımlar arasında ayrım yapmak reaksiyonlar izole edilmiş veya birleştirilmiş çoklu bağlar, örneğin: C=C, C=C, C=C-C=C, C=O, C=N, C=N. Homolitik çözümler vardır. (Ad R) ve heterolitik. katılım. İkincisi saldırganın suçlamasına bağlıdır reaktif elektrof ilçelere ayrılmıştır. (Reklam E) ve nükleof. (Reklam N)ekler. Davranış reaktif türüne bağlıdır alt tabaka ve r-yonun gerçekleştirilmesine ilişkin koşullar (r-ikamet eden, mevcudiyet katalizör, UV ışınımının etkisi vb.). Mn. reaktifler farklı koşullar altında farklı özellikler sergileyebilir reaksiyon türleri yetenekler, örneğin. halojenler radikal, elektrof gibi davranabilir. ve hatta nükleof. ajanlar.
Naib. incelenen katılımlar reaksiyonlarİle çoklu bağlar karbon-karbon. Bu süreçler aşamalı (aşamalı) veya senkronize (koordineli) bir mekanizmaya göre ilerlemektedir. Kademeli bir mekanizma ile ilk aşama, bir nükleofilin, elektrofilin veya serbest bir maddenin saldırısıdır. radikal, ikinci - rekombinasyon sonuçta orta seviye olumlu, olumsuz veya nötr bir parçacık, örneğin:
Elektrof. veya nükleof. parçacıkların olması gerekmez iyonlar; elektron çeken veya elektron veren bir kısım (grup) olabilirler moleküller. Ad N reaksiyonları yalnızca elektron çekici ikame ediciler tarafından aktive edilen C=C bağları ile mümkündür; Ad E'yi uygulamak için, ya ikame edilmemiş C=C bağlarına ya da elektron veren ikame ediciler tarafından aktive edilmiş olanlara ihtiyaç vardır. AdR çözümü için C=C bağındaki ikame edicinin doğası büyük önem taşımaz.
Stereokimya. Aşamalı eklemenin sonucu reaksiyonun mekanizmasına ve reaksiyona giren bileşiklerin doğasına bağlıdır. Evet, elektrof. birleştirme olefinler bir oğul eki olarak ilerleyebilir - Y ve W parçacıkları saldırır molekül uçağın bir tarafında çift bağ veya bağlanma karşıtı olarak - parçacıklar düzlemin farklı taraflarından saldırır; bazı durumlarda reaksiyonlar stereospesifik değildir. Çekirdek. katılımla katılım karbanyonlar kural olarak stereospesifik olmayan bir şekilde ilerler. Katıldıktan sonra reaksiyonlarİle üçlü bağlar syn eklenmesi bir cis izomerine yol açar, anti-eklenmesi bir trans izomerine yol açar.
Senkron mekanizma durumunda her ikisine de saldırı atom C eşzamanlı olarak gerçekleştirilir ve reaksiyon dipolar bir ekleme olarak ilerler (bakınız Döngüsel yükleme), ekleme işlemi ise reaksiyonlarçift veya üçlü bağ oğul gibi git-birleş (örneğin bkz. Reppe reaksiyonları).
P yeniden bağlantılar reaksiyonlar eşlenik tarafından çift bağlar kademeli bir mekanizma ile ilerleyerek 1,2- ve 1,4-ilave ürünlerinin oluşumuna yol açar:
Senkron 1.4 bağlantısı dienler iz sızdırıyor. yol:

Özel bir katılma reaksiyonu türü, konjuge eklenmesidir. Bu tür reaksiyonların akışına bir çözeltinin (veya özel olarak eklenen) bağlanması eşlik eder. reaktif) sürecin son aşamasında. Örneğin, konjuge elektrof. katılım halojenlerİle alkenler CH3COOH'da 1,2-dihalojenitlerle birlikte b-asetoksialkil halojenürlere yol açar:
Konjuge nükleof örnekleri. katılımlar - Michael'ın tepkisi ve etkileşim Aktif alkenler SH proton çözeltilerinde siyanür anyonu ile:

Katılma durumunda reaksiyonlarİle çoklu bağlar içine konulacağı karbon-hetero-atomu. ücret yerelleştirilmiştir atom C (C=O, C=N, C=N ve C=S bağları), nükleofiller her zaman bağlanır atom C ve heteroatoma elektrofiller. Maks. nükleofilik eklemeler şu ölçüde incelenmiştir: reaksiyonlar karbonil grubu üzerinde:

P yeniden bağlantılar reaksiyonİle atom C aromatikteki ikame aşamalarından biri olabilir. satır, örneğin: