Поверхностные явления примеры. Смотреть что такое "Поверхностные явления" в других словарях
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Явления, вызываемые избытком свободной энергии в пограничном слое - поверхностной энергии, повышенной активностью и ориентацией молекул поверхностного слоя, особенностями его структуры и состава. П. я. определяются также тем, что хим. и физ. вз-ствия тел происходят прежде всего в поверхностных слоях. Осн. П. я. связаны с уменьшением поверхностной энергии, пропорциональной площади поверхности. Так, образование равновесных форм жидких капель или газовых пузырей, а также кристаллов при их росте определяется минимумом свободной энергии при пост. объёме. П. я., возникающие при совместном действии молекулярных сил (поверхностного натяжения и смачивания) и внеш. сил (силы тяжести) и вызывающие искривление жидких поверхностей раздела, наз. капиллярными явлениями.
П. я. в тв. телах имеют место прежде всего на внеш. поверхности тела. К ним относятся: сцепление (когезия), (адгезия), трение. Из условий минимума свободной поверхностной энергии кристалла, на разл. гранях к-рого натяжения различны, выводятся математически все возможные формы кристаллич. многогранников, изучаемые в геом. кристаллографии.
П. я. имеют место и на внутр. поверхностях, развивающихся на основе дефектов кристаллич. решётки. Любое разрушение тв. тела, связанное с преодолением его прочности, по существу представляет собой П. я., т. к. выражается в образовании новой поверхности раздела. Образование и развитие зародышей новой фазы в первоначально однородной среде, находящейся в метастабильном состоянии, также определяется П. я. (с этим связано повышение растворимости малых капель и кристалликов и повышение над ними давления насыщенного пара; (см. КЕЛЬВИНА УРАВНЕНИЕ)).
Значит. группу П. я. составляют адсорбционные явления, при к-рых изменяется хим. состав поверхностного слоя (см. АДСОРБЦИЯ). К этой группе явлений примыкают разл. случаи активированной и хим. адсорбции, переходящей в поверхностные хим. реакции с образованием поверхностного слоя хим. соединения. Сюда относятся разл. топохим. (напр., образование металлич. зеркал на поверхностях при восстановлении металла из раствора его солей, образование накипи на поверхностях нагрева и т. д.). Образование хемосорбционных мономолекулярных слоев-покрытий служит эффективным методом изменения мономолекулярно-поверхностных св-в тела и характера его вз-ствия с окружающей средой. Адсорбционные слои могут резко повышать устойчивость эмульсий, пен, суспензий, что связано в пределе со структурно-механич. св-вами этих слоев (высокая , упругость и прочность).
Особенности теплового движения в поверхностных слоях приводят к мол. рассеянию света поверхностями. К др. группе явлений относятся: термоэлектронная эмиссия , возникновение скачков потенциала и образование двойного электрического слоя на поверхности раздела фаз. Эти П. я. связаны с адсорбцией ионов и дипольных молекул. П. я. влияют на термодинамич. равновесие фаз только в случае весьма развитой поверхности их раздела в коллоидных системах. Скорости же процессов теплообмена и массообмена - растворение, конденсация, гетерогенные хим. процессы (напр., коррозия) - определяются величиной и св-вами поверхности раздела и поэтому резко зависят от мол. природы и строения этой поверхности. Адсорбционные слои могут вызвать существ. изменение, замедление процессов межфазового обмена. Так, монослои нек-рых поверхностно-активных в-в, напр. цетилового спирта, на поверхности воды могут значительно замедлить её испарение. Таково же замедление процессов коррозии под действием поверхностных слоев ингибиторов или защитных плёнок окислов и др. хим. соединений на поверхности металла.
П. я. определяют особенности граничных условий при движении поверхностей раздела ( капель, пузырей и жидких струй, распадающихся на капли, капиллярные ). Адсорбционные слон вызывают гашение капиллярных волн вследствие возникновения местных разностей поверхностного натяжения, т. е. изменения граничных гидродинамич. условий.
П. я. определяют долговечность материалов и конструкций в данной среде. Не только растворение и коррозия, но даже и обратимая вызывают облегчение деформаций и разрушения тв. тел, понижая работу образования новых поверхностей. Малые примеси адсорбирующихся в-в, образующие мономол. слои на поверхностях раздела, позволяют управлять мн. св-вами материалов. Изучение мономолекулярных поверхностных слоев приводит к новым методам исследования молекул и установления их размеров. П. я. определяют процессы выветривания горных пород и почвообразования, испарения и конденсации влаги, а также мн. процессы в живых организмах. На использовании П. я. основаны многие технологич. процессы (смазка, смачивание , флотация и т. д.).
Физический энциклопедический словарь. - М.: Советская энциклопедия . . 1983 .
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
-
явления, адсорбцией, возникновениемповерхностной энергии, поверхностного натяжения, поверхностного электрич. Поверхностные слои неоднородны в масштабемолекулярных размеров и анизотропны независимо от агрегатного состоянияфаз, отличаются от объёмных фаз физ. свойствами (плотностью, вязкостью, кристаллы и полости микроскопич. При наличии на поверхности двумерных фазовыхпереходов, а также при пересечении поверхностей образуются межфазные линии- одномерные аналоги межфазных поверхностей, с существованием к-рых связанылинейные явления. Неоднородная линейная область является одномерным аналогомповерхностного слоя и обладает линейным натяжением, линейной свободнойэнергией и т. д. Уд. линейные термо-динамич. потенциалы отличаются от поверхностныхлишь тем, что относятся к единице длины (измеряются в Дж/м). Линейные явлениясущественны лишь для очень малых объектов (зародышей двумерных фаз, смачивающихмпирокапель и т. п.).
Закономерности П. я. описываются закономЛапласа и ур-нием Юнга (см. Смачивание),
а также обобщённым ур-ниемадсорбции Гиббса:
где - работа образования единицы поверхности путём разрезания (см. Поверхностноенатяжение),-
уд. энтропия (см. Поверхностная энергия),-
тензор поверхностных натяжений,- единичный тензор,- тензор деформации
(символ ":" означает скалярное произведениетензоров),- химические потенциалы
молекул (или электрохим. потенциалы ионов),Г i
- их адсорбции, суммирование производится по всемкомпонентам, для к-рых возможно равновесие между объёмной фазой и поверхностнымслоем. Для жидких поверхностей - поверхностное натяжение, а деформац. член отсутствует. Ур-ние адсорбцииГиббса устанавливает связь между важнейшими П. я. - адсорбцией и поверхностнойактивностью (см. Поверхностно-активные вещества).
Существенное влияние оказывают П. я. насвойства макросистем. Это связано с увеличением поверхности в таких системах, капиллярные явления. В гетерогенной системе только с искривлённымиповерхностями уже не действует Гиббса правило фаз
в его классич. расклинивающегодавления тонких плёнок, к-рое (при положит, его знаке) способствуетустойчивости дисперсных систем ( определяется какразность внеш. давления на плёнку и давления в объёмной фазе, составленнойиз компонентов плёнки при тех же, что и в плёнке, значениях темп-ры и хим. Важную группу П. я. составляют электроповерхностныеявления: поверхностная , поверхностный электрич. , эмиссия и др. Все они связаны с образованием на межфазной границе двойного электрического слоя
в результате эмиссии или специфич. К П. я. относятся когезия, адгезия,
смачивание, смазочное и моющее , трение, пропитка пористыхтел. П. я. влияют на (напр. адсорбционное понижениепрочности - эффект Ребиндера). П. я. играют важную роль в фазовых процессах. скорость тепло-и массообмена междуними. Проницаемость поверхностных слоев и плёнок, связанная с их молекулярнымстроением, обусловливает мембранные явления, особенно важные в биол. системах. Лит.:
Русанов А. И., Фазовые равновесияи поверхностные явления, Л., 1967; Адамеон А., Физическая химия поверхностей, А.
И. Русанов.
Физическая энциклопедия. В 5-ти томах. - М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1988 .
Смотреть что такое "ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ" в других словарях:
Современная энциклопедия
Поверхностные явления - ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, обусловлены особыми физическими и химическими свойствами тонких слоев вещества на границе тел (сред, фаз). Важнейшее поверхностное явление адсорбция. Определяют прочность и долговечность материалов. С поверхностным явлением … Иллюстрированный энциклопедический словарь
Группа явлений, обусловленных тем, что силы взаимодействия между частицами, составляющими тело, не скомпенсированы на его поверхности. К числу поверхностных явлений относятся поверхностное натяжение, капиллярные явления, поверхностная активность … Большой Энциклопедический словарь
поверхностные явления - – физико химические явления, обусловленные неравномерным распределением молекул растворителя и растворенного вещества вблизи поверхности раздела фаз. Общая химия: учебник / А. В. Жолнин … Химические термины
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ - явления, происходящие в поверхностном слое, на границах раздела между средами и вызываемые повышенной активностью и ориентацией молекул поверхностного слоя, особенностями его структуры и состава, а также хим. и физ. взаимодействиями в… … Большая политехническая энциклопедия
Физ. хим. явления, к рые обусловлены особыми (по сравнению с объемными) св вами поверхностных слоев жидкостей и твердых тел. Наиб. общее и важное св во этих слоев избыточная своб. энергия F = sS, где s поверхностное (межфазное) натяжение, для… … Химическая энциклопедия
Поверхностные явления совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном… … Википедия
Выражение особых свойств поверхностных слоев, т. е. тонких слоев вещества на границе соприкосновения тел (сред, фаз). Эти свойства обусловлены избытком свободной энергии (См. Свободная энергия) поверхностного слоя, особенностями его… … Большая советская энциклопедия
Поверхность – граница раздела между двумя контактирующими средами
Поверхностные явления – совокупность явлений, обусловленные физико-химическими свойствами на границе между соприкасающимися веществами.
Т.е это те явления, которые происходят на поверхности, обусловленные поверхностной энергией.
Приповерхностные слои материала рассматриваются как подсистема общей системы деформируемого материала.
Удельная поверхность : S уд = S/V
К поверхностным явлениям относятся:
2) капиллярные явления (поверхностные явления на границе жидкости с другой средой, связанные с искривлением ее поверхности)
Функция Лапласа (формула для капиллярного давления) P = σ(dS/dV)
3) адгезия (характеризует прилипание вещества одной фазы к другой фазе) и когезия (сцепление частей одного и того же однородного тела (жидкого или твердого))
4) трения
5) адсорбционные и десорбционные явления
Уравнение адсорбции Гиббса: Γ = -(∂σ/∂μ) T
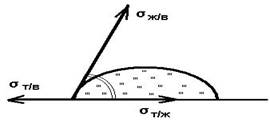
6) смачивание (поверхностное явление, наблюдаемое при контакте жидкости с твердым телом в присутствии третьей фазы-газа (пара) или другой жидкости, которая не смешивается с первой. Характерная особенность смачивания - наличие линий контакта трех фаз (линии смачивания).
Основные термодинамические характеристики смачивания - равновесный краевой угол смачивания q 0 , работа адгезии W a , теплота смачивания q W . Равновесный краевой угол смачивания определяется наклоном поверхности жидкости (напр., капли) к смоченной ею поверхности твердого тела; вершина угла находится на линии смачивания. Равновесный краевой угол определяется уравнением Юнга:
cosq 0 = (s s -s sl)/s sl ,
где s s и s sl -соотв. удельной поверхностные энергии твердого тела на границе с газом и в контакте со смачивающей жидкостью, s l -поверхностное натяжение жидкости.
Термодинамика поверхности :
поверхностные явления принято классифицировать в соответствии с объединенным уравнением первого и второго начал термодинамики.
Это уравнение записывается в виде:
где σdS – поверхностная энергия [Дж/м^2=Н/м]
Поверхностная энергия – энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объёме. Кристаллические вещества характеризуются анизотропией поверхностной энергии: наименьшей поверхностной энергией обладают грани с наибольшей плотностью частиц.
Поверхностное натяжение : σ = (dG/dS) T , p , ni
Т.е поверхностное натяжение - термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Стремление поверхностной энергии к минимуму вызывает искривление поверхности жидкости. Поэтому можно предположить наличие связи между поверхностной энергией и формой.
Электронные свойства поверхности отличаются от объёмных, в частности наличием электронных поверхностных состояний . Соответствующие им волновые функции электронов экспоненциально затухают при удалении от поверхности.
Особыми свойствами обладают и родственные поверхностным слоям малые (хотя бы в одном измерении) объекты - тонкие плёнки и нити, узкие щели и поры, капли, кристаллы и полости микроскопических размеров. Изучение тонких плёнок и мономолекулярных слоев даёт сведения о природе межмолекулярного взаимодействия и строения молекул.
При наличии на поверхности двумерных фазовых переходов, а также при пересечении поверхностей образуются межфазные линии - одномерные аналоги межфазных поверхностей, с существованием которых связаны линейные явления. Неоднородная линейная область является одномерным аналогом поверхностного слоя и обладает линейным натяжением, линейной свободной энергией и т. д. Удельные линейные термодинамические потенциалы отличаются от поверхностных лишь тем, что относятся к единице длины (измеряются в Дж/м). Линейные явления существенны лишь для очень малых объектов (зародышей двумерных фаз, смачивающих микрокапель и т. п.).
Адсорбционные и десорбционные явления
При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами – соответственно физическую и химическую адсорбцию.
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на угле.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах.
Явления физической и химической адсорбции чётко различаются в очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум.
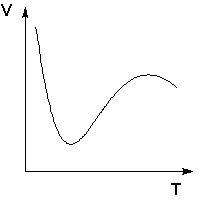
Зависимость объема адсорбированного никелем водорода от температуры
Виды адсорбции:
Теория мономолекулярной адсорбции Ленгмюра
Теория мономолекулярной адсорбции, которую разработал американский химик И.Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
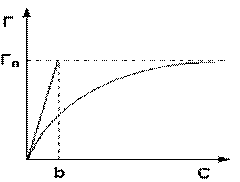
Изотерма мономолекулярной адсорбции
В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров (х), а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата на долю свободных активных центров (1 – х):
Разделив числитель и знаменатель правой части уравнения на k A , получим:

Максимально возможная величина адсорбции Г о достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. х = 1. Отсюда следует, что х = Г / Г о.
Уравнение есть изотерма мономолекулярной адсорбции, связывающая величину адсорбции Г с концентрацией адсорбата С. Здесь b – некоторая постоянная для данной пары адсорбент-адсорбат величина (отношение констант скоростей десорбции и адсорбции), численно равная концентрации адсорбата, при которой занята половина активных центров. График изотермы адсорбции Ленгмюра приведен на рис. Константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0.
При описании процесса адсорбции газов в уравнении концентрация может быть заменена пропорциональной величиной парциального давления газа:
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
Теория полимолекулярной адсорбции Поляни
На практике часто (особенно при адсорбции паров) встречаются т.н. S-образные изотермы адсорбции, форма которых свидетельствует о возможном, начиная с некоторой величины давления, взаимодействии адсорбированных молекул с адсорбатом.

Изотерма полимолекулярной адсорбции
Для описания таких изотерм адсорбции М. Поляни предложил теорию полимолекулярной адсорбции, основанную на следующих основных положениях:
1. Адсорбция вызвана чисто физическими силами.
2. Поверхность адсорбента однородна, т.е. на ней нет активных центров; адсорбционные силы образуют непрерывное силовое поле вблизи поверхности адсорбента.
3. Адсорбционные силы действуют на расстоянии, большем размера молекулы адсорбата. Иначе говоря, у поверхности адсорбента существует некоторый адсорбционный объём, который при адсорбции заполняется молекулами адсорбата.
Особенности атомной структуры поверхностного слоя:
Специфика атомной структуры вблизи поверхности твёрдых тел проявляется, в так называемых, поверхностных релаксации и реконструкции. При релаксации структура атомных плоскостей, параллельных поверхностей, сохраняется такой же, как в объёме, но межплоскостные расстояния у поверхности изменяются. При реконструкции симметрия решётки в приповерхностной области резко отличается от таковой в объёме. Это явление характерно в первую очередь для кристаллов с ковалентной связью(напр., Si и Ge). Вследствие сильно анизотропного характера ковалентного взаимодействия нарушение периодичности решётки при образовании поверхности влечёт за собой коренную перестройку геометрии межатомных связей у поверхности. Обнаружена также реконструкция поверхности ряда переходных и благородных металлов.
Поверхностная релаксация - модификация приповерхностного слоя кристалла, при которой атомная структура верхнего слоя остается той же, что и у соответствующих атомных плоскостей в объеме, но расстояние между первым и вторым слоем или их взаимное положение отличаются от таковых в объеме.
Релаксация подразделяется на нормальную и латеральную , называемую также параллельной или тангенциальной. Нормальная релаксация соответствует случаю, когда атомная структура верхнего слоя та же, что и в объеме, но расстояние между верхним и вторым слоем отличается от расстояния между плоскостями в объеме (рис. а). В чистом виде нормальная релаксация наблюдается в металлах. В большинстве случаев имеет место уменьшение первого межслоевого расстояния; для более глубоких слоев отклонение от объемного значения межслоевого расстояния уменьшается с глубиной. Иногда также наблюдается однородное смещение верхнего слоя параллельно поверхности (рис. б); в этом случае говорят о параллельной или тангенциальной релаксации. Она наблюдается в основном на высокоиндексных плоскостях с низкой концентрацией атомов.
Поверхностные явления
Пове́рхностные явле́ния - совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз . К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие различного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны разных фаз существует ненасыщенное поле межатомных, межмолекулярных сил. Вследствие этого атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся от его состояния в объеме фаз различными свойствами. Поверхностные явления изучаются коллоидной химией .
Классификация поверхностных явлений
Поверхностные явления принято классифицировать в соответствии с объединенным уравнением первого и второго начал термодинамики, в которое входят основные виды энергии . Для любой гетерогенной системы его можно записать в следующем виде:
Это уравнение показывает приращение энергии Гиббса через алгебраическую сумму приращений других видов энергии. Очевидно, что поверхностная энергия способна переходить в следующие виды энергии:
- Энергия Гиббса
- Химическая энергия
- Механическая энергия
- Электрическая энергия
Превращение поверхностной энергии в один из перечисленных видов энергии соответствует определенным поверхностным явления, таким как изменение реакционной способности при изменении дисперсности , адгезия и смачивание , капиллярность , адсорбция , электрические явления.
Значение поверхностных явлений
Поверхностные явления широко распространены в химической технологии . Практически любое химическое производство осуществляется с применением дисперсных систем и поверхностных явлений. Как правило, все гетерогенные процессы в химической технологии проводят при максимальной поверхности контакта фаз. Для этого системы вещества переводят в состояние суспензий, порошков, эмульсий, туманов, пылей. Процессы измельчения сырья и промежуточных продуктов, обогащение протекают в дисперсных системах, значительную роль в них играют такие явления как смачивание, капиллярность, адсорбция , седиментация , коагуляция . Широко распространены в химической технологии пористые адсорбенты и катализаторы, представляющие собой дисперсную систему с твердой дисперсионной средой.
Закономерности протекания поверхностных явлений, в частности структурообразования, служат теоретической основой получения материалов с заданными свойствами: керамики, цементов, ситаллов, сорбентов, катализаторов, полимеров, порохов, лекарственных средств и т. п.
Литература
Фролов Ю. Г. Курс коллоидной химии. - ООО ТИД "Альянс", 2004. - 464 с. - ISBN 5-98535-003-7
Wikimedia Foundation . 2010 .
Смотреть что такое "Поверхностные явления" в других словарях:
Явления, вызываемые избытком свободной энергии в пограничном слое поверхностной энергии, повышенной активностью и ориентацией молекул поверхностного слоя, особенностями его структуры и состава. П. я. определяются также тем, что хим. и физ. вз… … Физическая энциклопедия
Современная энциклопедия
Поверхностные явления - ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ, обусловлены особыми физическими и химическими свойствами тонких слоев вещества на границе тел (сред, фаз). Важнейшее поверхностное явление адсорбция. Определяют прочность и долговечность материалов. С поверхностным явлением … Иллюстрированный энциклопедический словарь
Группа явлений, обусловленных тем, что силы взаимодействия между частицами, составляющими тело, не скомпенсированы на его поверхности. К числу поверхностных явлений относятся поверхностное натяжение, капиллярные явления, поверхностная активность … Большой Энциклопедический словарь
поверхностные явления - – физико химические явления, обусловленные неравномерным распределением молекул растворителя и растворенного вещества вблизи поверхности раздела фаз. Общая химия: учебник / А. В. Жолнин … Химические термины
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ - явления, происходящие в поверхностном слое, на границах раздела между средами и вызываемые повышенной активностью и ориентацией молекул поверхностного слоя, особенностями его структуры и состава, а также хим. и физ. взаимодействиями в… … Большая политехническая энциклопедия
Физ. хим. явления, к рые обусловлены особыми (по сравнению с объемными) св вами поверхностных слоев жидкостей и твердых тел. Наиб. общее и важное св во этих слоев избыточная своб. энергия F = sS, где s поверхностное (межфазное) натяжение, для… … Химическая энциклопедия
Выражение особых свойств поверхностных слоев, т. е. тонких слоев вещества на границе соприкосновения тел (сред, фаз). Эти свойства обусловлены избытком свободной энергии (См. Свободная энергия) поверхностного слоя, особенностями его… … Большая советская энциклопедия
Группа явлений, обусловленных тем, что силы взаимодействия между частицами, составляющими тело, не скомпенсированы на его поверхности. К числу поверхностных явлений относят поверхностное натяжение, капиллярные явления, поверхностную активность,… … Энциклопедический словарь
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ - совокупность явлений, связанных с особыми свойствами поверхностных слоев на границе между соприкасающимися телами. Поверхностные явления обусловлены наличием поверхностной энергии. К поверхностным явлениям относятся поверхностное натяжение,… … Металлургический словарь
Книги
- Физическая химия. Поверхностные явления и дисперсные системы. Учебное пособие , А. Г. Морачевский. Физическая химия. Поверхностные явления и дисперсные системы: Уч. пособие, 2-е изд., стер. ISBN:978-5-81141-857-2…
Пове́рхностные явле́ния - совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз . К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз , в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие различного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны разных фаз существует ненасыщенное поле межатомных, межмолекулярных сил. Вследствие этого атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся от его состояния в объеме фаз различными свойствами . Поверхностные явления изучаются коллоидной химией .
Классификация поверхностных явлений
Поверхностные явления принято классифицировать в соответствии с объединенным уравнением первого и второго начал термодинамики, в которое входят основные виды энергии . Для любой гетерогенной системы его можно записать в следующем виде:
d G = − S d T + V d P + σ d s _ + Σ μ i d n i + φ d q {\displaystyle dG=-SdT+VdP+{\underline {\sigma ds}}+\Sigma \mu _{i}dn_{i}+\varphi dq}Это уравнение показывает приращение энергии Гиббса через алгебраическую сумму приращений других видов энергии. Очевидно, что поверхностная энергия способна переходить в следующие виды энергии:
- Энергия Гиббса
- Химическая энергия
- Механическая энергия
- Электрическая энергия
Превращение поверхностной энергии в один из перечисленных видов энергии соответствует определенным поверхностным явления, таким как изменение реакционной способности при изменении дисперсности , адгезия и смачивание , капиллярность , адсорбция , электрические явления.
Значение поверхностных явлений
Поверхностные явления широко распространены в химической технологии . Практически любое химическое производство осуществляется с применением дисперсных систем и поверхностных явлений. Как правило, все гетерогенные процессы в химической технологии проводят при максимальной поверхности контакта фаз. Для этого системы вещества переводят в состояние суспензий, порошков, эмульсий, туманов, пылей. Процессы измельчения сырья и промежуточных продуктов, обогащение протекают в дисперсных системах, значительную роль в них играют такие явления как смачивание, капиллярность, адсорбция , седиментация , коагуляция . Широко распространены в химической технологии пористые адсорбенты и катализаторы, представляющие собой дисперсную систему с твердой дисперсионной средой.
Закономерности протекания поверхностных явлений, в частности структурообразования, служат теоретической основой получения материалов с заданными свойствами: керамики, цементов, ситаллов, сорбентов, катализаторов, полимеров, порохов, лекарственных средств и т. п.
Явления на водных поверхностях
Существует отчётливый контраст между простотой раздела поверхностей «масло-вода» при визуальном осмотре и его сложностью на уровне микроскопического масштаба en , которая проявляется в молекулярной структуре границы и в динамике её водородных связей . Огромный объём работ, начиная с Пуассона и Максвелла , был посвящён вопросам изучения структуры воды и её реакционной способности на границе раздела, однако из-за скандала с поливодой тема структуры воды испытала спад научной активности .
Поверхностные явления на границе «масло-вода» лежат в основе ряда важных химических , физических en и биологических процессов, включая образование мицелл и мембран , сворачивание белка , химическое разделение , нефтедобычу , формирование наночастиц и полимеризацию на границе фаз en .
Структура воды, контактирующей с «расширенными» гидрофобными поверхностями, которые возникают на границе раздела , например, в эмульсии гексана , сильно отличается от структуры гидратационной оболочки en простых растворённых веществ, таких как метан . В гомогенном растворе метана молекулы водной оболочки ориентированы по касательной к сфере молекулы метана; в то время как в эмульсии гексана около 25 % поверхностных молекул воды теряют одну водородную связь , а возникающие при этом свободные группы OH проникают в мицеллу гексана. Согласно гипотезе химиков Ю. Чона и Р. А. Маркуса , наличие свободных групп OH является причиной, по которой некоторые органические реакции на водных поверхностях en ускоряются в сотни раз.
См. также
Примечания
Литература
- Фролов Ю. Г. Курс коллоидной химии. - ООО ТИД "Альянс", 2004. - 464 с. - ISBN 5-98535-003-7 .
- Chaplin, M. Water structuring at colloidal surfaces // Surface Chemistry in Biomedical and Environmental Science: [англ. ] / J. P. Blitz, V. M. Gun’ko (Eds.). - Springer Netherlands , 2006. - P. 1-10. - DOI :10.1007/1-4020-4741-X_1 .
- Jung, Y.
Процессы, протекающие на границе раздела фаз называются поверхност-ными явлениями. Причиной поверхностных явлений служит особое состоя-ние молекул в слоях, непосредственно приле-гающих к поверхности раздела фаз, т.к. эти слои отличаются от внутренних слоев своими физико-химичес-кими свойствами (удельной энергией, плотностью, вязкостью, электропро-водностью, составом). Причем, чем больше удельная энергия системы, тем сильнее отличаются свойства и сильнее влияние поверхностных явлений на поведение системы в целом.
Молекулярное давление . Энергетическое состояние молекул вещества в объеме фазы и в поверхностном слое не одинаково. Молекулы, находящиеся в объеме фазы, испытывают одинаковое притяжение (и отталкивание) со сто-роны окружающих её молекул и поэтому равнодействующая молекулярных сил равна нулю. Например, молекула жидкости в точке А. На молекулу (точ-ка Б), находящуюся на границе раздела фаз, со стороны разных (прилегаю-
больше чем сил притяжения газовой фазы. Если притяжением со стороны мо-лекул газа можно пренебречь, то сила притяжения поверхностных молекул жидкости, занимающей площадь 1 м 2 , молекулами глубинных слоев равна внутреннему (молекулярному) давлению жидкости, т.е. силе притяжения между молекулами жидкости в объеме. Величина внутреннего давления жид-кости очень велика и зависит от полярности жидкости. Чем полярнее ве-щества, и чем больше притяжение их молекул, тем больше внутреннее дав-ление. Например, для воды 14800 атм., а для бензола – 3800 атм.
Поверхностное натяжение. Свободная поверхностная энергия. Для уве-личения поверхности жидкости (т.е. переноса вещества из объема фазы в поверхностный слой) нужно преодолеть силу внутреннего давления и совер-шить работу. Эта работа тем больше, чем больше площадь создаваемой поверхности и чем выше поверхностное натяжение. Одностороннее натяже-ние поверхностного слоя молекул называется поверхностным натяжением (σ ). Оно является выражением сил сцепления между молекулами данного вещества в данном состоянии.
Энергия, затраченная на создание поверхности, пойдет на увеличение энергии молекул для вывода их из глубины фазы на поверхность. Избыток энергии поверхностных молекул по сравнению с энергией внутренних моле-кул, приходящийся на единицу площади поверхности называется свободной поверхностной энергией: F= σ . S (измеряется в Дж/м 2 или эрг/см 2). Как видно
из формулы, поверхностное натяжение численно равно работе образования единицы площади поверхности или удельной свободной энергии: . Это естьэнергетическое выражение поверхностного натяжения. Силовое оп-ределение поверхностного натяжения: это сила, действующая на поверхность по касательной к ней и стремящаяся сократить свободную поверхность тела до наименьших пределов. В этом случае оно измеряется в Н/м.
Согласно II закону термодинамики свободная поверхностная энергия сис-темы самопроизвольно стремится к минимуму. Значит, свободная поверх-ностная энергия может снижаться за счет уменьшения площади поверхности или за счет снижения поверхностного натяжения. Уменьшение площади поверхности под действием сил молекулярного давления возможно только для жидкостей, т.к. силы сцепления её молекул не слишком велики. Поэтому мелкие капли сливаются в более крупные и капли жидкости в аэрозолях, туманах, эмульсиях имеют сферическую форму.
Снижение свободной поверхностной энергии за счет уменьшения поверх-ностного натяжения присуще как жидкости, так и твердому телу. Поверх-ностное натяжение может снижаться за счет накопления на поверхности мо-лекул другого вещества, в частности, ПАВ. Эти молекулы своим притяже-нием частично компенсируют втяжение поверхностных молекул данной фазы в глубь объема и система приобретает большую устойчивость.
Свободная поверхностная энергия и поверхностное натяжение зависят от температуры, природы фаз, природы и концентрации растворенных веществ.
С повышением температуры поверхностное натяжение снижается, т.к. уменьшается взаимное притяжение молекул. В критической точке поверх-ностное натяжение достигает нуля, т.к. при этом исчезают различия и граница раздела фаз.
Повышение давления снижает поверхностное натяжение только в системе «газ-жидкость», т.к. при этом газ по физико-химическим свойствам сбли-жается к жидкости.
Следует также отметить, что можно измерить поверхностное натяжение только жидкостей. У твердых тел это невозможно, т.к. невозможно искусственно растягивать поверхность твердого тела из-за его разрушения. По-верхностное натяжение твердых тел определяют расчетным путем. Для изме-рения поверхностного натяжения жидкостей применяют статические (методы капиллярного поднятия, лежащей или висящей капли), полустатические ме-тоды (метод максимального давления пузырька газа, метод отрыва кольца, сталагмометрический метод (метод взвешивания или счета капель). Из них прост и достаточно точен сталагмометрический метод. Он основан на том, что в момент отрыва под действием силы тяжести от конца капилляра капли жидкости, её вес практически равен силе поверхностного натяжения, прило-женной к окружности капилляра.
Для
разбавленных растворов, плотность
которых мало отличается от плотности
воды, поверхностное натяжение можно
вычислить по уравнению (мДж/м 2):
![]() .
.
Адгезия и когезия. Поверхностные явления имеют важное значение в фармации, т.к. большинство лекарств − порошки, таблетки, эмульсии, сус-пензии, аэрозоли, мази и др. являются дисперсными системами. В производ-стве лекарств чаще всего приходится сталкиваться с такими явлениями, как адсорбция, смачивание, адгезия.
Притяжение, возникающее между двумя разнородными (твердыми или жидкими) телами при их соприкосновении называется адгезией (от лат adhaesio притяжение, сцепление»). Она характеризует силу сцепления разно-родных веществ и измеряется работой, затраченной на отрыв молекул одной фазы от молекул другой фазы (измеряется в Дж/м 2). Эта работа рассчиты-вается по уравнению Дюпре-Юнга: W A = σ ж-г (1 + cosӨ). На явлениях адгезии основано действие клеев, связующих веществ, покрытий. Она влияет на рас-падаемость таблеток, прочность оболочек, растворение твердых лекарствен-ных форм, используется для характеристики материалов, применяемых в хирургии и стоматологии.
Сцепление однородных молекул, атомов, ионов, которое включает все ви-ды межмолекулярного, межатомного и межионного притяжения внутри од-ной фазы называют когезией (лат.«связь»). Она характеризует прочность ве-щества и измеряется работой, необходимой для разрыва вещества (преодоле-ния сил сцепления между молекулами) и создания двух новых единиц поверхностей. Величина сцепления численно равна удвоенному значению поверхностного натяжения: W ког. = 2σ.
Основные понятия адсорбционных процессов. Твердое тело или жид-кость, на поверхности которых происходит адсорбция, называется адсорбен-том, а адсорбирующееся вещество – адсорбатом или адсорбтивом. Процесс самопроизвольного накопления вещества на границе раздела фаз называется адсорбцией (Г). Она выражается количеством вещества, адсорбированного единицей поверхности или массы (моль/м 2 , моль/г). Адсорбция, осуществ-ляющая под действием сил Ван-дер-Ваальса и водородных связей, называется физической . Адсорбция, в основе которой лежит возникновение ковалентных связей между молекулами адсорбента и адсорбтива, называется химической или хемосорбцией. Физическая адсорбция представляет обратимый процесс и сопровождается десорбцией (освобождением поверхности от адсорбирован-ного вещества). Между адсорбцией и десорбцией устанавливается динами-ческое равновесие, положение которого зависит от температуры. Повышение температуры понижает физическую адсорбцию и усиливает химическую адсорбцию. Десорбция осуществляется разрушением адсорбента, изменением температуры и снижением сил адсорбционного взаимодействия. Последняя широко используется в виде элюции. Элюция – это смена граничащей с ад-сорбентом фазы, например раствора, в целях десорбции вещества. При элю-ции адсорбированное вещество вытесняется с адсорбента молекулами нового растворителя или в результате понижения адсорбционного сродства веществами, растворенными в новом растворе (чаще всего путем изменения заряда молекул адсорбента и адсорбтива вследствие изменения рН или ионной силы раствора).
Характерным признаком адсорбции является её избирательность (специ-фичность). Это означает, что каждый адсорбент адсорбирует одно или нес-колько определенных веществ. Избирательность адсорбции предполагает случайное совпадение в распределении электронной плотности молекул адсорбента и адсорбтива по типу «ключ – замок», т.е. химическое сродство между адсорбентом и адсорбтивом.






