Llojet e reaksioneve kimike në shembujt e kimisë organike. Llojet e reaksioneve kimike në planin e mësimit të kimisë organike në kimi (klasa 10) me temë. Klasifikimi i reaksioneve organike sipas mekanizmit. Shembuj
Shumë reaksione zëvendësimi hapin rrugën për prodhimin e një sërë përbërjesh që kanë aplikime ekonomike. Zëvendësimi elektrofilik dhe nukleofilik luan një rol të madh në shkencën dhe industrinë kimike. Në sintezën organike, këto procese kanë një sërë veçorish të cilave duhet t'u kushtohet vëmendje.
Shumëllojshmëri dukurish kimike. Reaksionet e zëvendësimit
Ndryshimet kimike që lidhen me transformimin e substancave dallohen nga një numër karakteristikash. Rezultatet përfundimtare dhe efektet termike mund të ndryshojnë; Disa procese shkojnë drejt përfundimit, në të tjera ndodh një ndryshim në substanca, shpesh i shoqëruar me një rritje ose ulje të shkallës së oksidimit. Gjatë klasifikimit të dukurive kimike sipas rezultatit përfundimtar të tyre, vëmendje i kushtohet dallimeve cilësore dhe sasiore midis reagentëve dhe produkteve. Bazuar në këto karakteristika, mund të dallohen 7 lloje të transformimeve kimike, duke përfshirë zëvendësimin, i cili ndjek skemën: A-B + C A-C + B. Një shënim i thjeshtuar i një klase të tërë fenomenesh kimike jep idenë se midis substancave fillestare ekziston një e ashtuquajtura "sulm" një grimcë që zëvendëson një atom, jon ose grup funksional në një reagent. Reaksioni i zëvendësimit është karakteristik për kufizues dhe
Reaksionet e zëvendësimit mund të ndodhin në formën e një shkëmbimi të dyfishtë: A-B + C-E A-C + B-E. Një nga nënllojet është zhvendosja, për shembull, e bakrit me hekur nga një zgjidhje e sulfatit të bakrit: CuSO 4 + Fe = FeSO 4 + Cu. Grimca "sulmuese" mund të jetë atome, jone ose grupe funksionale

Zëvendësimi homolitik (radikal, SR)
Me mekanizmin radikal të thyerjes së lidhjeve kovalente, një çift elektronik i përbashkët për elementë të ndryshëm shpërndahet proporcionalisht midis "fragmenteve" të molekulës. Janë formuar radikalet e lira. Këto janë grimca të paqëndrueshme, stabilizimi i të cilave ndodh si rezultat i transformimeve të mëvonshme. Për shembull, kur prodhohet etan nga metani, shfaqen radikale të lira që marrin pjesë në reaksionin e zëvendësimit: CH 4 CH 3. + .N; CH 3. + .CH 3 → C2H5; N. + .N → N2. Prishja e lidhjes homolitike sipas mekanizmit të zëvendësimit të mësipërm është e një natyre zinxhir. Në metan, atomet H mund të zëvendësohen në mënyrë të njëpasnjëshme nga klori. Reagimi me bromin ndodh në mënyrë të ngjashme, por jodi nuk është në gjendje të zëvendësojë drejtpërdrejt hidrogjenin në alkane; fluori reagon me to shumë fuqishëm.

Metoda e thyerjes së lidhjes heterolitike
Me mekanizmin jonik të reaksioneve të zëvendësimit, elektronet shpërndahen në mënyrë të pabarabartë midis grimcave të sapoformuara. Çifti i lidhjes së elektroneve shkon tërësisht në një nga "fragmentet", më së shpeshti tek partneri i lidhjes drejt të cilit u zhvendos dendësia negative në molekulën polare. Reaksionet e zëvendësimit përfshijnë formimin e alkoolit metil CH 3 OH. Në bromometan CH3Br, ndarja e molekulës është heterolitike dhe grimcat e ngarkuara janë të qëndrueshme. Metil fiton një ngarkesë pozitive dhe bromi fiton një ngarkesë negative: CH 3 Br → CH 3 + + Br - ; NaOH → Na + + OH - ; CH 3 + + OH - → CH 3 OH; Na + + Br - ↔ NaBr.

Elektrofile dhe nukleofile
Grimcat të cilave u mungojnë elektronet dhe mund t'i pranojnë ato quhen "elektrofile". Këto përfshijnë atomet e karbonit të lidhur me halogjenet në haloalkanet. Nukleofilët kanë rritur densitetin e elektroneve; ata "dhurojnë" një palë elektrone kur krijojnë një lidhje kovalente. Në reaksionet e zëvendësimit, nukleofile të pasura me ngarkesa negative sulmohen nga elektrofile të uritur nga elektroni. Ky fenomen shoqërohet me lëvizjen e një atomi ose grimce tjetër - një grup largues. Një lloj tjetër i reaksionit të zëvendësimit është sulmi i një elektrofili nga një nukleofile. Ndonjëherë është e vështirë të dallosh dy procese dhe t'i atribuosh zëvendësimin një lloji ose një tjetër, pasi është e vështirë të tregosh me saktësi se cila nga molekulat është substrati dhe cili është reagjenti. Zakonisht në raste të tilla merren parasysh faktorët e mëposhtëm:
- natyra e grupit që largohet;
- reaktiviteti nukleofile;
- natyra e tretësit;
- struktura e pjesës alkilike.
Zëvendësimi nukleofilik (SN)
Gjatë procesit të ndërveprimit në një molekulë organike, vërehet një rritje e polarizimit. Në ekuacione, një ngarkesë e pjesshme pozitive ose negative tregohet nga një shkronjë e alfabetit grek. Polarizimi i lidhjes bën të mundur gjykimin e natyrës së këputjes së tij dhe sjelljes së mëtejshme të "fragmenteve" të molekulës. Për shembull, atomi i karbonit në jodometan ka një ngarkesë të pjesshme pozitive dhe është një qendër elektrofile. Ajo tërheq atë pjesë të dipolit të ujit ku ndodhet oksigjeni, i cili ka një tepricë të elektroneve. Kur një elektrofil ndërvepron me një reagent nukleofilik, formohet metanoli: CH 3 I + H 2 O → CH 3 OH + HI. Reaksionet e zëvendësimit nukleofilik zhvillohen me pjesëmarrjen e një joni ose molekule të ngarkuar negativisht me një çift elektronik të lirë që nuk është i përfshirë në krijimin e një lidhjeje kimike. Pjesëmarrja aktive e jodometanit në reaksionet SN 2 shpjegohet me hapjen e tij ndaj sulmit nukleofilik dhe lëvizshmërinë e jodit.

Zëvendësimi elektrofilik (SE)
Një molekulë organike mund të përmbajë një qendër nukleofile, e cila karakterizohet nga një tepricë e densitetit të elektroneve. Ai reagon me një reagent elektrofilik të cilit i mungon ngarkesa negative. Grimca të tilla përfshijnë atome me orbitale të lira dhe molekula me zona me densitet të ulët elektronik. Karboni B, i cili ka një ngarkesë "-", ndërvepron me pjesën pozitive të dipolit të ujit - me hidrogjenin: CH 3 Na + H 2 O → CH 4 + NaOH. Produkti i këtij reaksioni të zëvendësimit elektrofilik është metani. Në reaksionet heterolitike, qendrat e ngarkuara në mënyrë të kundërt të molekulave organike bashkëveprojnë, gjë që i bën ato të ngjashme me jonet në kiminë e substancave inorganike. Nuk duhet neglizhuar se transformimi i përbërjeve organike shoqërohet rrallë me formimin e kationeve dhe anioneve të vërteta.

Reaksionet monomolekulare dhe bimolekulare
Zëvendësimi nukleofilik është monomolekular (SN1). Ky mekanizëm përdoret për të hidrolizuar një produkt të rëndësishëm të sintezës organike - klorur butil terciar. Faza e parë është e ngadaltë; shoqërohet me ndarje graduale në kation karbonium dhe anion klorur. Faza e dytë vazhdon më shpejt, ndodh reagimi i jonit të karbonit me ujë. duke zëvendësuar halogjenin në alkan me një grup hidroksi dhe duke marrë një alkool primar: (CH 3) 3 C—Cl → (CH 3) 3 C + + Cl - ; (CH 3) 3 C + + H 2 O → (CH 3) 3 C—OH + H + . Hidroliza njëfazore e halogjeneve alkil primare dhe sekondare karakterizohet nga shkatërrimi i njëkohshëm i lidhjes karbon-halogjen dhe formimi i një çifti C-OH. Ky është një mekanizëm i zëvendësimit bimolekular nukleofilik (SN2).
Mekanizmi i zëvendësimit heterolitik
Mekanizmi i zëvendësimit shoqërohet me transferimin e elektroneve dhe krijimin e komplekseve të ndërmjetme. Sa më shpejt të ndodhë reagimi, aq më lehtë lindin produktet e ndërmjetme karakteristike të tij. Shpesh procesi shkon në disa drejtime njëkohësisht. Avantazhi zakonisht shkon në rrugën që përdor grimcat që kërkojnë sasinë më të vogël të energjisë për formimin e tyre. Për shembull, prania e një lidhjeje dyfishe rrit probabilitetin e shfaqjes së një kationi alilik CH2=CH—CH 2 + krahasuar me jonin CH 3 +. Arsyeja qëndron në densitetin elektronik të lidhjes së shumëfishtë, e cila ndikon në delokalizimin e ngarkesës pozitive të shpërndarë në të gjithë molekulën.
Reaksionet e zëvendësimit të benzenit
Grupi i karakterizuar nga zëvendësimi elektrofilik janë arenet. Unaza e benzenit është një objektiv i përshtatshëm për sulm elektrofilik. Procesi fillon me polarizimin e lidhjes në reagentin e dytë, duke rezultuar në formimin e një elektrofili ngjitur me renë elektronike të unazës së benzenit. Si rezultat, shfaqet një kompleks tranzicioni. Nuk ka ende një lidhje të plotë midis grimcave elektrofile dhe një prej atomeve të karbonit; ajo tërhiqet nga e gjithë ngarkesa negative e elektroneve "aromatike gjashtë". Në fazën e tretë të procesit, elektrofili dhe një atom karboni i unazës lidhen nga një palë elektronesh të përbashkëta (lidhja kovalente). Por në këtë rast, "gjashtë aromatike" shkatërrohet, e cila është e pafavorshme nga pikëpamja e arritjes së një gjendjeje të qëndrueshme, të qëndrueshme energjetike. Vërehet një fenomen që mund të quhet "nxjerrja e protonit". H+ eliminohet dhe rikthehet një sistem i qëndrueshëm komunikimi karakteristik për arenët. Nënprodukti përmban një kation hidrogjeni nga unaza e benzenit dhe një anion nga reagenti i dytë.

Shembuj të reaksioneve të zëvendësimit nga kimia organike
Alkanet karakterizohen veçanërisht nga një reaksion zëvendësimi. Shembuj të transformimeve elektrofile dhe nukleofile mund të jepen për cikloalkanet dhe arenet. Reaksione të ngjashme në molekulat e substancave organike ndodhin në kushte normale, por më shpesh kur nxehen dhe në prani të katalizatorëve. Proceset e zakonshme dhe të studiuara mirë përfshijnë zëvendësimin elektrofilik në unazën aromatike. Reagimet më të rëndësishme të këtij lloji:
- Nitrimi i benzenit në prani të H 2 SO 4 zhvillohet sipas skemës: C 6 H 6 → C 6 H 5 - NO 2.
- Halogjenimi katalitik i benzenit, në veçanti klorifikimi, sipas ekuacionit: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl.
- Procesi aromatik vazhdon me acid sulfurik "tymues", formohen acide benzensulfonike.
- Alkilimi është zëvendësimi i një atomi hidrogjeni nga unaza e benzenit me një alkil.
- Acilimi - formimi i ketoneve.
- Formilimi është zëvendësimi i hidrogjenit me një grup CHO dhe formimi i aldehideve.
Reaksionet e zëvendësimit përfshijnë reaksionet në alkane dhe cikloalkane në të cilat halogjenet sulmojnë një lidhje të arritshme C-H. Formimi i derivateve mund të përfshijë zëvendësimin e një, dy ose të gjithë atomeve të hidrogjenit në hidrokarburet e ngopura dhe cikloparafinat. Shumë nga haloalkanet me pesha të vogla molekulare përdoren në prodhimin e substancave më komplekse që i përkasin klasave të ndryshme. Progresi i arritur në studimin e mekanizmave të reaksioneve të zëvendësimit i ka dhënë një shtysë të fuqishme zhvillimit të sintezave të bazuara në alkane, cikloparafina, arene dhe hidrokarbure të halogjenizuara.
CH 3 -CH 3 + Cl 2 – (hv) ---- CH 3 -CH 2 Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
Reaksionet e shtimit
Reaksione të tilla janë tipike për përbërjet organike që përmbajnë lidhje të shumta (të dyfishta ose të trefishta). Reaksionet e këtij lloji përfshijnë reaksionet e shtimit të halogjeneve, halogjeneve të hidrogjenit dhe ujit në alkenet dhe alkinet.
CH3 -CH=CH2 + HCl ---- CH3 -CH(Cl)-CH3
Reaksionet e eliminimit
Këto janë reagime që çojnë në formimin e lidhjeve të shumta. Gjatë eliminimit të halogjeneve të hidrogjenit dhe ujit, vërehet një selektivitet i caktuar i reaksionit, i përshkruar nga rregulli i Zaitsev, sipas të cilit një atom hidrogjeni eliminohet nga atomi i karbonit në të cilin ka më pak atome hidrogjeni. Shembull reagimi
CH3-CH(Cl)-CH 2 -CH 3 + KOH →CH 3 -CH=CH-CH 3 + HCl
Polimerizimi dhe polikondensimi
n(CH 2 =CHCl) (-CH 2 -CHCl)n
Redoks
Reaksionet oksiduese më intensive janë djegia, një reaksion karakteristik i të gjitha klasave të përbërjeve organike. Në këtë rast, në varësi të kushteve të djegies, karboni oksidohet në C (blozë), CO ose CO 2 dhe hidrogjeni shndërrohet në ujë. Megjithatë, për kimistët organikë, reaksionet e oksidimit të kryera në kushte shumë më të buta se djegia janë me interes të madh. Agjentët oksidues të përdorur: tretësirat e Br2 në ujë ose Cl2 në CCl4; KMnO 4 në ujë ose acid të holluar; oksid bakri; hidroksidet e argjendit (I) ose të bakrit (II) të sapoprecipituara.
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
Esterifikimi (dhe reagimi i tij i kundërt i hidrolizës)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Cycloaddition
Y R Y-R
‖ + ‖ → ǀ ǀ
R Y R-Y
‖ + →
11. Klasifikimi i reaksioneve organike sipas mekanizmit. Shembuj.
Mekanizmi i reagimit përfshin një përshkrim të detajuar hap pas hapi të reaksioneve kimike. Në të njëjtën kohë, përcaktohet se cilat lidhje kovalente janë thyer, në çfarë radhe dhe në çfarë mënyre. Përshkruhet me kujdes edhe formimi i lidhjeve të reja gjatë procesit të reaksionit. Kur merret parasysh mekanizmi i reaksionit, para së gjithash, kushtojini vëmendje metodës së prishjes së lidhjes kovalente në molekulën reaguese. Ka dy mënyra të tilla - homolitike dhe heterolitike.
Reagimet radikale procedohet me ndarje homolitike (radikale) të një lidhje kovalente:

Lidhjet kovalente jopolare ose polare të ulëta (C–C, N–N, C–H) i nënshtrohen ndarjes radikale në temperatura të larta ose nën ndikimin e dritës. Karboni në radikalin CH 3 ka 7 elektrone të jashtme (në vend të një guaskë të qëndrueshme oktet në CH 4). Radikalët janë të paqëndrueshëm; ata priren të kapin elektronin që mungon (deri në një çift ose deri në një oktet). Një nga mënyrat për të formuar produkte të qëndrueshme është dimerizimi (kombinimi i dy radikalëve):
CH 3 + CH 3 CH 3 : CH 3,
N + N N : N.
Reagimet radikale - këto janë, për shembull, reaksionet e klorimit, brominimit dhe nitrimit të alkaneve:

Reaksionet jonike ndodhin me shkëputje të lidhjes heterolitike. Në këtë rast, jonet organike jetëshkurtër - karbokacionet dhe karbanionet - me një ngarkesë në atomin e karbonit formohen në mënyrë të ndërmjetme. Në reaksionet jonike, çifti elektronik i lidhjes nuk ndahet, por kalon tërësisht në një nga atomet, duke e kthyer atë në një anion:

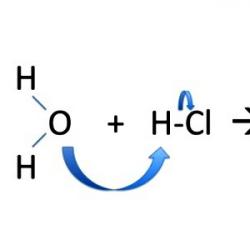
Lidhjet fort polare (H-O, C-O) dhe lehtësisht të polarizueshme (C-Br, C-I) janë të prirura për ndarje heterolitike.
Të dallojë reaksionet nukleofile (nukleofile– kërkimi i bërthamës, një vend me mungesë elektronesh) dhe reaksionet elektrofile (elektrofil– kërkimi i elektroneve). Deklarata se një reaksion i veçantë është nukleofilik ose elektrofilik i referohet gjithmonë reagentit. Reagent– një substancë që merr pjesë në reaksion me një strukturë më të thjeshtë. Substrati– një substancë fillestare me një strukturë më komplekse. Grupi në daljeështë një jon i zëvendësueshëm që është lidhur me karbonin. Produkt reaksioni– substancë e re që përmban karbon (e shkruar në anën e djathtë të ekuacionit të reaksionit).
TE reagentë nukleofilik(nukleofile) përfshijnë jone të ngarkuar negativisht, komponime me çifte të vetme elektronesh, përbërje me lidhje të dyfishta karbon-karbon. TE reagentët elektrofilë(elektrofile) përfshijnë jonet e ngarkuar pozitivisht, përbërjet me predha elektronike të pambushura (AlCl 3, BF 3, FeCl 3), përbërjet me grupe karbonil, halogjene. Elektrofile janë çdo atom, molekulë ose jon i aftë për të shtuar një palë elektrone në procesin e formimit të një lidhjeje të re. Forca lëvizëse e reaksioneve jonike është bashkëveprimi i joneve të ngarkuar në mënyrë të kundërt ose i fragmenteve të molekulave të ndryshme me një ngarkesë të pjesshme (+ dhe –).
Shembuj të llojeve të ndryshme të reaksioneve jonike.
Zëvendësimi nukleofilik :
Zëvendësimi elektrofilik :
Shtimi nukleofilik (CN - shtohet së pari, pastaj H +):

Lidhje elektrofile (H + shtohet fillimisht, pastaj X –):

Eliminimi me veprimin e nukleofileve (bazave) :
Eliminimi me veprim elektrofile (acide) :
Reaksionet organike mund të klasifikohen në dy lloje të përgjithshme.
Reaksionet hemolitike. Këto reagime zhvillohen me një mekanizëm radikal. Ne do t'i shikojmë ato në mënyrë më të detajuar në kapitullin tjetër. Kinetika dhe mekanizmi i reaksioneve të këtij lloji u diskutuan në Kap. 9.
Reaksionet heterolitike. Këto reaksione janë në thelb reaksione jonike. Ato, nga ana tjetër, mund të ndahen në reaksione zëvendësimi, shtimi dhe eliminimi.
Reaksionet e zëvendësimit
Në këto reaksione, një atom ose grup atomesh zëvendësohet nga një atom ose grup tjetër. Si shembull i reaksioneve të këtij lloji, japim hidrolizën e klorometanit me formimin e metanolit:
Joni hidroksil është një nukleofil. Prandaj, zëvendësimi në fjalë quhet zëvendësim nukleofilik. Përcaktohet me simbolin SN. Grimca e zëvendësuar (në këtë rast, një jon klori) quhet një grup largues.
Nëse shënojmë nukleofilin me simbolin dhe grupin largues me simbolin, atëherë mund të shkruajmë ekuacionin e përgjithësuar për reaksionin e zëvendësimit nukleofilik në një atom karboni të ngopur në grupin alkil R si më poshtë:
Një studim i shpejtësisë së reaksioneve të këtij lloji tregon se reaksionet mund të ndahen në
Reaksionet e tipit Për disa reaksione të tipit SN, ekuacioni kinetik për shpejtësinë e reaksionit (shih seksionin 9.1) ka formën
Kështu, këto reaksione janë të rendit të parë në substrat, por të rendit zero në reaktant.Karakteristika kinetike e një reaksioni të rendit të parë është një tregues i besueshëm se hapi kufizues i shpejtësisë i reaksionit është një proces jomolekular. Prandaj, reagimet e këtij lloji tregohen me simbol.
Reaksioni ka rend zero në lidhje me reagentin pasi shpejtësia e tij nuk varet nga përqendrimi i reagentit. Prandaj, mund të shkruajmë:
Meqenëse nukleofili nuk merr pjesë në hapin kufizues të shpejtësisë së reagimit, mekanizmi i një reagimi të tillë duhet të përfshijë të paktën dy hapa. Mekanizmi i mëposhtëm është propozuar për reagime të tilla:

Faza e parë është jonizimi me formimin e një karbokacioni.Ky stad është kufizues (i ngadalshëm).
Një shembull i këtij lloji të reaksionit është hidroliza alkaline e halogjeneve alkile terciare. Për shembull
Në rastin në shqyrtim, shpejtësia e reagimit përcaktohet nga ekuacioni
Reaksionet e tipit Për disa reaksione të zëvendësimit nukleofilik SN ekuacioni i shpejtësisë ka formën
Në këtë rast, reaksioni është i rendit të parë në nukleofile dhe i rendit të parë në . Në përgjithësi, është një reagim i rendit të dytë. Kjo është arsye e mjaftueshme për të besuar se faza kufizuese e shpejtësisë së këtij reagimi është një proces bimolekular. Prandaj, reaksioni i llojit në shqyrtim shënohet me simbolin Meqenëse si nukleofili ashtu edhe substrati marrin pjesë njëkohësisht në fazën kufizuese të shpejtësisë së reaksionit, mund të mendojmë se ky reagim vazhdon në një fazë përmes një gjendje tranzicioni (shih seksionin 9.2):
Hidroliza e halogjenëve alkil primar në një mjedis alkalik vazhdon sipas mekanizmit

Ky reaksion ka ekuacionin kinetik të mëposhtëm:
Deri tani kemi konsideruar zëvendësimin nukleofilik vetëm në atomin e karbonit të ngopur. Zëvendësimi nukleofilik është gjithashtu i mundur në një atom karboni të pangopur:

Reaksionet e këtij lloji quhen zëvendësim acil nukleofilik.
Zëvendësimi elektrofilik. Reaksionet e zëvendësimit elektrofil mund të ndodhin edhe në unazat e benzenit. Në këtë lloj zëvendësimi, unaza e benzenit furnizon elektrofilin me dy nga elektronet e tij të delokalizuara. Në këtë rast, formohet një përbërje e ndërmjetme - një kompleks i paqëndrueshëm i një elektrofili dhe një grupi largues. Për një paraqitje skematike të komplekseve të tilla, përdoret një rreth i hapur, që tregon humbjen e dy elektroneve:

Një shembull i reaksioneve të zëvendësimit elektrofilik është nitrimi i benzenit:

Nitrimi i benzenit kryhet në një instalim me një kondensator refluksi në një temperaturë prej 55 deri në 60 ° C duke përdorur një përzierje nitratuese. Kjo përzierje përmban sasi të barabarta të acideve nitrik dhe sulfurik të koncentruar. Reagimi midis këtyre acideve çon në formimin e një kationi nitroil
Reaksionet e shtimit
Në reaksionet e këtij lloji, një elektrofil ose nukleofili i shtohet një atomi karboni të pangopur. Ne do të shqyrtojmë këtu një shembull secilin prej shtimit elektrofil dhe shtimit nukleofilik.
Një shembull i shtimit elektrofilik është reaksioni midis bromurit të hidrogjenit dhe një alkeni. Për të marrë hidrogjen bromin në laborator, mund të përdoret një reaksion midis acidit sulfurik të koncentruar dhe bromit të natriumit (shih seksionin 16.2). Molekulat e bromit të hidrogjenit janë polare sepse atomi i bromit ka një efekt induktiv negativ në hidrogjen. Prandaj, molekula e bromit të hidrogjenit ka vetitë e një acidi të fortë. Sipas pikëpamjeve moderne, reagimi i bromurit të hidrogjenit me alkenet ndodh në dy faza. Në fazën e parë, një atom hidrogjeni i ngarkuar pozitivisht sulmon lidhjen e dyfishtë, e cila vepron si burim elektronesh. Si rezultat, formohet një kompleks i aktivizuar dhe një jon bromidi:

Joni i bromit më pas sulmon këtë kompleks, duke rezultuar në formimin e një bromidi alkil:

Një shembull i shtimit nukleofilik është shtimi i cianidit të hidrogjenit në çdo aldehid ose keton. Së pari, aldehidi ose ketoni trajtohet me një tretësirë ujore të cianidit të natriumit, pastaj shtohet një sasi e tepërt e çdo acidi mineral, i cili çon në formimin e cianidit të hidrogjenit HCN. Joni i cianidit është një nukleofil. Ai sulmon atomin e karbonit të ngarkuar pozitivisht në grupin karbonil të aldehidit ose ketonit. Ngarkesa pozitive dhe polariteti i grupit karbonil është për shkak të efektit mesomerik, i cili u përshkrua më lart. Reagimi mund të përfaqësohet nga diagrami i mëposhtëm:

Reaksionet e eliminimit
Këto reaksione janë të kundërta të reaksioneve të shtimit. Ato çojnë në heqjen e çdo atomi ose grupi atomesh nga dy atome karboni të lidhur me njëri-tjetrin me një lidhje të thjeshtë kovalente, duke rezultuar në formimin e një lidhjeje të shumëfishtë midis tyre.
Një shembull i një reagimi të tillë është eliminimi i hidrogjenit dhe halogjenit nga halogjenet alkil:
Për të kryer këtë reaksion, halidi alkil trajtohet me hidroksid kaliumi në alkool në një temperaturë prej 60 °C.
Duhet të theksohet se trajtimi i një alkil halide me hidroksid gjithashtu çon në zëvendësimin nukleofilik (shih më lart). Si rezultat, dy reaksione konkurruese të zëvendësimit dhe eliminimit ndodhin njëkohësisht, gjë që çon në formimin e një përzierjeje të produkteve të zëvendësimit dhe eliminimit. Cili nga këto reaksione do të jetë mbizotërues varet nga një sërë faktorësh, duke përfshirë mjedisin në të cilin kryhet reaksioni. Zëvendësimi nukleofilik i halogjenëve alkil kryhet në prani të ujit. Në të kundërt, reaksionet e eliminimit kryhen në mungesë të ujit dhe në temperatura më të larta.
Pra, le ta themi përsëri!
1. Gjatë ndarjes hemolitike të një lidhjeje, dy elektrone të përbashkëta shpërndahen në mënyrë të barabartë midis atomeve.
2. Gjatë shkëputjes së lidhjes heterolitike, dy elektrone të përbashkëta shpërndahen në mënyrë të pabarabartë midis atomeve.
3. Një karbanion është një jon që përmban një atom karboni me ngarkesë negative.
4. Një karbokacion është një jon që përmban një atom karboni me ngarkesë pozitive.
5. Efektet e tretësit mund të kenë një ndikim të rëndësishëm në proceset kimike dhe konstantet e tyre të ekuilibrit.
6. Efekti i mjedisit kimik të një grupi funksional brenda një molekule në reaktivitetin e atij grupi funksional quhet efekt strukturor.
7. Efektet elektronike dhe efektet sterike quhen kolektivisht efekte strukturore.
8. Dy efektet elektronike më të rëndësishme janë efekti induktiv dhe efekti mesomerik (rezonant).
9. Efekti induktiv është zhvendosja e densitetit të elektroneve nga një atom në tjetrin, gjë që çon në polarizimin e lidhjes midis dy atomeve. Ky efekt mund të jetë pozitiv ose negativ.
10. Grimcat molekulare me lidhje të shumta mund të ekzistojnë në formën e hibrideve rezonante ndërmjet dy ose më shumë strukturave rezonante.
11. Efekti mezomerik (rezonanca) konsiston në stabilizimin e hibrideve rezonante për shkak të delokalizimit të -elektroneve.
12. Pengimi sterik mund të ndodhë kur grupet e mëdha në një molekulë pengojnë mekanikisht reaksionin.
13. Nukleofili është një grimcë që sulmon një atom karboni, duke e furnizuar atë me çiftin e tij elektronik. Nukleofili është një bazë Lewis.
14. Një elektrofil është një grimcë që sulmon një atom karboni, duke pranuar çiftin e tij elektronik. Nukleofili është një acid Lewis.
15. Reaksionet hemolitike janë reaksione radikale.
16. Reaksionet heterolitike janë kryesisht reaksione jonike.
17. Zëvendësimi i ndonjë grupi në një molekulë me një reagent nukleofilik quhet zëvendësim nukleofilik. Grupi që zëvendësohet në këtë rast quhet grupi largues.
18. Zëvendësimi elektrofilik në unazën e benzenit përfshin dhurimin e dy elektroneve të delokalizuara në disa elektrofile.
19. Në reaksionet e shtimit elektrofil, një atomi karboni të pangopur i shtohet një elektrofil.
20. Shtimi i cianidit të hidrogjenit në aldehide ose ketone është një shembull i shtimit nukleofilik.
21. Në reaksionet e eliminimit (eliminimit), disa atome ose grupe atomesh ndahen nga dy atome karboni të lidhura me njëri-tjetrin me një lidhje të thjeshtë kovalente. Si rezultat, një lidhje e shumëfishtë formohet midis këtyre atomeve të karbonit.

Teoria e zëvendësimit në përbërjet aromatike. Reaksionet e zëvendësimit elektrofil. Orientuesit e llojit të dytë (meta-orientantët).
Zëvendësuesit që kanë një efekt induktiv negativ ose efekt negativ si induktiv ashtu edhe mezomer, drejtojnë zëvendësimin elektrofilik në pozicionin meta të unazës së benzenit dhe quhen orientues të llojit të dytë.
Reaksionet organike, si ato inorganike, ndahen në 3 lloje kryesore:
1) reaksioni i zëvendësimit: CH 4 + CI 2 → CH 3 CI + HCI;
2) reaksioni i eliminimit: CH 3 CH 2 Br → CH 2 = CH 2 + HBr;
3) reaksioni i shtimit: CH 2 = CH 2 + HBr → CH 3 CH 2 Br. reaksionet e polimerizimit)
Klasifikoni me mekanizmin e thyerjes së lidhjeve kovalente në molekulat reaguese.
Dy mënyra për të thyer lidhjet kovalente.
1. Nëse një çift elektronik i përbashkët ndahet midis atomeve, duke formuar radikale. Radikalët-grimca me elektrone të paçiftuara. Kjo shkëputje quhet radikal (homolitik).Veçori Kjo lidhje është se radikalët që formohen ndërveprojnë me molekulat e pranishme në sistemin e reaksionit ose me njëri-tjetrin.
Radikalët që rezultojnë ndërveprojnë me molekulat e pranishme në sistemin e reaksionit ose me njëri-tjetrin: CH 3 + CI 2 → CH 3 CI + CI.
Sipas mekanizmit radikal, ndodhin reaksione në të cilat lidhjet me polaritet të ulët (C-C, C-H, N-N) thyhen në temperatura të larta, nën ndikimin e dritës ose rrezatimit radioaktiv.
2. Nëse, kur një lidhje prishet, një çift elektronik i përbashkët mbetet me një atom, atëherë jonet – kation dhe anion. Ky mekanizëm quhet jonike ose heterolitike. Ajo çon në formimin e organike katione ose anione: 1) klorur metil formon një kation metil dhe një anion klorur; 2) litium metil formon kation litium dhe anion metil.
Jonet organike pësojnë transformime të mëtejshme. Në këtë rast, kationet ndërveprojnë me nukleofile("bërthamë-dashur") grimcat, dhe anionet organike - me elektrofile grimca ("elektronidashëse") (katione metalike, halogjene, etj.).
Mekanizmi jonik vërehet kur prishet një lidhje kovalente polare (karbon - halogjen, karbon - oksigjen etj.).
Grimcat jonike organike janë të ngjashme me jonet në kiminë inorganike - ato kanë ngarkesa përkatëse. Sidoqoftë, ato janë ashpër të ndryshme: jonet e përbërjeve inorganike janë vazhdimisht të pranishme në solucione ujore, dhe grimcat jonike organike shfaqen vetëm në momentin e reagimit.
Prandaj, në shumë raste është e nevojshme të flasim jo për jone organike të lira, por për molekula shumë të polarizuara.
Mekanizmi radikal vërehet kur prishet një lidhje kovalente jopolare ose e ulët polare (karbon-karbon, karbon-hidrogjen etj.).
Grimcat jonike organike janë të ngjashme me jonet në kiminë inorganike - ato kanë ngarkesa përkatëse.