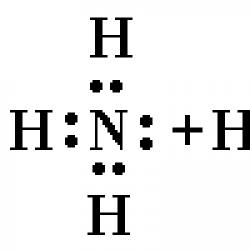Lidhja kimike në klorurin e amonit. Llojet e lidhjeve kimike. Vetitë kimike të klorurit të amonit
§5. Dhe për kripërat, tradicionalja është një lidhje jonike
Çfarë lloj lidhjeje kimike do të ketë nëse formohet nga atome të elementeve që janë shumë të ndryshëm në elektronegativitet - për shembull, një metal alkali natriumi dhe halogjen klorin?
Elektroni i atomit natriumi Na, i vendosur në nivelin e jashtëm të valencës, është një adhurues i madh i shëtitjeve nëpër lagje dhe shpesh harron edhe të kthehet në shtëpi në bërthamën e tij atomike amtare. Dhe pastaj atomi i natriumit mbetet pa elektronin e tij të padrejtë dhe shndërrohet në kation Na+:
Na 0 - 1 e− = Na +
Shtatë elektrone të një atomi klorin Cl Përkundrazi, ata janë shtëpi të pandreqshme, nuk u pëlqen të vizitojnë, por i presin me kënaqësi mysafirët. Nëse ndonjë elektron fqinj kthehet drejt tyre, do të thotë atomi klorin do të kthehet në anion Cl¯, e cila zakonisht quhet klorur-jon:
Cl 0 + 1 e− = Cl −
Jonet me ngarkesë të kundërt do të tërheqin njëri-tjetrin; është formuar Lidhja jonike Na+ ~~~~ Cl −. Kështu rezulton klorid sodium NaCl, të gjithë e dinë kripë.
Kripa natyrale e tryezës është një mineral.
Në natyrë, ky mineral formohet nga uji i kripur i detit ose liqenit. Kur ftohet nën një shtresë tretësirë kripe, zbulohen kristalet e saj - kube transparente klorid sodium. Jonet që përbëjnë klorid sodium, formë kristal jonik, i përbërë nga katione natriumi Na+ Dhe anionet e klorurit Cl −.
Kur një lëndë e ngurtë formohet nga jonet e tretura, kationet dhe anionet vendosen në kristal jo rastësisht, por në atë mënyrë që ngarkesat pozitive dhe negative të alternojnë me njëra-tjetrën. Atëherë do të jetë e fortë qelizë kristalore kripë NaCl, i përbërë nga jone.
Kristalet e kripërave të tjera janë ndërtuar në mënyrë të ngjashme - karbonat natriumi Na 2 CO 3 (sodë), klorur amoniumi NH4Cl (amoniaku), nitrat argjendi AgNO3 (lapis) dhe shume te tjere.
A është e vërtetë që të gjitha kripërat janë ndërtuar nga jone individuale që ekzistojnë vetëm? E vërtetë, por ka një "por" të vogël...
Kationi i kripës ruan një pjesë të resë elektronike, sepse edhe elektroni më i keq kthehet herë pas here në shtëpi. Por një pjesë shumë e madhe e kësaj reje është zhvendosur drejt anionit të kripës. Prandaj, merret parasysh lidhja jonike rasti kufizues i lidhjes polare kovalente.
PËRKUFIZIM
Amoniumi- një jon poliatomik i ngarkuar pozitivisht.
Formula kimike NH4+
Joni i amonit NH 4 + është një tetraedron i rregullt me në qendër dhe atome në kulmet e tetraedrit.
Në molekulën e amoniakut NH 3, tre çifte elektronike formojnë tre lidhje N - H, çifti i katërt elektronik që i përket atomit të azotit është i vetëm. Me ndihmën e këtij çifti elektronik, formohet një lidhje me një jon hidrogjeni, i cili ka një orbital të zbrazët:

Kështu, në jonin e amonit, tre lidhje kovalente formohen nga mekanizmi i shkëmbimit dhe një nga mekanizmi dhurues-pranues. Mekanizmi i formimit nuk ndikon në karakteristikat e lidhjes; të gjitha lidhjet në kationin e amonit janë ekuivalente.
Komponimet e amonit
Kationi i amonit mund të formojë komponime amoniumi me kundërjone të ndryshme, në të cilat një atom azoti i ngarkuar pozitivisht është i lidhur në mënyrë kovalente me jonet e hidrogjenit dhe (ose) radikalet organike, dhe i lidhur jonikisht me disa anione.
Komponimet inorganike të amonit
Hidrati i amoniakut(hidroksid amoniumi, uji i amoniakut, hidroksidi i amonit, hidroksidi i amoniakut). Formula: NH 3 H 2 O
Formohet kur amoniaku reagon me ujin. Një bazë e dobët shpërndahet në ujë për të formuar katione të amonit dhe jone hidroksid:
Reaksioni është i kthyeshëm, prandaj tretësirat ujore të hidroksidit të amonit kanë gjithmonë një erë karakteristike të mprehtë të amoniakut.
Kripërat e amonit
Të gjitha kripërat e amonit janë të ngjashme në veti me kripërat përkatëse të natriumit. Ata treten mirë në ujë, shpërndahen plotësisht në një tretësirë ujore dhe dekompozohen kur nxehen:
Në tretësirë ato hidrolizohen me kation:
Komponimet organike të amonit pjesëtuar me numrin e radikalëve organikë të lidhur me atomin e azotit në primar (R 1 NH 3) + X –, sekondar (R 1 R 2 NH 2) + X –, terciar (R 1 R 2 R 3 NH) + X - , dhe kuaternare (R 1 R 2 R 3 R 4 N) + X – .
Komponimet primare, sekondare dhe terciare të amonit mund të konsiderohen si kripëra të amineve përkatëse; ato mund të përgatiten duke reaguar këto amina me acide:
ku R1, R2, R3 janë radikale organike ose hidrogjen, X është anioni i mbetjes së acidit.
Reagimi cilësor për jonet e amonit - ndërveprimi me alkalet me çlirimin e amoniakut:
Shembuj të zgjidhjes së problemeve
SHEMBULL 1
| Ushtrimi | Çfarë vlere pH (më shumë ose më pak se 7) ka një tretësirë ujore e klorurit të amonit? Shkruani ekuacionet molekulare dhe jon-molekulare të hidrolizës. |
| Zgjidhje | NH 4 Cl është një kripë e një baze të dobët dhe një acidi të fortë, kështu që hidroliza ndodh përmes kationit. Ekuacioni molekular: Ekuacioni i plotë jonik: Ekuacion i shkurtër jonik: Gjatë procesit të hidrolizës, u formua hidrogjen (H +), kështu që tretësira ka një mjedis acid (pH |
| Përgjigju | PH e tretësirës së klorurit të amonit është më pak se 7. |
SHEMBULL 2
| Ushtrimi | Çfarë mase kripe formohet nga bashkëveprimi i 44,8 litra amoniak dhe 33,6 litra klorur hidrogjeni (kushte normale)? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zgjidhje | Le të shkruajmë ekuacionin e reaksionit: Masat molare të amoniakut, klorurit të hidrogjenit dhe kripës që rezulton, klorurit të amonit (NH 4 Cl), janë të barabarta. Lidhja kimike. Qelizë kristalore Përgjigjet e detyrave janë një fjalë, frazë, numër ose sekuencë fjalësh, numrash. Shkruani përgjigjen tuaj pa hapësira, presje ose karaktere të tjera shtesë. Fillimi i formularit 1 Kloruri i amonit përmban lidhje kimike: 1. jonike 2. polare kovalente 3. jopolare kovalente 4. hidrogjen 5. metal 2 Lidhjet ndërmolekulare të hidrogjenit në gjendje të lëngshme janë karakteristike për: 1. hidrogjen 2. Ujë 3. Amoniak 4. Acetaldehid 5. izobutan 3 Lidhjet kimike kovalente jopolare gjenden në substanca: 1. fosfor i bardhë 2. acid fosforik 3. amoniak 4. alkool etilik 5. squfur rombik 4 Nga lista e ofruar, zgjidhni dy përbërës që përmbajnë një lidhje kimike jonike. 1. Ca(ClO 2 ) 2 2. HClO 3 3. NH 4 Cl 4.HClO 4 5. C l2O 7 5 Nga lista e ofruar, zgjidhni dy komponime që përmbajnë lidhje kimike jopolare kovalente. 1. Ca 2. N 2 3. AlCl 3 4. HClO 4 5. Kl 2 6 Sulfati i kaliumit përmban lidhje kimike: 1. jonike 2. jopolare kovalente 3. polare kovalente 4. hidrogjen 5. metal 7 Të dy lidhjet kimike jonike dhe kovalente janë të pranishme në substancë: 1. HCl 2. H 2 KËSHTU QË 4 3. NaOH 4. NH 4 Br 5. C 2 N 5 AI 8 Nga lista e propozuar, zgjidhni dy komponime midis molekulave të të cilave a lidhje hidrogjenore. 1. fenol 2. eter dietil 3. Etil acetat 4. aldehid formik 5. acid formik 9 Nga lista e ofruar, zgjidhni dy komponime që përmbajnë një kovalent lidhje kimike polare. 1. CaCl 2 2. HCl 3. BaO 4. KSIO 4 5. Kl 2 10 Ata kanë një strukturë jo molekulare: 1. hidroksid kaliumi 2. amoniak 3. acid acetik 4. acid nitrik 5. grafit 11 Lidhjet jonike realizohen në secilën prej dy substancave: 1. Al 2 O 3 DheFeCl 3 2.K 2 SDheNaNO 3 3. KNO 2 dhe jo 2 4. HF dhe HCl 5. NaBr dhe NH 4 F 12 Rrjeta atomike kristalore në gjendje të ngurtë ka: 1. oksigjen 2. fosfor i bardhë 3. fosfor i kuq 4. diamant 5. klorur natriumi 13 Nga lista e ofruar, zgjidhni dy përbërje në të cilat formohet një lidhje kimike për shkak të një çifti të përbashkët elektronesh. 1. Ca 2. H 2 O 3. NaCl 4. CaO 5. Cl 2 14 Struktura molekulare është: 1. propanol-2 2. acetat kaliumi 3. dioksid karboni 4. metooksid natriumi 5. karbonat kalciumi 15 Të gjitha substancat me rrjeta kristalore jonike 1. i fortë 2. plastik 3. relativisht i paqëndrueshëm 4. shumë i tretshëm në ujë 5. kanë pika të larta shkrirjeje 16 Nga lista e ofruar, zgjidhni dy komponime molekulat e të cilave formojnë një lidhje hidrogjeni. 1. metan 2. silan 3. amoniak 4. fosfinë 5. ujë Fundi i formës Kloruri i amonit (klorur amoniumi, amoniak) është një përbërës inorganik i përdorur gjerësisht në fusha të ndryshme. Nga pikëpamja kimike, është një kripë amoniumi; formula NH 4 Cl. Kloruri i amonit ishte i njohur tashmë në Greqinë e Lashtë dhe Egjiptin e Lashtë. Një nga emrat e tij, "amoniak" vjen nga "nushadir" egjiptian - një substancë që priftërinjtë e mblodhën në muret e shpellave për të thithur avujt e saj para ceremonisë dhe për t'u përshtatur për të komunikuar me forcat hyjnore. "Amonia" e ka emrin e tij që nga perëndia egjiptian e diellit Amun. Në Greqinë e Lashtë, substanca nxirrej nga bloza që krijohej në muret e oxhaqeve si rezultat i djegies së bajgës së devesë, e cila shërbente si lëndë djegëse për grekët (kloruri i amonit përftohet nga dekompozimi i jashtëqitjeve të kafshëve dhe njerëzve). Kloruri i amonit gjendet natyrshëm në shpellat vullkanike dhe pranë çarjeve në koren e tokës, në formën e pllakës ose kores. VetitëNH 4 Cl është një pluhur kristalor i bardhë (reagjenti teknik mund të jetë i verdhë ose rozë), pak higroskopik, pa erë dhe me shije të kripur. Ai shpërndahet mirë në ujë dhe amoniak të lëngshëm; me rritjen e temperaturës, tretshmëria në ujë rritet. Reagon me alkalet për të formuar kripë, ujë dhe amoniak. Reagenti shpërndahet në një masë shumë më të vogël në alkoolet etilik dhe metil. Digjet me lëshimin e tymit të bardhë të trashë. Zbërthehet plotësisht në temperatura mbi 338 °C, si dhe nën ndikimin e rrymës elektrike. Djegia e klorurit të amonit çliron amoniak, i cili është një irritues i frymëmarrjes. Një tretësirë ujore e reagentit është amoniaku, një lëng me erë të fortë që ka një efekt stimulues në sistemin nervor. Reagenti përdoret si ilaç, por trajtimi me amoniak duhet të kryhet rreptësisht me rekomandimin e mjekut, pasi një mbidozë mund të çojë në ndalim të frymëmarrjes dhe koma (zgjidhjet alkaline, për shembull, bikarbonat natriumi, administrohen si antidot) . Përveç kësaj, ky ilaç ka kundërindikacione.
Kloruri i amonit klasifikohet si një substancë mesatarisht e rrezikshme (klasa 3); duhet të punoni me të duke përdorur pajisje mbrojtëse: doreza gome, syze sigurie dhe një respirator, në një dhomë me furnizim dhe ventilim të shkarkimit. Duhet pasur kujdes që reagjenti të mos bie në kontakt me lëkurën dhe mukozën. Ruaj kimikate Reagenti nevojitet në thasë me shumë shtresa të mbyllura hermetikisht, në ambiente të brendshme pa akses ndaj lagështirës. Lidhja është e rrezikshme për mjedisin. AplikacionNë metalurgjinë me ngjyra për turshinë e metaleve. Në dyqanin Prime Chemicals Group mund të blini 1. Lidhjet më polare në një molekulë janë: a) HC1 b) AsH 3 c) PH 3 r) H 2 S 2. Molekula ka një formë lineare: a) H 2 O b) H 2 S c) WeC1 2 d) OF 2 3. Forma gjeometrike e molekulës së metanit CH 4: a) këndore b) piramidale b) trekëndësh d) katërkëndor 4. Molekula ka një formë piramidale: a) BC1 3 b) SiBr 4 c) A1Br 3 d) PC1 3 5. Një molekulë polare është: a) CO 2 b) CH 4 b) NH 3 r) N 2 6. Numri i lidhjeve σ është tre herë më i madh se numri i lidhjeve π në molekulë: a) acidi klorik b) acid ortofosforik c) acid sulfurik d) acid perklorik 7. Në cilën seri paraqiten formulat e përbërjeve vetëm me lidhje kovalente? a) BaCl 2, CdC1 2, LiF c) NaCl, CuSO 4, Fe(OH) 3 b) H 2 O, SiO 2, CH3COOH d) N 2, HNO 3, NaNO 3 8. Çfarë lloj lidhjesh kimike mungojnë në klorurin e amonit? a) polare kovalente b) kovalente jopolare c) dhurues-pranues d) jonike 9. Lidhja kimike e formuar ndërmjet atomeve të elementeve me numra atomik 3 dhe 9: a) polare kovalente b) metali c) kovalente jopolare d) jonike 10. Sa elektrone përmban një molekulë e etilenit? Jo marrin pjesë në formimin e lidhjeve kimike? a) 4 b) 8 c) 12 d) 16 11. Numri i elektroneve të përfshira në formimin e lidhjeve kimike është më i madhi në një molekulë: a)H2O b)C12b)H2S r)N2 12. Rrjeta atomike kristalore ka: a) hidroksid natriumi c) hekur b) diamanti d) akull 13. Cili lloj i rrjetës kristalore është karakteristik për përbërjet e s-metaleve me p-elemente që kanë elektronegativitet të lartë? a) metalike b) atomike b) jonike d) molekulare 14. Në cilin rresht renditen përkatësisht substancat me rrjeta kristalore atomike, molekulare dhe jonike në gjendje të ngurtë? a) diamant, klorur natriumi, grafit b) fosfor i bardhë, ujë, shkumës c) oksidi i silicit (IV), bakri, azoti d) diamant, dioksid karboni, fluor kaliumi 15. Çfarë ndryshon kur kloruri i amonit formohet nga amoniaku dhe kloruri i hidrogjenit? a) gjendja e oksidimit të atomit të azotit b) gjendja e oksidimit dhe valenca e atomit të azotit c) valencën e atomit të azotit d) gjendja e oksidimit të atomit të hidrogjenit 16. Cila nga grimcat e mëposhtme është formuar nga një mekanizëm dhurues-pranues? a) F 2 b) HF c) BF 4 – d) BF 3 17. Në cilën substancë gjendja e oksidimit dhe valenca e azotit është e barabartë në vlerë absolute? a)N 2 b)NH 3 b)HNO 3 d) NH 4 C1 18. Cila molekulë është më pak e qëndrueshme? a)H 2 O 6) H 2 S B) H 2 Se d) H 2 Te 19. Cila lidhje kimike është më pak e fortë? a) metalike b) hidrogjen b) jonike d) kovalente 20. Atomi i cilit element shfaq prirjen më të madhe për të formuar lidhje jonike? a) C b) Si c) F d) P 21. Si ndryshon polariteti dhe forca e lidhjes në një seri molekulash HF → HC1 → HI? a) polariteti dhe forca e lidhjes rriten b) polariteti rritet, forca zvogëlohet c) ulen si polariteti ashtu edhe forca e lidhjes d) polariteti zvogëlohet, forca rritet 22. Cili lloj i orbitaleve të atomeve të hidrogjenit dhe klorit përkatësisht mbivendosen gjatë formimit të molekulës së klorurit të hidrogjenit? a) s Dhe s b) s Dhe R V) R Dhe R G) fq Dhe s 23. Në cilën molekulë janë të gjitha lidhjet kovalente polare? a) H 2 O 2 b) C 2 H 4 c) C 2 H 2 d) CO 2 24. Cili element ka vlerën më të lartë algjebrike të gjendjes më të lartë të oksidimit? a) fluori b) kromi c) karboni d) klori 25. Cili element ka vlerën më të ulët algjebrike të gjendjes më të ulët të oksidimit? a) azoti b) squfuri c) hidrogjeni d) bromi 26. Në cilin përbërje hidrogjeni ka gjendje oksidimi negativ? a) NH 4 Cl b) CaH 2 c) H 2 O 2 d) HF 27. Në përbërjet BC1 3, Be1 2 dhe SiBr 4, orbitalet valore të atomeve qendrore janë përkatësisht në gjendjet hibride të mëposhtme: a) sp, sp 2, sp 3 V) sp, sp 3, sp 2 b) sp 2, sp, sp 3 G) sp 3 , sp 2 , sp 28. Valenca e azotit në përbërjet e mëposhtme: N 2, NH 3, NH 4 +, CH 3 NH 2, HNO 3 - janë të barabarta, përkatësisht: a) 0, III, IV, V, V c) III, III, IV, III, IV b) I, III, III, IV, IV r) III, III, III, IV, V 29.Karakteristika e saktë e një lidhjeje jonike është: b) i drejtuar, i pangopur c) i drejtuar, i ngopur d) jo-drejtues, i ngopur 30. Karakteristika e saktë e lidhjes kovalente është: a) jo-drejtues, jo i ngopur b) i drejtuar, i pangopur c) i drejtuar, i ngopur d) jo-drejtues, i ngopur 31. Lidhjet e dyfishta midis atomeve ekzistojnë në çdo përbërje të përfshirë në grup: a) CO, CO 2 c) S 8, C 2 H 4 b) C 2 H 2, SO 2 d) CO 2, C 2 H 4 32. Lidhjet e trefishta midis atomeve ekzistojnë në çdo përbërje të përfshirë në grup: a) CO, N 2 b) N 2, SO 2 c) S 8, C 2 H 2 d) CO 2, C 2 H 4 33.Për cilin element gjendja më e lartë e oksidimit është më e madhe se numri i grupit në të cilin ndodhet në sistemin periodik? a) mangani b) ari c) bori d) azoti 34. Një karakteristikë sasiore e elementeve, e cila na lejon të gjykojmë llojin e lidhjes kimike midis atomeve të këtyre elementeve, është: a) rrezja atomike c) elektronegativiteti b) ngarkesa bërthamore d) masa atomike 35. Lidhjet polare të vetme, jopolare të dyfishta, të vetme jopolare, të trefishta ekzistojnë në molekulat e substancave të mëposhtme, përkatësisht: a) HF, C 2 H 4, Br 2, CO c) H 2, CO 2, HC1, N 2 b) HBr, SO 3, N 2, C 2 H 2 d) C1 2, O 2, C 2 H 6, CO 36. Numri i përgjithshëm σ dhe lidhjet π në një molekulë të acidit dikromik janë përkatësisht: a) 10 dhe 4 b) 4 dhe 10 c) 6 dhe 2 d) 2 dhe 6 37. Lëndët e dhëna: klorur ceziumi, bakër, diamant, squfur rombik, akull, oksid natriumi, jod, “akulli i thatë” (CO 2 i ngurtë), grafiti, platini, hidridi i kaliumit. Midis tyre, numri i substancave me një rrjetë kristal atomike është i barabartë me: a) 4 b) 3 c) 2 d)1 38. Lëndët e dhëna: klorur ceziumi, bakër, diamant, squfur rombik, akull, oksid natriumi, jod, “akulli i thatë” (CO 2 i ngurtë), grafiti, platini, hidridi i kaliumit. Midis tyre, numri i substancave me një rrjetë kristalore molekulare është i barabartë me: a) 4 b) 3 c) 2 d) 1 39. Lëndët e dhëna: klorur ceziumi, bakër, diamant, squfur rombik, akull, oksid natriumi, jod, “akulli i thatë” (CO 2 i ngurtë), grafiti, platini, hidridi i kaliumit. Midis tyre, numri i substancave me një rrjetë kristal jonike është i barabartë me: a) 4 b) 3 c) 2 d) 1 40. Substancat e dhëna: klorur ceziumi, bakër, diamant, squfur rombik, akull, oksid natriumi, jod, “akull i thatë” (CO 2 i ngurtë), grafit, platin, hidrid kaliumi. Midis tyre, numri i substancave me një rrjetë kristalore metalike është i barabartë me: a) 4 b) 3 c) 2 d) 1
|

 Në industri, kloruri i amonit merret si nënprodukt në prodhimin e sodës. Në laborator, përbërja mund të sintetizohet nga klori dhe amoniaku, ose duke kaluar amoniak dhe klorur hidrogjeni përmes një tretësire të kripës së tryezës.
Në industri, kloruri i amonit merret si nënprodukt në prodhimin e sodës. Në laborator, përbërja mund të sintetizohet nga klori dhe amoniaku, ose duke kaluar amoniak dhe klorur hidrogjeni përmes një tretësire të kripës së tryezës.