Молекулярная физика. Кипение жидкости
Пусть жидкость занимает часть объема замкнутого сосуда. При любой температуре существует некоторое количество достаточно энергичных молекул внутри жидкости, которые способны разорвать связи с соседними молекулами и вылететь из жидкости. Чем больше температура и при наличии ветра тем быстрее происходит испарение. В то же время в паре, занимающем остальной объем внутри сосуда, всегда найдутся молекулы, которые влетают обратно в жидкость и не могут вылететь обратно. Таким образом, в этом сосуде все время происходят два конкурирующих процесса – испарение и обратная конденсация. Когда число молекул, покидающих жидкость, становится равным числу молекул, возвращающихся обратно, то наступает динамическое равновесие между жидкой и газообразной фазой, говорят, что пар достиг насыщения.
Пар называется ненасыщенным, если его давление меньше давления насыщенного при данной температуре.
Давление насыщенного пара существенно зависит от температуры: чем она выше, тем
больше молекул имеют достаточную энергию, чтобы покинуть жидкость, следовательно, должна возрасти и плотность насыщенного пара.
nkT. Давление пара р0 , при котором жидкость находится в равновесии со своим паром, называется давлением насыщенного пара.
Давление насыщеного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул пара.
AB-от увеличение температуры давление возрастает
ВС-при испарении всей жидкости давление при постоянном объеме
возрастает прямо пропорционально абсолютной температуре
Кипение.
По мере увеличения температуры жидкости интенсивность испарения увеличивается, жидкость начинает кипеть. При кипении по всему объему жидкости образуются быстро растущие пузырьки пара, которые всплывают на поверхность. Температура кипения жидкости остается постоянной. Это происходит потому, что вся подводимая к жидкости энергия расходуется на превращение ее в пар.
В жидкости всегда присутствуют растворенные газы, которые выделяются на дне и стенках сосуда, а также на взвешенных в жидкости пылинках. Пары жидкости, которые находятся внутри пузырьков, являются насыщенными. С увеличением температуры давление насыщенных паров возрастает и пузырьки увеличиваются в размерах. Под действием выталкивающей силы они всплывают вверх. Если верхние слои жидкости имеют более низкую температуру, то в этих слоях происходит конденсация пара в пузырьках. Давление стремительно падает, и пузырьки захлопываются. Захлопывание происходит настолько быстро, что стенки пузырька, сталкиваясь, производят нечто вроде взрыва. Множество таких микровзрывов создает характерный шум. Когда жидкость достаточно прогреется, пузырьки перестанут захлопываться и всплывут на поверхность. Жидкость закипит. Перед закипанием чайник почти перестает шуметь.
Зависимость давления насыщенного пара от температуры объясняет, почему температура кипения жидкости зависит от давления на ее поверхность. Пузырек пара может расти, когда давления насыщенного пара внутри его немного превосходит давление в жидкости, которое складывается из давления воздуха на поверхность жидкости (внешнее давление) и гидростатического давления столба жидкости. Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости. Чем больше внешнее давление, тем выше температура кипения, и наоборот, уменьшая внешнее давление- понижается температура кипения.
У каждой жидкости своя температура кипения, которая зависит от давления насыщенного пара. Чем выше давление насыщенного пара, тем ниже температура кипения соответствующей жидкости, т.к при меньших температурах давление насыщенного пара становится равным атмосферному.
Критическая температура- это температура, при которой исчезают различия в физических свойствах между жидкостью и ее насыщенным паром.
Представление о критической температуре ввел Д. И. Менделеев. При критической температуре плотность и давление насыщенного пара становятся максимальными, а плотность жидкости, находящейся в равновесии с паром, - минимальной. Особое значение критической температуры состоит в том, что при температуре выше критической ни при каких давлениях газ нельзя обратить в жидкость. Газ, имеющий температуру ниже критической, представляет собой ненасыщенный пар.
Статистическая механика позволяет объяснить на основе некоторых моделей не только свойства вещества в газообразном состоянии, но и процессы перехода вещества из одного состояния в другое, в том числе фазовые превращения газ-жидкость, жидкость-твердое тело и т. д.
Фазы и компоненты термодинамической системы. Фазой вещества называется его макроскопическая однородная часть, отделенная от других частей границами раздела. Например, в закрытом сосуде над некоторым количеством воды находится смесь воздуха с водяными парами. Это двухфазная система, состоящая из двух фаз: жидкой (вода) и газообразной (смесь воздуха и паров воды). Если бы воздуха в сосуде не было, то в системе все равно было бы две фазы - жидкая (вода) и газообразная (пары воды), так что разделение вещества на фазы возможно и в однокомпонентной системе, а не только в смеси разных веществ.
Если к воде добавить спирт, то число фаз в системе не изменится, так как при разведении спирта в воде образуется физически однородная жидкость. Если же к воде добавить растительное масло, то получится система с двумя жидкими фазами - маслом и водой.
При подсчете числа фаз не имеет значения, сосредоточена ли определенная фаза в одном месте или состоит из нескольких частей, отделенных одна от другой другими фазами. Так, капельки тумана в воздухе образуют с ним двухфазную систему. Смесь газов, будучи многокомпонентной системой, всегда образует однофазную систему.
Фазовые превращения. Примерами фазовых превращений могут служить изменения агрегатного состояния вещества. Под агрегатными состояниями понимают твердое, жидкое и газообразное состояния вещества. Иногда в качестве четвертого агрегатного состояния вещества выделяют плазму. Твердое и жидкое состояния вещества называют конденсированными.
Испарением или парообразованием называют переход вещества из конденсированного состояния в газообразное. Обратный переход называется конденсацией. Переход из твердого состояния в жидкое называется плавлением, а обратный переход затвердеванием или кристаллизацией.
Твердое состояние одного и того же вещества может реализовываться в нескольких кристаллических модификациях. Превращение модификаций друг в друга тоже дает пример фазового перехода.
Равновесие фаз. При каких условиях различные фазы могут находиться в равновесии? Для механического равновесия давление по разные стороны границы соприкасающихся фаз должно быть одинаковым. Для теплового равновесия фазы должны иметь одинаковую температуру.
Равновесие фаз - это всегда динамическое равновесие, поскольку молекулы, совершая хаотическое тепловое движение, непрерывно переходят через границу из одной фазы в другую и обратно. Но эти потоки компенсируют друг друга.
Испарение и конденсация. Рассмотрим подробнее один из простейших примеров фазовых превращений - испарение жидкости и конденсацию пара.
Количество жидкости, налитой в открытый сосуд, постепенно уменьшается. При этом покидают жидкость преимущественно быстрые молекулы, кинетическая энергия которых достаточна для преодоления сил притяжения со стороны других молекул жидкости в приповерхностном слое. В результате внутренняя энергия жидкости уменьшается, и если не подводить к ней теплоту, то в процессе испарения ее температура будет понижаться.
Одновременно с испарением идет и обратный процесс конденсации, т. е. возвращение части молекул из пара в жидкость. В открытом сосуде испарение обычно не компенсируется конденсацией и количество жидкости уменьшается.
Если сосуд плотно закрыть, то вскоре установится динамическое равновесие и уровень жидкости не будет изменяться. Пар,
находящийся в динамическом равновесии со своей жидкостью, называют насыщенным. паром. Название подчеркивает, что в данном объеме при данной температуре не может находиться большее количество пара.
Наличие других газов или паров над поверхностью жидкости не влияет на процесс образования пара. Максимальное давление пара данного вещества, т. е. его максимальное парциальное давление, равно давлению насыщенного пара соответствующей жидкости и не зависит от присутствия других газов.
Давление насыщенного пара. Будем постепенно уменьшать объем пара над жидкостью, вдвигая закрывающий сосуд поршень. При этом часть вещества перейдет из газообразной фазы в жидкость, но давление пара не изменится, если поддерживается прежняя температура. Это значит, что давление насыщенного пара зависит только от температуры. Такой опытный факт можно качественно объяснить на основе представлений статистической механики.
Число вылетающих из жидкости молекул через участок границы единичной площади не зависит от того, сколько пара находится над жидкостью. В динамическом равновесии число вылетающих и влетающих молекул одинаково. Значит, и число молекул, влетающих в жидкость через единичную поверхность, не зависит от занимаемого паром объема. Так как это число при данной температуре определяется концентрацией молекул пара, то концентрация, а тем самым и давление не зависят от объема, а определяются только температурой. Для каждого вещества давление насыщенного пара при данной температуре имеет свое вполне определенное значение.
С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа. Так происходит потому, что с увеличением температуры давление насыщенного пара растет не только вследствие увеличения средней кинетической энергии молекул, но и вследствие увеличения концентрации молекул, т. е. плотности пара, за счет перехода части вещества из жидкой фазы в газообразную. Именно увеличение концентрации молекул насыщенного пара и является главной причиной роста давления с температурой.
Когда вся жидкость в закрытом сосуде испарится, пар при дальнейшем нагревании перестанет быть насыщенным, и его давление при постоянном объеме будет возрастать пропорционально термодинамической температуре, как и у идеального газа.
Кипение. По мере увеличения температуры интенсивность испарения жидкости в открытом сосуде увеличивается. Наконец, при некоторой температуре жидкость начинает кипеть: по всему ее объему образуются быстро растущие пузырьки пара, поднимающиеся на поверхность. Это значит, что при кипении испарение жидкости происходит не только с ее открытой поверхности, но и внутрь пузырьков. Ясно, что рост пузырьков за счет испарения в них возможен лишь при такой температуре, когда давление внутри пузырька, т. е.
давление насыщенного пара, становится равным давлению жидкости на данной глубине. Поэтому температура кипения жидкости зависит от внешнего давления. На высоте 7 км над уровнем моря температура кипения воды составляет примерно 70 °С. Наоборот, температура кипения в герметически закрытых автоклавах, где поддерживается повышенное давление, значительно выше 100 °С.
Интересными особенностями обладает кипение на границе несмешивающихся жидкостей. Их можно продемонстрировать следующим простым опытом. В стеклянный сосуд наливают некоторое количество четыреххлористого углерода а сверху слой воды. При нормальном атмосферном давлении вода кипит при 100 °С, а четыреххлористый углерод - при Если медленно нагревать сосуд в водяной бане, то но границе раздела этих несмешивающихся жидкостей кипение начинается при Как объяснить это явление?
Кипение наступает, когда давление насыщенного пара сравняется с давлением в жидкости на той глубине, где образуется пузырек. Давление жидкости складывается из атмосферного давления и гидростатического давления столба жидкости. Если высота столба жидкости в сосуде несколько сантиметров, то гидростатическое давление составляет несколько тысячных от нормального атмосферного и его можно не принимать во внимание. Давление насыщенных паров жидкости определяется ее температурой. В воде пузырьки содержат только пары воды, при 100 °С давление насыщенного пара воды равно нормальному атмосферному. В четыреххлористом углероде пузырьки содержат только пары и давление насыщенных паров равно атмосферному при
На границе раздела этих жидкостей пузырьки содержат как пары так и пары воды. Давление в этих пузырьках, на основании закона Дальтона, равно сумме парциальных давлений паров воды и Поэтому давление, равное атмосферному, устанавливается в пузырьках, находящихся на границе, при температуре, меньшей При этой температуре и начинается кипение на границе раздела. Опыт показывает, что это происходит при температуре Эту температуру можно установить без опыта, подбирая такую температуру по таблицам зависимости давления насыщенных паров воды и от температуры, при которой сумма давлений равна атмосферному. При давление паров воды составляет 192 мм рт. ст., а давление паров мм рт. ст. Используя эти цифры, можно сделать вывод, что в каждом пузырьке, образовавшемся на границе раздела, молекул будет почти в три раза больше, чем молекул воды. А так как и масса молекулы четыреххлористого углерода в девять раз больше массы молекулы воды, то его испарение происходит почти в 25 раз быстрее, чем испарение воды. Наблюдая кипение в пограничном слое в течение
некоторого времени, можно убедиться, что нижний слой выкипает значительно быстрее, чем верхний слой воды.
Центры парообразования. Для процесса кипения необходимо, чтобы в жидкости существовали неоднородности - зародыши газообразной фазы, играющие роль центров парообразования. Обычно в жидкости присутствуют растворенные газы, которые выделяются пузырьками на дне и стенках сосуда и на взвешенных в жидкости пылинках. При нагревании эти пузырьки увеличиваются как за счет уменьшения растворимости газов с температурой, так и за счет испарения в них жидкости. Увеличившиеся в объеме пузырьки всплывают под действием архимедовой выталкивающей силы. Если верхние слои жидкости имеют более низкую температуру, то вследствие конденсации пара давление в них резко падает и пузырьки «захлопываются» с характерным шумом. По мере прогревания всей жидкости до температуры кипения пузырьки перестают захлопываться и всплывают на поверхность: вся жидкость закипает.
Перегретая жидкость. Жидкость можно нагреть и до температуры, превышающей температуру кипения при данном давлении. Для этого ее нужно тщательно очистить от растворенных газов и механических примесей. Центры парообразования в такой жидкости практически отсутствуют, и кипение не начинается даже тогда, когда температура заметно превышает температуру кипения. Такая жидкость называется перегретой. Это неустойчивое состояние. Перегретая жидкость бурно закипает при появлении в ней центров парообразования.
Явление быстрого закипания перегретой жидкости используется в пузырьковой камере - современном приборе для регистрации частиц высоких энергий. Прохождение заряженной частицы через перегретую жидкость приводит к образованию вдоль следа частицы зародышей центров кипения. Образующиеся на зародышах пузырьки достигают размеров в доли миллиметра и могут быть сфотографированы при боковом освещении импульсным источником света.
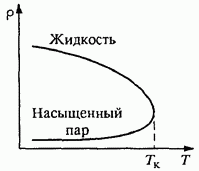
Рис. 80. Зависимость плотности жидкости и ее насыщенного пара от температуры Изучение треков в пузырьковых камерах позволило открыть и исследовать много новых элементарных частиц.
Критическая температура. При увеличении температуры одновременно с ростом плотности насыщенного пара происходит уменьшение плотности жидкости вследствие ее теплового расширения. Если на одном графике изобразить зависимости плотности жидкости и ее насыщенного пара от температуры, то при некоторой температуре Тк, называемой критической, обе кривые сливаются (рис. 80): плотность
жидкости становится равной плотности насыщенного пара. При критической температуре исчезает различие не только в плотности, но и во всех других физических свойствах жидкости и насыщенного пара.
Понятие критической температуры было введено Д. И. Менделеевым. Каждое вещество характеризуется своей критической температурой. Например, у воды это 374,15 °С, а у окиси углерода около 31 °С.
Различие между газом и паром. Существование критической температуры позволяет провести различие между газом и паром. Газ можно перевести в жидкое состояние путем сжатия только при температуре ниже критической. Поэтому вещество в газообразном состоянии при температуре ниже критической и называют паром.
Таким образом, никакой принципиальной разницы между паром и газом нет. Это деление условно и имеет смысл потому, что мы привыкли к существованию в довольно узком интервале температур. Поэтому газом обычно называют вещество, давление насыщенного пара которого при обычных температурах выше атмосферного (например, углекислый газ). Напротив, используют термин «пар», когда при комнатной температуре давление насыщенного пара вещества меньше атмосферного давления (например, водяной пар).
Теплота испарения и конденсации. Фазовые переходы, такие как испарение и конденсация, всегда сопровождаются поглощением или выделением теплоты. Количество теплоты, которое необходимо сообщить веществу для того, чтобы превратить его из жидкого состояния в газообразное при постоянной температуре и постоянном давлении, называется теплотой испарения (или теплотой парообразования). Такое же количество теплоты выделяется при конденсации пара в жидкость при тех же условиях. Различают удельную теплоту испарения (измеряется в джоулях на килограмм) и молярную (измеряется в джоулях на моль).
Теплота испарения зависит от температуры. С ростом температуры она уменьшается и при критической температуре обращается в нуль.
Теплота парообразования представляет собой частный случай теплоты фазового перехода. Другой пример - теплота плавления, поглощаемая при плавлении и выделяющаяся при кристаллизации.
Влажность воздуха. Водяной пар в земной атмосфере, несмотря на огромные открытые водные поверхности, не является насыщенным. Содержание водяного пара в воздухе характеризуется влажностью воздуха. От влажности воздуха во многом зависит состояние биосферы, самочувствие человека, работоспособность технических устройств, сохранность зданий и произведений искусства.
Влажность воздуха характеризуют парциальным давлением паров воды, которое иногда называют абсолютной влажностью. Однако значение абсолютной влажности еще не позволяет судить о том, насколько водяной пар в данных условиях далек от насыщения. Но именно от этого зависит интенсивность испарения воды с открытых поверхностей. Чтобы характеризовать близость состояния водяных паров к насыщению, вводят относительную влажность.
Относительная влажность - это отношение парциального давления водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара при этой температуре. Относительную влажность обычно выражают в процентах:
![]()
Если понижать температуру воздуха при неизменном содержании в ней паров воды (т. е. при неизменной абсолютной влажности), то относительная влажность будет возрастать и при некоторой температуре достигнет т. е. пар станет насыщенным. Эту температуру, при которой содержащийся в воздухе пар становится насыщенным, называют точкой росы. При охлаждении воздуха до точки росы начинается конденсация паров воды. Это проявляется в образовании тумана и выпадении росы.
Измерение влажности воздуха. Для измерения влажности воздуха существуют приборы гигрометры и психрометры. Действие конденсационного гигрометра основано на измерении точки росы, т. е. на измерении температуры охлаждаемой поверхности в тот момент, когда она запотевает. Зная точку росы и температуру воздуха, можно по специальным таблицам определить парциальное давление паров воды и относительную влажность.
Действие психрометра основано на зависимости интенсивности испарения воды от относительной влажности воздуха. Он состоит из двух термометров, шарик одного из которых сухой, а шарик другого обернут полоской влажной ткани, конец которой погружен в воду. По разности показаний сухого и влажного термометров с помощью специальных таблиц определяют влажность воздуха.
Поверхностное натяжение. В термодинамической системе, состоящей из нескольких фаз, всегда имеются границы раздела. С этими межфазными границами связан ряд свойств системы, к обсуждению которых мы и переходим.
В жидкой фазе на молекулы вещества действуют силы притяжения со стороны окружающих молекул. Когда молекула находится в глубине жидкости и удалена от поверхности, то эти силы действуют во все стороны и в среднем уравновешиваются. Если же молекула находится вблизи поверхности, то действие на нее других молекул приводит к появлению равнодействующей силы, направленной внутрь
жидкости. Для увеличения свободной поверхности жидкости часть молекул должна перейти из объема в поверхностный слой, а для этого необходимо совершить некоторую работу. Поэтому существование поверхности жидкости связано с дополнительной энергией.
Поверхностная энергия - это избыток потенциальной энергии молекул в поверхностном слое по сравнению с энергией молекул внутри фаз (т. е. в объеме вдали от границы), обусловленный отмеченным различием межмолекулярных взаимодействий в граничащих фазах.
Сила поверхностного натяжения. Сила поверхностного натяжения - это сила, которая действует вдоль границы раздела, например вдоль поверхности жидкости, перпендикулярно линии (реальной или мысленной), ограничивающей эту поверхность. В существовании силы поверхностного натяжения можно убедиться с помощью следующих простых опытов.
Наиболее наглядны опыты с использованием мыльной пленки. Положим петлю из нитки на мыльную пленку, полученную при обмакивании проволочного каркаса в мыльном растворе (рис. 81). Пока мыльная пленка внутри петли цела, петля сохраняет любую приданную ей форму (рис. 81а). Если же пленку внутри петли проткнуть, то нить принимает форму окружности (рис. 816). Такая форма обеспечивает минимальную площадь оставшейся на каркасе пленки и тем самым минимальное значение ее поверхностной энергии.
Рис. 81. Петля из ннтки на мыльной пленке
Благодаря поверхностному натяжению жидкость в отсутствие внешних сил принимает форму шара, т. е. имеет минимальную при данном объеме поверхность и соответственно минимальную поверхностную энергию. Так бывает в невесомости, например в кабине космического корабля, где невозможно налить воду в стакан, и при свободном падении дождевых капель.
Поверхностная энергия. Количественно поверхностное натяжение а характеризуется отношением модуля силы поверхностного натяжения, действующей на границу поверхностного слоя, к длине границы или, что то же самое, отношением поверхностной энергии к площади поверхности:
![]()
В случае плоской поверхности жидкости сила поверхностного натяжения не зависит от того, насколько поверхность «растянута». Строго говоря, само понятие «растяжение» для такой поверхности
лишено смысла: чтобы увеличивать площадь поверхности, вытягивая в поверхностный слой из объема все новые и новые молекулы, необходимо, в отличие от случая растягивания резиновой пленки, прикладывать постоянную силу, так как поверхностный слой, увеличиваясь по площади, не меняет своих свойств.
Именно это свойство сил поверхностного натяжения приводит к эквивалентности двух определений величины с в формуле (2).
В самом деле, работа, совершаемая при перемещении ограничивающей мыльную пленку перемычки длиной на расстояние х (рис. 82) равна , где - увеличение площади поверхности одной стороны пленки. Эта работа равна приращению поверхностной энергии пленки
Смачивание. Вследствие взаимодействия молекул жидкости с молекулами твердых тел возникает смачивание - явление, приводящее к искривлению свободной поверхности жидкости у поверхности твердого тела.
Рис. 82. К вычислению работы при увеличении поверхности пленки
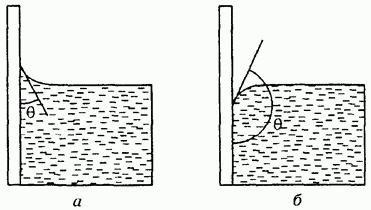
Рис. 83. Краевой угол в случае смачивания (а) и несмачивания (б)
Если сила взаимодействия между молекулами жидкости и твердого тела больше силы взаимодействия между молекулами самой жидкости, то говорят, что жидкость смачивает твердую поверхность. В этом случае угол между плоскостью, касательной к поверхности жидкости, и поверхностью твердого тела, называемый краевым углом или углом смачивания, будет острым (рис. 83а). В противном случае угол будет тупым (рис. 836). При полном смачивании при полном несмачивании Например, вода смачивает чистое стекло и не смачивает поверхность, покрытую парафином.
Смачиванием и несмачиванием объясняются многие хорошо знакомые нам явления. Подъем керосина по фитилю лампы, возможность вытереться полотенцем - это примеры явлений, целиком обусловленных смачиванием. Напротив, плавание покрытой тонким слоем жира стальной иголки на поверхности воды, тефлоновые кастрюли и сковородки, в которых не подгорает пища, бегающие по воде на длинных тонких ногах жуки-водомеры - во всех этих случаях мы сталкиваемся с несмачиванием.
Капиллярные явления. Подъем или опускание жидкости в узких трубках-капиллярах вследствие явления смачивания называются капиллярными явлениями (рис. 84).
Рис. 84. Жидкость в капиллярах
Высоту , на которую поднимается жидкость (плотностью полностью смачивающая стенки капилляра радиуса можно найти, приравнивая вес столбика поднявшейся жидкости силе поверхностного натяжения, действующей по верхнему периметру столбика:
![]()
Капиллярное давление. Искривление поверхности жидкости, вызываемое силами поверхностного натяжения, ведет к появлению избыточного давления в жидкости, называемого капиллярным. В случае сферической поверхности это давление связано с радиусом ее кривизны формулой Лапласа:
Эту формулу легко получить с помощью (3), если учесть, что избыточное гидростатическое давление у основания столба жидкости в капилляре должно компенсироваться изменением давления, обусловленным искривлением свободной поверхности жидкости.
Силе поверхностного натяжения действующей вдоль всей длины границы жидкости со стеклом в зазоре:
![]()
Обратим внимание на то, что эта высота вдвое меньше высоты подъема в капилляре, диаметр которого равен ширине зазора. Соответственно вдвое меньше и величина капиллярного давления, создаваемого цилиндрической поверхностью по сравнению со сферической.
Капиллярные волны. Силы поверхностного натяжения, как и силы тяжести, играют важную роль в образовании волн на поверхности воды. Роль этих сил различна для волн разной длины: для достаточно коротких волн, когда кривизна поверхности жидкости велика, преобладают силы поверхностного натяжения; в случае длинных волн, наоборот, этими силами можно пренебречь. Поэтому мелкая рябь на воде - это по существу капиллярные волны. Соображения размерности позволяют легко найти характер зависимости скорости распространения капиллярных волн от плотности жидкости поверхностного натяжения а и длины волны К. Составляя выражение
![]()
и выписывая соответствующее равенство размерностей, находим
Точная динамическая теория дает для безразмерного коэффициента С значение, равное .
Что такое фазы и что такое компоненты термодинамической системы?
Приведите примеры многофазных однокомпонентных систем и однофазных многокомпонентных систем.
Какие фазовые превращения вы знаете?
При каких условиях различные фазы могут находиться в равновесии?
Что такое насыщенный пар? Объясните, почему его давление не зависит от объема.
Почему давление насыщенного пара с увеличением температуры растет быстрее, чем давление идеального газа?
Объясните, почему температура кипения жидкости зависит от внешнего давления. Почему при определенном давлении температура кипения на границе несмешивающихся жидкостей ниже температуры кипения каждой из них?
Если стакан с водой положить под колокол воздушного насоса, то при быстром откачивании воздуха вода в стакане закипает. Объясните, почему.
На чем основан принцип действия пузырьковой камеры?
Что такое критическая температура? Как связано различие понятий «газ» и «пар» с критической температурой?
Поясните физическую природу теплоты парообразования. Почему она обращается в нуль при критической температуре?
Чему равна разность показаний сухого и влажного термометров в психрометре при относительной влажности воздуха 100 %?
Чем обусловлено различие энергии молекул, находящихся в объеме жидкости и на ее поверхности?
Почему дождевая капля в свободном полете немного сплюснута, а капля, свисающая с водопроводного крана, - вытянута?
Почему тонкая сплошная вертикальная струя воды, вытекающая из крана, на некотором расстоянии распадается на отдельные капли?
Почему у пловца под водой волосы свободно развеваются, и сразу слипаются, как только пловец выйдет из воды?
Какую форму принимает капля воды на горизонтальной деревянной, стеклянной и алюминиевой поверхности?
Почему капля воды на раскаленной сковороде сохраняет шарообразную форму, несмотря на то, что вода смачивает поверхность металла?
Где при выводе формулы (3) использовано предположение о том, что жидкость полностью смачивает внутреннюю поверхность капилляра?
Чем объясняется различие формы поверхности жидкости в узком капилляре и широкой трубке?
При подъеме жидкости в капилляре до высоты силы поверхностного натяжения совершают работу где - масса столба жидкости (докажите это). Но потенциальная энергия этого столба равна только Как это согласуется с законом сохранения энергии?
Кипение - это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
В отличие от испарения, которое происходит при любой температуре жидкости, другой вид парообразования - кипение - возможен лишь при совершенно определенной (при данном давлении) температуре - температуре кипения.
При нагревании воды в открытом стеклянном сосуде можно увидеть, что по мере увеличения температуры стенки и дно сосуда покрываются мелкими пузырьками. Они образуются в результате расширения мельчайших пузырьков воздуха, которые существуют в углублениях и микротрещинах не полностью смачиваемых стенок сосуда.
Пары жидкости, которые находятся внутри пузырьков, являются насыщенными. С ростом температуры давление насыщенных паров возрастает, и пузырьки увеличиваются в размерах. С увеличением объема пузырьков растет и действующая на них выталкивающая (архимедова) сила. Под действием этой силы наиболее крупные пузырьки отрываются от стенок сосуда и поднимаются вверх. Если верхние слои воды еще не успели нагреться до 100 °С, то в такой (более холодной) воде часть водяного пара внутри пузырьков конденсируется и уходит в воду; пузырьки при этом сокращаются в размерах, и сила тяжести заставляет их снова опускаться вниз. Здесь они опять увеличиваются и вновь начинают всплывать вверх. Попеременное увеличение и уменьшение пузырьков внутри воды сопровождается возникновением в ней характерных звуковых волн: закипающая вода шумит.
Когда вся вода прогреется до 100 °С, поднявшиеся вверх пузырьки уже не сокращаются в размерах, а лопаются на поверхности воды, выбрасывая пар наружу. Возникает характерное булькание - вода кипит.
Кипение начинается после того, как давление насыщенного пара внутри пузырьков сравнивается с давлением в окружающей жидкости.
Во время кипения температура жидкости и пара над ней не меняется. Она сохраняется неизменной до тех пор, пока вся жидкость не выкипит. Это происходит потому, что вся подводимая к жидкости энергия уходит на превращение ее в пар.
Температура, при которой кипит жидкость, называется температурой кипения.
Температура кипения зависит от давления, оказываемого на свободную поверхность жидкости. Это объясняется зависимостью давления насыщенного пара от температуры. Пузырек пара растет, пока давление насыщенного пара внутри него немного превосходит давление в жидкости, которое складывается из внешнего давления и гидростатического давления столба жидкости.
Чем больше внешнее давление, тем больше температура кипения.
Всем известно, что вода кипит при температуре 100 °С. Но не следует забывать, что это справедливо лишь при нормальном атмосферном давлении (примерно 101 кПа). При увеличении давления температура кипения воды возрастает. Так, например, в кастрюлях-скороварках пищу варят под давлением около 200 кПа. Температура кипения воды при этом достигает 120 °С. В воде такой температуры процесс варки происходит значительно быстрее, чем в обычном кипятке. Этим и объясняется название «скороварка».
И наоборот, уменьшая внешнее давление, мы тем самым понижаем температуру кипения. Например, в горных районах (на высоте 3 км, где давление составляет 70 кПа) вода кипит при температуре 90°С. Поэтому жителям этих районов, использующим такой кипяток, требуется значительно больше времени для приготовления пищи, чем жителям равнин. А сварить в этом кипятке, например, куриное яйцо вообще невозможно, так как при температуре ниже 100 °С белок не сворачивается.
У каждой жидкости своя температура кипения, которая зависит от давления насыщенного пара. Чем выше давление насыщенного пара, тем ниже температура кипения соответствующей жидкости, т. к. при меньших температурах давление насыщенного пара становится равным атмосферному. Например, при температуре кипения 100 °С давление насыщенных паров воды равно 101 325 Па (760 мм рт. ст.), а паров ртути - всего лишь 117 Па (0,88 мм рт. ст.). Кипит ртуть при 357°С при нормальном давлении.
Кипение - это процесс преобразования жидкости в состояние газа (пара). В жидкости появляются пузырьки пара или паровые полости. Пузырьки становятся больше, в тот момент, когда в них испаряется жидкость. Пар, находящийся в пузырьках превращается в газообразное состояние над жидкостью.
Под кипением понимается интенсивный переход жидкого состояния воды в пар. Переход состоит из преобразования пузырьков пара по всему объему жидкости при некоторой температуре.
В отличие от испарения, которое может протекать при любой температуре воды, такое парообразование как кипение, возможно только при соответствующей температуре. Такая температура называется температурой кипения.
Если нагревать воду в открытом стеклянном сосуде, можно заметить, что при увеличении температуры, вода начинает покрываться маленькими пузырьками. Такие пузырьки образуются вследствие расширения маленьких пузырьков воздуха, которые существуют в микротрещинах сосуда.
Пар, находящийся внутри пузырьков является насыщенным. При повышении температуры, давление насыщенных паров увеличивается. Вследствие этого пузырьки изменяются в размере. После увеличения объема пузырьков, возрастает и действующая на них архимедова сила. При воздействии такой силы пузырьки начинают стремиться к поверхности воды. Если верхний слой не успел прогреться до температуры кипения, то есть до ста градусов Цельсия, часть водяного пара охлаждается и спускается вниз. Пузырьки изменяются в размере, а сила тяжести заставляет их спуститься ниже. Спустившись ниже в более горячие слои воды, они начинают снова подниматься к поверхности. Так как пузырьки увеличиваются и уменьшаются в размерах, внутри воды появляются звуковые волны. Поэтому вода, которая начинает закипать издает характерный шум.
После того когда вся вода достигает температуры 100 градусов, пузырьки достигшие поверхности перестают уменьшаться в размерах. Они начинают лопаться после того как достигают поверхности воды. Из воды начинает выступать водяной пар. Вода издает специфический звук.
В момент кипения, температура жидкости и пара не изменяется. Она остается в одном состоянии, пока вся жидкость не испарится. Это происходит по той причине, что вся энергия расходуется на превращение воды в пар.
Температура, при которой вода начинает кипеть, называется температурой кипения.
Температура кипения напрямую зависит от давления, которое оказывается на поверхность жидкости. Это объясняет зависимостью давления насыщенного пара от температуры. Пузырьки пара постоянно растут. Рост продолжается до тех пор, пока давление насыщенного пара внутри него не будет превосходить давление жидкости. Такое давление складывается из внешнего давления и гидростатического давления жидкости.
Если внешнее давление увеличивается, значит, температура кипения также будет увеличиваться!
Каждый взрослый человек знает, что вода начинает кипеть при температуре равной сто градусов Цельсия. Необходимо помнить, что такая температура кипения будет при нормальном атмосферном давлении, которое равно 101 кПа. Если давление будет увеличиваться, температура кипения изменится.
При уменьшении внешнего атмосферного давления, температура кипения уменьшится. В горной местности вода закипает при температуре равной девяносто градусов. Поэтому людям, которые проживают на данной территории необходимо больше времени, чтобы приготовить пищу. Жители равнины смогут приготовить еду значительно быстрее. При низкой температуре кипения невозможно сварить обычное яйцо, так как белок не может свернуться, если температура ниже 100 градусов.
Каждая жидкость имеет собственную температуру кипения, которая зависит от давления насыщения пара. При повышении давления насыщения пара, температура кипения уменьшается.
Закипание воды это достаточно сложный процесс, который состоит из четырех различных стадий, который отличаются друг от друга:
- На первой стадии, маленькие пузырьки воздуха поднимаются со дна емкости, а также появляется группа пузырьков на стенках емкости.
- На второй стадии кипения происходит увеличение объема пузырьков. Со временем, количество пузырьков, возникающих в воде и стремящихся к поверхности, начинает возрастать. На данной стадии вода начинает издавать мало заметный шум.
- На третьей стадии начинается массовый подъем пузырьков, которые вызывают легкое помутнение воды, а через некоторый промежуток времени «побеление» воды. Такое действие напоминает родник, в котором протекает быстрый поток воды. Такое кипение называется «белым ключом». Такая стадия достаточно короткая. Что касается звука, то он становится похож на звук издаваемый роем пчел.
- На четвертой стадии происходит интенсивное бурление жидкости. На поверхности воды появляется большое количество крупных пузырей, которые начинаю лопаться. Через несколько минут вода начинает брызгаться. Появление брызг характеризует сильно перекипевшую воду. Звук становится резким, равномерность прекращается. Шум напоминает взбесившихся пчел, которые летят друг на друга.






