Klasat kryesore të përbërjeve inorganike. Klasifikimi dhe vetitë e substancave komplekse inorganike. Marrëdhënia Klasifikimi dhe nomenklatura e përbërjeve komplekse inorganike
Aktualisht njihen më shumë se 500 mijë komponime inorganike; është pothuajse e pamundur të dihen formulat, emrat dhe aq më tepër vetitë e tyre. Për ta bërë më të lehtë lundrimin në shumëllojshmërinë e madhe të substancave kimike, të gjitha substancat ndahen në klasa të veçanta, duke përfshirë përbërjet që janë të ngjashme në strukturë dhe veti.
Fillimisht, të gjitha substancat kimike ndahen në të thjeshta dhe komplekse.
Substancat e thjeshta ndahen në metale dhe jometale.
Përveç metaleve dhe jometaleve tipike, ekziston një grup i madh substancash me veti të ndërmjetme, ato quhen metaloidë. .
Substancat komplekse ndahen në katër klasa të përbërjeve kimike: oksidet, bazat, acidet dhe kripërat. . Ky klasifikim u zhvillua nga kimistët e shquar të shekujve 18-19 Antoine Laurent Lavoisier, Mikhail Vasilyevich Lomonosov, Jons Jacob Berzelius, John Dalton.
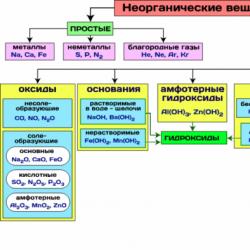
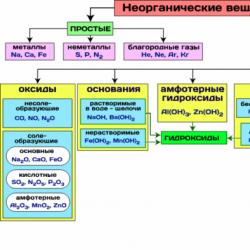
Në Fig. Tabela 8 tregon klasat më të rëndësishme të përbërjeve inorganike.
Figura 8 - Klasat më të rëndësishme të përbërjeve inorganike
Hidroksidet janë një lloj substancash komplekse që përmbajnë atome të disa elementeve E (përveç fluorit dhe oksigjenit) dhe grupeve hidroksil OH; formula e përgjithshme e hidroksideve E(OH) n, Ku n= 1÷6. Forma e hidroksideve E(OH) n thirrur orto-formë; në n> 2 hidroksid mund të gjendet gjithashtu në meta-forma, e cila përfshin, përveç atomeve E dhe grupeve OH, atomet e oksigjenit O, për shembull E(OH) 3 dhe EO(OH), E(OH) 4 dhe E(OH) 6 dhe EO 2 (OH) 2 .
Hidroksidet ndahen në dy grupe me veti kimike të kundërta: hidroksidet acidike dhe bazike.
Hidroksidet acidike përmbajnë atome hidrogjeni, të cilët mund të zëvendësohen me atome metalike, duke iu nënshtruar rregullit të valencës stoikiometrike. Shumica e hidroksideve acide gjenden në meta-forma, dhe atomet e hidrogjenit në formulat e hidroksideve acide janë dhënë në vendin e parë, për shembull, H 2 SO 4, HNO 3 dhe H 2 CO 3, dhe jo SO 2 (OH) 2, NO 2 (OH) dhe CO ( OH) 2. Formula e përgjithshme e hidroksideve acide është H X OE në, ku komponenti elektronegativ EO y x - quhet mbetje acide. Nëse jo të gjithë atomet e hidrogjenit zëvendësohen nga një metal, atëherë ato mbeten si pjesë e mbetjes së acidit.
Emrat e hidroksideve të zakonshme të acidit përbëhen nga dy fjalë: emri i duhur me mbaresën "aya" dhe fjala e grupit "acid".
Emrat e acideve dhe mbetjeve acide janë paraqitur në tabelë. Shtojca A.
Emrat e mbetjeve acide përdoren për të ndërtuar emrat e kripërave.
Hidroksidet bazë përmbajnë jone hidroksid, të cilët mund të zëvendësohen nga mbetje acidike që i nënshtrohen rregullit të valencës stoikiometrike. Të gjitha hidroksidet bazë gjenden në orto-formë; formula e tyre e përgjithshme është M(OH) n, Ku n= 1.2 (më rrallë 3.4) dhe M n+ - kation metalik.
Shembuj të formulave dhe emrave të hidroksideve bazë:
Vetia kimike më e rëndësishme e hidroksideve bazike dhe acidike është ndërveprimi i tyre me njëri-tjetrin për të formuar kripëra. reaksioni i formimit të kripës), Për shembull:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O
Ca(OH) 2 + 2H 2 SO 4 = Ca(HSO 4) 2 + 2H 2 O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Kripërat- lloji i substancave komplekse që përmbajnë M katione n+ dhe mbetjet acidike.
Kripërat me formulë të përgjithshme M X(OE në)n thirrur mesatare kripërat dhe kripërat me atome hidrogjeni të pazëvendësuar, - i thartë kripërat. Ndonjëherë kripërat përmbajnë edhe jone hidroksid dhe/ose oksid; kripëra të tilla quhen kryesore kripërat.
Këtu janë shembuj dhe emra të kripërave:
Kripërat acide dhe bazike mund të shndërrohen në kripëra të mesme me anë të reagimit me hidroksidin e duhur bazë dhe acid, për shembull:
Ca(HSO 4) 2 + Ca(OH) = CaSO 4 + 2H 2 O
Ca 2 SO 4 (OH) 2 + H 2 SO 4 = 2CaSO 4 + 2H 2 O
Ka edhe kripëra që përmbajnë dy katione të ndryshme: ato shpesh quhen kripëra të dyfishta , Për shembull:
Oksidet acidike dhe bazike
Oksidet E X RRETH në- produkte të dehidrimit të plotë të hidroksideve:
Hidroksidet e acidit (H 2 SO 4, H 2 CO 3) korrespondojnë me oksidet e acidit (SO 3, CO 2), dhe hidroksidet bazë (NaOH, Ca(OH) 2) - oksidet bazë (Na 2 O, CaO), dhe gjendja e oksidimit të elementit E nuk ndryshon kur lëviz nga hidroksidi në oksid.
Shembull i formulave dhe emrave të oksideve:
Oksidet acidike dhe bazike ruajnë vetitë e formimit të kripës të hidroksideve përkatëse kur bashkëveprojnë me hidroksidet me veti të kundërta ose me njëri-tjetrin:
N 2 O 5 + 2NaOH = 2NaNO 3 + H 2 O
3CaO + 2H 3 PO 4 = Ca 3 (PO 4) 2 + 3H 2 O
La 2 O 3 + 3SO 3 = La 2 (SO 4) 3
Oksidet dhe hidroksidet amfoterike
Amfotericiteti hidroksidet dhe oksidet - një veti kimike që konsiston në formimin e dy rreshtave të kripërave prej tyre, për shembull, për hidroksidin e aluminit dhe oksidin e aluminit:
(a) 2Al(OH) 3 + 3SO 3 = Al 2 (SO 4) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2 O
(b) 2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Kështu, hidroksidi dhe oksidi i aluminit në reaksionet (a) shfaqin vetitë kryesore hidroksidet dhe oksidet, d.m.th. reagojnë me hidroksidet dhe oksidet acidike, duke formuar kripën përkatëse - sulfat alumini Al 2 (SO 4) 3, ndërsa në reaksionet (b) shfaqin edhe vetitë acidike hidroksidet dhe oksidet, d.m.th. reagojnë me hidroksidin bazë dhe oksidin, duke formuar një kripë - dioksoaluminat natriumi (III) NaAlO 2. Në rastin e parë, elementi alumini shfaq vetinë e një metali dhe është pjesë e përbërësit elektropozitiv (Al 3+), në të dytën - vetia e një jometali dhe është pjesë e përbërësit elektronegativ të formulës së kripës ( AlO 2 -).
Nëse këto reaksione ndodhin në një tretësirë ujore, atëherë përbërja e kripërave që rezultojnë ndryshon, por prania e aluminit në kation dhe anion mbetet:
2Al(OH) 3 + 3H 2 SO 4 = 2 (SO 4) 3
Al(OH) 3 + NaOH = Na
Këtu, jonet komplekse 3+ - kation heksakualumini (III), - - joni tetrahidroksoaluminat (III) janë theksuar në kllapa katrore.
Elementet që shfaqin veti metalike dhe jometalike në përbërje quhen amfoterike, këtu përfshihen elementet e grupeve A të tabelës periodike - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, etj., si. si dhe shumica e elementeve të grupeve B - Cr, Mn, Fe, Zn, Cd, Au, etj. Oksidet amfoterike quhen njësoj si ato bazë, për shembull:
Hidroksidet amfoterike (nëse gjendja e oksidimit të elementit tejkalon + II) mund të gjenden në orto- ose (dhe) meta- forma.
Shembuj të hidroksideve amfoterike:
Oksidet amfoterike jo gjithmonë korrespondojnë me hidroksidet amfoterike, pasi kur përpiqeni të merrni këtë të fundit, formohen okside të hidratuar, për shembull:
Nëse një element amfoterik në një përbërje ka disa gjendje oksidimi, atëherë amfoteriteti i oksideve dhe hidroksideve përkatëse (dhe, rrjedhimisht, amfoteriteti i vetë elementit) do të shprehet ndryshe. Për gjendjet e ulëta të oksidimit, hidroksidet dhe oksidet kanë një mbizotërim të vetive themelore, dhe vetë elementi ka veti metalike, kështu që pothuajse gjithmonë përfshihet në përbërjen e kationeve. Për gjendjet e larta të oksidimit, përkundrazi, hidroksidet dhe oksidet kanë një mbizotërim të vetive acidike, dhe vetë elementi ka veti jo metalike, kështu që pothuajse gjithmonë përfshihet në përbërjen e anioneve.
Oksidet që formojnë kripëra:
1). Oksidet bazë janë oksidet të cilave u korrespondojnë bazat. Oksidet kryesore përfshijnë oksidet e metaleve të grupeve 1 dhe 2, si dhe metalet e nëngrupeve dytësore me valencë I dhe II (përveç oksidit të ZnO - zinkut dhe oksidit BeO - beriliumit): oksidi i litiumit Li 2 O; oksid natriumi Na 2 O; oksid kaliumi K 2 O; oksid bakri CuO; oksid argjendi Ag2O; oksid magnezi MgO; oksid kalciumi CaO; oksid stroncium SrO; oksid ceziumi Cs 2 O; oksid merkuri (2) HgO; oksid rubidiumi Rb 2 O; oksid hekuri (2) FeO; oksid kromi CrO; Oksidi i nikelit NiO.
2). Oksidet acide janë okside që korrespondojnë me acidet. Oksidet e acidit përfshijnë oksidet e jometaleve (përveç atyre që nuk formojnë kripë - indiferente), si dhe oksidet e metaleve të nëngrupeve dytësore me valencë nga V në VII:
monoksidi i karbonit (IV) CO 2 ; oksid squfuri(IV) SO2; oksid squfuri(VI) SO3; oksid silici (IV) SiO2; oksid fosfori(V) P2O5; dioksidi i kromit (VI) CrO3; dioksid mangani(VII) Mn2O7; oksid nitrik NO 2; oksidet e klorit Cl 2 O 5 dhe Cl 2 O 3.
3). Oksidet amfoterike janë okside, të cilat korrespondojnë me bazat dhe acidet. Formohet nga metalet kalimtare. Metalet në oksidet amfoterike zakonisht shfaqin një gjendje oksidimi nga +3 deri në +4, me përjashtim të ZnO, BeO, SnO, PbO: oksidi i zinkut ZnO; oksid kromi(III) Cr2O3; oksid alumini Al 2 O 3 ; oksid kallaji (II) SnO; oksid kallaji (IV) SnO2; oksid plumbi (II) PbO; oksid plumbi(IV) PbO2; oksid titani (IV) TiO2; oksid mangani (IV) MnO2; oksid hekuri (III) Fe 2 O 3 ; oksid beriliumi BeO.
Oksidet që nuk formojnë kripëra
1). Oksidet që nuk formojnë kripëra- këto janë okside indiferente ndaj acideve dhe bazave. Këto përfshijnë oksidet jometale me valencë I dhe II:
monoksidi i karbonit CO; oksid nitrik (II) NO; oksid nitrik (I) N 2 O; oksid silikoni (II) SiO, oksid squfuri (I) S 2 O; oksid hidrogjeni H 2 O.
Bazat. Klasifikimi i bazave
Bazat janë hidroksidet që shpërndahen (ndahen) në një grup hidroksil dhe një kation të ngarkuar pozitivisht. Formula e përgjithshme e bazave është E(OH)m, ku m është gjendja e oksidimit të metalit.
Klasifikimi i bazave sipas forcës:
1). Arsyet e forta.
Bazat e tretshme në ujë quhen alkale:
NaOH - hidroksid natriumi (sode kaustike); KOH - hidroksid kaliumi (potas kaustik); LiOH - hidroksid litiumi; Ba(OH) 2 - hidroksid bariumi; Ca(OH) 2 - hidroksid kalciumi (gëlqere e shuar).
2). Bazat e dobëta:
Mg(OH) 2 - hidroksid magnezi; Fe(OH) 2 - hidroksid hekuri (II); Zn(OH) 2 - hidroksid zinku; NH 4 OH - hidroksid amoniumi; A1 (OH) 3 - hidroksid alumini; Fe(OH) 3 - hidroksid hekuri (III) etj. (shumica e hidroksideve të metaleve).
Klasifikimi i bazave sipas tretshmërisë
Një klasifikim më i pranueshëm i bazave bazohet në tretshmërinë e tyre në ujë.
1) Bazat e tretshme. Alkalet- Këto janë baza që janë të tretshme në ujë. Alkalet përfshijnë hidroksidet e metaleve alkaline dhe alkaline tokësore: LiOH, NaOH, KOH, RbOH, CsOH, CaOH) 2, Sr(OH) 2, Ba(OH) 2.
2). Bazat e pazgjidhshme- këto janë të ashtuquajturat hidrokside amfoterike, të cilat, kur bashkëveprojnë me acidet, veprojnë si baza, dhe me alkalin - si acide.
Klasifikimi i bazave sipas numrit të grupeve hidroksil (OH):
1). Bazat e vetme acide (n = 1)- kjo është një bazë që përmban një grup - (OH): LiOH, KOH, NaOH, NH4OH.
2). Bazat diacid - (n = 2)- kjo është një bazë që përmban dy grupe - (OH): Ba(OH) 2, Mg(OH) 2, Zn(OH) 2, Fe(OH) 2.
3). Bazat triacid - (n = 3)- kjo është një bazë, e cila përfshin tre grupe - (OH): Fe(OH) 3, A1(OH) 3, etj.
Acidet. Klasifikimi i acideve
Acidiështë një substancë komplekse, molekula e së cilës përmban një ose më shumë atome hidrogjeni dhe një mbetje acidi. Acidet klasifikohen sipas kritereve të mëposhtme: a) nga prania ose mungesa e oksigjenit në molekulë dhe b) nga numri i atomeve të hidrogjenit.
a) Klasifikimi i acideve sipas pranisë ose mungesës së oksigjenit në molekulë:
1). Acidet që përmbajnë oksigjen: H2SO4 - acid sulfurik; H2SO3 - acid squfuri; HNO 3 - acid nitrik; H3PO4 - acid fosforik; H 2 CO 3 - acid karbonik; H2SiO3 - acid silicik; HClO 4 - acid perklorik; HClO 3 - trioksoklorat hidrogjeni (V) (acid klorik); HClO 2 - hidrogjen dioksoklorat (III) (acid klor); HClO - oksoklorat hidrogjen (I) (acid hipoklor); H2Cr2O7 - dihidrogjen heptaoksodikromat (VI) (acidi dikromik); H 2 S 4 O 6 - heksaoksotetrasulfat dihidrogjen (acidi tetrationik); H 2 B 4 O 6 - heksaoksotetraborat dihidrogjen (acidi tetrametaborik); H - hidrogjen heksahidroksostibate (V); H3PO3S - acid tiofosforik; HbSO 3 S - acid tiosulfurik; H 3 PO 3 - acid fosforik (fosfonik).
2). Acidet anoksike: HF - acid hidrofluorik; HCl - acid klorhidrik (acidi klorhidrik); HBr - acid hidrobromik; HI - acid hidrojodik; H2S - acid hidrosulfid; HAuCl4 - hidrogjen tetrakloroaurat (III) (acidi kloraurik); HSCN - acid hidrotiocianat; HN3 - acid hidroazidik.
b) Klasifikimi i acideve sipas numrit të atomeve të hidrogjenit:
1). Acidet monobazike- këto janë acide që përmbajnë një jon (H +): HNO 3 - acid nitrik; HF - acid hidrofluorik; HCl - acid klorhidrik; HBr - acid hidrobromik; HI - acid hidrojodik; HClO 4 - acid perklorik; HClO 3 - trioksoklorat hidrogjeni (V) (acid klorik); HClO 2 - hidrogjen dioksoklorat (III) (acid klor); HClO - oksoklorat hidrogjen (I) (acid hipoklor); HAuCl 4 - hidrogjen tetrakloroaurat (III) (acidi kloraurik); H - hidrogjen heksahidroksostibate (V); HSCN - acid hidrotiocianat.
2). Acidet dibazike- këto janë acide që përmbajnë dy jone (H +): H 2 SO 4 - acid sulfurik; H2SO3 - acid squfuri; H2S - acid hidrosulfid; H 2 CO 3 - acid karbonik; H2SiO3 - acid silicik; H2Cr2O7 - dihidrogjen heptaoksodikromat (VI) (acidi dikromik); H 2 S 4 O 6 - heksaoksotetrasulfat dihidrogjen (acidi tetrationik); H 2 B 4 O 6 - heksaoksotetraborat dihidrogjen (acidi tetrametaborik); H 2 SO 3 S - acid tiosulfurik.
3). Acidet tribazike- këto janë acide që përmbajnë tre jone (H +): H 3 PO 4 - acid fosforik; H3BO3 - acid borik; H3AsO4 - acid arseniku; H3PO3S - acid tiofosforik; H 3 AlO 3 - acid ortoalumini; H 3 PO 3 - acid fosforik (fosfonik).
4). Acidet polibazike (polibazike).- këto janë acide që përmbajnë katër ose më shumë jone (H +): H 4 SiO 4 - acid ortosilicik; H 4 CO 4 - acid ortokarbonik; H4P2O7 - acid difosforik (pirofosforik); H6P6O18 - acid heksafosforik; H 6 TeO 6 - acid telurik.
Klasifikime të tjera të acideve:
Nga forca e acidit:
Acidet e forta - shpërndahen pothuajse plotësisht, konstantet e disociimit janë më të mëdha se 1 .
10 -3 (HNO 3); HCl; H2SO4);
Acidet e dobëta - konstanta e disociimit më pak se 1 .
10 -3 (acidi acetik Kd = 1,7 .
10 -5).
Për sa i përket stabilitetit:
Acidet e qëndrueshme (H 2 SO 4);
Acidet e paqëndrueshme (H 2 CO 3).
Duke u përkatur në klasat e përbërjeve kimike:
Acidet inorganike: (HBr); (H2SO4);
Acidet organike: (HCOOH,CH3COOH).
Sipas paqëndrueshmërisë:
Acidet volatile: (HNO 3,H 2 S);
Acidet jo të avullueshme: (H 2 SO 4).
Sipas tretshmërisë në ujë:
Acidet e tretshme (H 2 SO 4);
Acidet e patretshme (H 2 SiO 3).
Kripë.
Kripërat janë substanca në të cilat atomet metalike janë të lidhura me mbetjet acidike. Përjashtim bëjnë kripërat e amonit, në të cilat jo atomet metalike, por grimcat NH4+ shoqërohen me mbetje acidike, për shembull, (NH4)2SO4 - sulfat amoni.
Klasifikimi i kripërave:
1). Kripërat mesatare.
Kripërat mesatare- këto janë substanca komplekse që shpërbëhen në tretësirat ujore në katione metalike dhe anione të mbetjeve acidike, d.m.th. ato janë produkte të zëvendësimit të të gjitha kationeve të hidrogjenit në molekulat e acidit me katione metalike (Na 2 CO 3, K 3 PO 4).
2). Kripërat acidike.
Kripërat e acidit- këto janë produkte të zëvendësimit të pjesshëm të kationeve të hidrogjenit në acide me katione metalike (NaHCO 3, KH 2 PO 4, K 2 HPO 4). Ato formohen kur një bazë neutralizohet nga një tepricë e acidit (d.m.th., në kushtet e mungesës së bazës ose një tepricë të acidit).
3). Kripërat bazë.
Kripërat bazë- këto janë produkte të zëvendësimit jo të plotë të grupeve hidroksil të bazës (OH -) me mbetje acidike (CuOH) 2 CO 3, ConO 3 (OH). Ato formohen në kushte të bazës së tepërt ose mungesës së acidit.
4). Kripërat komplekse.
Kripërat komplekse- kripërat që kanë katione ose anione komplekse në të cilat lidhja formohet nga një mekanizëm dhurues-pranues. Jonet komplekse, duke u kombinuar me jone të tjerë, formojnë kripëra komplekse, për shembull, K 4, Cl, K 2, (Na 2), etj.
Klasifikimi i kripërave sipas numrit të kationeve dhe anioneve të pranishme në strukturë
Dallohen llojet e mëposhtme të kripërave:
1). Kripërat e thjeshta.
Kripërat e thjeshta- këto janë kripëra që përbëhen nga një lloj kationesh dhe një lloj anionesh (NaCl).
2). Kripërat e dyfishta.
Kripërat e dyfishta janë kripëra që përmbajnë dy lloje të ndryshme kationesh. shembuj të kripërave të dyfishta janë (KAl(SO 4) 2 .
12H2O) (shurp kaliumi), KAl(SO4) 2 (sulfat alumini-kalium), MgK2 (SO4) 2, AgK(CN) 2. Kripërat e dyfishta ekzistojnë vetëm në formë të ngurtë.
3). Kripërat e përziera.
Kripërat e përziera- këto janë kripëra që përmbajnë dy anione të ndryshme (Ca(OCl)Cl), Fe(NH 4) 2 (SO 4) 2 [sulfat i hekurit të diamonit (II)], LiAl (SiO 3) 2 (metasilikat alumini- litium), Ca(ClO)Cl (klorur kalciumi-hipoklorit), Na 3 CO 3 (HCO 3) (bikarbonat natriumi-karbonat), Na 2 IO 3 (NO 3) (nitrat natriumi-jodat)
4). Kripërat hidratuese (hidratet kristalore).
Kripërat hidratuese ose hidratet kristalore- këto janë kripëra që përmbajnë molekula të ujit të kristalizimit, për shembull, Na 2 SO 4 10 H 2 O, CaSO 4 ·
2H2O (gipps), MgCl2 ·
KCl ·
6H2O (karnalit), CuSO4 ·
5H2O (sulfat bakri), FeSO4 ·
7H2O (sulfat hekuri), Na2CO3 ·
10H 2 O (sode kristalore).
5). Kripërat e brendshme.
Kripërat e brendshme- këto janë kripëra që formohen nga jone bipolare, domethënë molekula që përmbajnë një atom të ngarkuar pozitivisht dhe një atom negativ (+) NH 3 -CH 2 -COO (-) (jon bipolar i aminoacidit glicinë), (+ ) NH 3 -C 6 H 4 -SO 3 (-) (acid sulfanilik ose taurinë). Taurina- një acid sulfonik i formuar në trup nga aminoacidi cisteinë.
Klasifikimi i substancave inorganike bazohet në aftësinë e tyre për t'u dekompozuar. Substancat e thjeshta, të përbëra nga atome të vetëm një elementi kimik (O 2, H 2, Mg), nuk shpërbëhen. Substancat komplekse të përbëra nga atome të dy ose më shumë elementeve (CO 2, H 2 SO 4, NaOH, KCl) dekompozohen lehtësisht.
E thjeshtë
Klasifikimi i klasave të substancave inorganike përfshin:
- metalet - elementë me përçueshmëri termike dhe elektrike, duktilitet të lartë, lakueshmëri dhe shkëlqim metalik;
- jometalet - Elementet që janë më të brishtë se metalet, nuk kanë përçueshmëri elektrike dhe shfaqin veti oksiduese.

Oriz. 1. Skema e klasifikimit për substancat inorganike.
Metalet ndodhen në këndin e poshtëm të majtë të tabelës periodike, jometalet janë të vendosura në këndin e sipërm të djathtë dhe përfshijnë gazrat fisnikë.

Oriz. 2. Vendndodhja e metaleve dhe jometaleve në tabelën periodike.
Shumë elementë të thjeshtë kimikë kanë alotropi - veti të formimit të disa substancave të thjeshta. Për shembull, kur oksigjenit i shtohet edhe një atom, formohet substanca e thjeshtë ozon (O 3); karboni, në varësi të numrit të atomeve, formon grafit, qymyr ose diamant.
Kompleksi
Substancat komplekse klasifikohen në klasat e mëposhtme:
- oksidet - përbëhet nga dy elementë, njëri prej të cilëve është oksigjeni;
- acidet - përbëhet nga atome hidrogjeni dhe një mbetje acidi;
- bazat - përbëhet nga një metal dhe një ose më shumë grupe hidroksil;
- kripë - përbëhet nga mbetje metalike dhe acide.
Më vete, izolohen hidroksidet amfoterike, të cilat shfaqin vetitë e acideve dhe bazave. Këto janë lëndë të ngurta që janë elektrolite të dobëta. Këto përfshijnë hidroksidet metalike me gjendje oksidimi +3 dhe +4. Përjashtim bëjnë Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2.
Një klasifikim më i detajuar i substancave komplekse është paraqitur në tabelën me shembuj.
|
Pamje |
Nomenklatura |
Vetitë kimike |
Shembull |
|
Oksidet - E x O y |
Oksidi i elementit (gjendja e oksidimit) |
Ekzistojnë okside bazike, të cilat formojnë kripëra kur bashkëveprojnë me acidet dhe okside acidike, të cilat formojnë acide kur ndërveprojnë me bazat. Më vete, izolohen oksidet amfoterike që ndërveprojnë me acidet dhe bazat (kripa formohet) |
Na 2 O - oksid natriumi, Fe 2 O 3 - oksid hekuri (III), N 2 O 5 - oksid nitrik (V) |
|
Bazat - Me(OH) x |
Hidroksidi i metalit (gjendja e oksidimit) |
Në përputhje me tretshmërinë, dallohen alkalet dhe bazat e patretshme në ujë. Alkalet reagojnë me jometalet dhe oksidet acide. Bazat e patretshme reagojnë me acidet dhe mund të dekompozohen në temperatura të larta |
Fe(OH) 2 - hidroksid hekuri (II), Cu (OH) 2 - hidroksid bakri (II), NaOH - hidroksid natriumi |
|
Acidet - H n Ac |
Lexoni në varësi të mbetjeve të acidit |
Ata ndërveprojnë me metalet në të majtë të hidrogjenit në serinë e aktivitetit, me okside dhe kripëra. I aftë për t'u dekompozuar në temperatura të larta |
H 2 SO 4 - acid sulfurik, HCl - acid klorhidrik, HNO 3 - acid nitrik |
|
Kripërat - Fur x (Ac) y |
Mbetja acide e metalit (gjendja e oksidimit) |
Reagon me acide, alkale, metale dhe kripëra |
Na 2 SO 4 - sulfat natriumi, CaCO 3 - karbonat kalciumi, KCl - klorur kaliumi |

Oriz. 3. Lista e emrave të acideve.
Lidhjet gjenetike midis klasave bazohen në transformimin e ndërsjellë të substancave. Gjatë reaksioneve kimike, atomet lëvizin nga një substancë në tjetrën, duke formuar seri gjenetike (seri transformimesh). Kur një metal i shtohet oksigjenit, ai formon një oksid, i cili kur reagon me ujin kthehet në një bazë. Një oksid acidi formohet nga një jometal, i cili reagon me ujin për të formuar një acid. Çdo seri gjenetike përfundon me kripë.
Çfarë kemi mësuar?
Substancat inorganike përfshijnë komponime të thjeshta dhe komplekse. Substancat e thjeshta përbëhen nga atomet e të njëjtit element. Këto përfshijnë metale dhe jometale. Komponimet komplekse përfshijnë substanca që përbëhen nga disa elementë. Këto përfshijnë oksidet, acidet, bazat, kripërat dhe hidroksidet amfoterike. Të gjitha substancat janë të lidhura gjenetikisht me njëra-tjetrën. Nga një substancë e thjeshtë mund të merrni një substancë më komplekse. Kripërat konsiderohen si substancat më komplekse.
Test mbi temën
Vlerësimi i raportit
Vleresim mesatar: 4.6. Gjithsej vlerësimet e marra: 102.
Substancat kimike mund të ndahen në dy grupe të pabarabarta: të thjeshta dhe komplekse.
Substanca të thjeshta përbëhet nga atomet e një elementi (O 2, P 4).
Substancat komplekse përbëhet nga atome të dy ose më shumë elementeve (CaO, H 3 PO 4).
Substancat e thjeshta mund të ndahen në metalet Dhe jometalet.
Metalet- këto janë substanca të thjeshta në të cilat atomet janë të lidhur me njëri-tjetrin me një lidhje kimike metalike. Metalet priren të heqin dorë nga elektronet dhe karakterizohen nga vetitë metalike (shkëlqimi metalik, përçueshmëria e lartë elektrike dhe termike, duktiliteti, etj.).
jometalet – Këto janë substanca të thjeshta në të cilat atomet janë të lidhur me lidhje kovalente (ose ndërmolekulare). Jometalet priren të pranojnë ose tërheqin elektrone. Vetitë jometalike janë aftësia për të pranuar ose tërhequr elektrone.
Të gjithë elementët në Tabelën Periodike të Elementeve Kimike (PSCE) ndodhen ose në nëngrupi kryesor, ose V anësor. Në forma të ndryshme të PSCE-së afatshkurtër, nëngrupet kryesore dhe dytësore janë të vendosura ndryshe. Ekziston një mënyrë e thjeshtë që do t'ju lejojë të përcaktoni shpejt dhe me besueshmëri se cilit nëngrup i përket një element. Fakti është se të gjithë elementët e periudhës së dytë ndodhen në nëngrupin kryesor. Ata elementë që ndodhen në qelizë saktësisht nën elementët e periudhës së dytë (në të djathtë ose në të majtë) i përkasin nëngrupit kryesor. Pjesa tjetër shkon në anën.
Për shembull , në tabelën periodike, që përdoret në Provimin e Bashkuar të Shtetit në kimi, elementi numër 32, galium, ndodhet në qelizën në të djathtë, saktësisht nën elementin përkatës të periudhës së dytë, bor. Prandaj, galiumi i përket nëngrupit kryesor. Por skandiumi, elementi numër 21, ndodhet në qelizën në të majtë. Prandaj, skandiumi i përket nëngrupit dytësor.
Jometalet ndodhen në nëngrupet kryesore, në këndin e sipërm të djathtë të PSHE. Të gjitha metalet përfshijnë elementet e nëngrupeve anësore Dhe elementet e nëngrupeve kryesore të vendosura në pjesën e poshtme të majtë të PSHE. Metalet dhe jometalet zakonisht ndahen duke tërhequr një vijë konvencionale nga beriliumi në astatine. Figura tregon ndarjen e saktë në metale dhe jometale. Jometalet janë të ngjyrosura.
Klasat kryesore të substancave komplekse janë oksidet, hidroksidet, kripë.
Oksidet- këto janë substanca komplekse që përbëhen nga atome të dy elementeve, njëri prej të cilëve është oksigjeni, i cili ka një gjendje oksidimi prej -2.
Në varësi të elementit të dytë, oksidet shfaqin veti të ndryshme kimike. Disa okside korrespondojnë me hidroksidet (oksidet që formojnë kripëra), dhe disa jo (oksidet që nuk formojnë kripë).
Oksidet që formojnë kripëra ndahet në bazë, amfoterike dhe acidike.
Oksidet bazë janë okside që shfaqin veti themelore karakteristike. Këto përfshijnë oksidet e formuara nga atomet metalet me gjendja e oksidimit +1 dhe +2 . Për shembull, oksid litiumi Li 2 O, oksid hekuri (II) FeO.
Oksidet acidike janë okside që shfaqin veti acidike. Këto përfshijnë oksidet e formuara nga atomet metale me gjendje oksidimi +5, +6 dhe +7 , si dhe atomet jometale me çdo shkallë oksidimi . Për shembull, oksid klori (I) Cl 2 O, oksid kromi (VI) CrO 3.
Oksidet amfoterike janë okside që shfaqin veti bazike dhe acidike. Këto janë okside metale me gjendje oksidimi +3 dhe +4 , si dhe katër okside me gjendje oksidimi +2: ZnO, PbO, SnO dhe BeO .
Oksidet që nuk formojnë kripëra nuk shfaqin veti karakteristike bazike ose acidike; hidroksidet nuk korrespondojnë me to. Katër okside klasifikohen si jokripë-formuese: CO, NO, N 2 O dhe SiO .
Ka edhe okside të ngjashme me kripërat, d.m.th. si kripë (dyfish).
Dyfishtë oksidet - Këto janë disa okside të formuara nga një element me gjendje të ndryshme oksidimi. Për shembull, magnetit ( mineral hekuri magnetik) FeO·Fe 2 O 3.

Algoritmi për përcaktimin e llojit të oksidit: ne fillim përcaktoni se cili element formon oksidin - metalike ose jo metalike. Nëse është metal, atëherë përcaktojmë gjendjen e oksidimit, pastaj përcaktojmë llojin e oksidit. Nëse është një jometal, atëherë oksidi është acid (përveç nëse ky është një përjashtim).
Hidroksidet- këto janë substanca komplekse që përmbajnë grupin E-O-H. Hidroksidet përfshijnë bazat, hidroksidet amfoterike dhe acidet që përmbajnë oksigjen.
Çdo oksid që formon kripë korrespondon me një hidroksid:
oksid bazë korrespondon me hidroksid bazë ,
oksid acidi korrespondon me hidroksid acid ,
oksid amfoterik korrespondon hidroksid amfoterik .
Për shembull, oksidi i kromit (II) CrO është bazik; ai korrespondon me një bazë hidroksid. Formula e hidroksidit është e lehtë për t'u marrë duke shtuar thjesht grupin hidroksid OH në metal: Cr(OH) 2 .
Oksidi i kromit (VI) është acid, korrespondon me acidin hidroksid H 2 CrO 4, dhe mbetja acidike është joni kromat CrO 4 2-.
Nëse të gjithë indekset janë shumëfish të 2, atëherë ne i ndajmë të gjithë indekset me 2.
Për shembull: N 2 O 5 + H 2 O → H 2 N 2 O 6, pjesëtojeni me 2, marrim HNO 3. Pra marrim meta-formula acidet. Nëse shtojmë edhe një molekulë uji, marrim formula orto acidet.
Për shembull: oksid P 2 O 5 , metaformë: HPO 3 . Shtoni ujë, në formë orto: H 3 PO 4. Forma orto është e qëndrueshme ndaj fosforit dhe arsenikut.
Oksidi i kromit (III) - Cr 2 O 3 - është amfoterik, korrespondon me një hidroksid amfoterik, i cili mund të veprojë edhe si bazë edhe si acid: Cr(OH) 3 = HCrO 2, mbetje acidike kromit: CrO 2 -.
Marrëdhënia midis oksideve dhe hidroksideve:
Arsye(hidroksidet bazë) janë substanca komplekse që kur shpërndahen në tretësirat ujore si anione (jone negative), formojnë vetëm jone hidroksid OH - .
Bazat mund të ndahen në ato që janë të tretshme në ujë ( alkalet ), i pazgjidhshëmnë ujë dhe në mënyrë spontaneduke u dekompozuar .
TE dekompozohet në ujë (i paqëndrueshëm) bazat përfshijnë hidroksid amoniumi, hidroksid argjendi (I), hidroksid bakri (I). Në një tretësirë ujore, komponime të tilla dekompozohen pothuajse në mënyrë të pakthyeshme:
NH 4 OH → NH 3 + H 2 O
2AgOH → Ag 2 O + H 2 O
2CuOH → Cu 2 O + H 2 O
Bazat me një grup OH - monoacid(Për shembull, NaOH), me dy - diacid(Ca(OH)2) dhe me tre - triacid(Fe(OH) 3).
Acidet- këto janë substanca komplekse që, kur shpërndahen në tretësira ujore, formojnë vetëm jone hidronium H 3 O + (H +) si katione. Acidet përbëhen nga hidrogjeni H+ dhe një mbetje e acidit.
Sipas numrit të atomeve të hidrogjenit që mund të zëvendësohen me metale, acidet ndahen në monobazike (HNO3), dybazike(H 2 SO 4), tribazike (H 3 PO 4), etj.
Acidet gjithashtu mund të ndahen në të forta dhe të dobëta.
Acidet e forta. Kjo perfshin:
- Acidet anoksike: HCl, HBr, HI. Acidet e mbetura pa oksigjen janë zakonisht të dobëta.
- Disa acide më të larta që përmbajnë oksigjen: H2SO4, HNO3, HClO4 dhe etj.
Acidet e dobëta . Kjo perfshin:
- Acidet e dobëta dhe të tretshme : Kjo H3PO4, CH3COOH, HF dhe etj.
- Acidet e paqëndrueshme ose të paqëndrueshme : H2S- gaz; H2CO3 H 2 CO 3 → H 2 O + CO 2; H2SO3- zbërthehet në ujë dhe oksid: H 2 SO 3 → H 2 O + SO 2.
- Acidet e patretshme në ujë : H2SiO3, H3BO3 dhe të tjerët.
Një teknikë e thjeshtë ju lejon të përcaktoni nëse acidi para jush është i fortë apo i dobët. Ne e zbresim numrin e atomeve H nga numri i atomeve O në acid. Nëse marrim numrin 2 ose 3, atëherë acidi të fortë. Nëse 1 ose 0 - atëherë acid i dobët.
Kripërat– substanca komplekse që përbëhen nga një kation metalik (ose katione të ngjashme me metalin, për shembull, joni i amoniumit NH 4 +) dhe një anion i mbetjeve acidike. Kripërat quhen edhe substanca që mund të përftohen nga bashkëveprimi i acideve dhe bazave me çlirimin e ujit.
Nëse i konsiderojmë kripërat si produktet e reaksionit acid-bazë, më pas kripërat ndahen në mesatare , i thartë Dhe bazë .
Mesatare kripë – produkte të zëvendësimit të plotë të kationeve të hidrogjenit në acid me katione metalike ( Për shembull , Na 2 CO 3, K 3 PO 4).
I thartë kripë – produktet e zëvendësimit jo të plotë të kationeve të hidrogjenit në acid me katione metalike ( Për shembull , NaHCO3, K2HPO4).
bazë kripë - produkte të zëvendësimit jo të plotë të grupeve hidroksil të bazës me anione të mbetjeve acidike ( Për shembull, malakit (CuOH)2CO3).
Sipas numrit të kationeve dhe anioneve kripërat ndahen në:
Kripërat e thjeshta – i përbërë nga një kation i një lloji dhe anion i një lloji ( Për shembull, klorur kalciumi CaCl2).
Kripërat e dyfishta janë kripëra të përbëra nga dy ose më shumë katione të ndryshme dhe një anion i të njëjtit lloj ( Për shembull, shap kaliumi - KAl(SO 4) 2).
Kripërat e përziera janë kripëra të përbëra nga një kation i një lloji dhe dy ose më shumë anione të llojeve të ndryshme ( Për shembull, klorur kalciumi-hipoklorit Ca(OCl)Cl).
Në bazë të veçorive strukturore dallojnë edhe hidratohem kripë dhe komplekse kripë.
Kripërat hidratuese (hidratet e kristalit) - këto janë kripëra që përmbajnë molekula të ujit të kristalizimit ( Për shembull, dekahidrat sulfat natriumi Na 2 SO 4 10 H 2 O).
Kripërat komplekse janë kripëra që përmbajnë një kation kompleks ose anion kompleks ( K3, (OH) 2).
Përveç klasave kryesore të përbërjeve inorganike, ka një numër të madh të tjerash. Për shembull, komponimet binare të elementeve me hidrogjen.
Komponimet e hidrogjenit janë substanca komplekse të përbëra nga dy elementë, njëri prej të cilëve është hidrogjeni. Hidrogjeni formon hidride të ngjashme me kripën dhe komponime hidrogjeni të paqëndrueshme.
Hidride të ngjashme me kripën EN x janë përbërje të metaleve të grupit IA, IIA dhe aluminit me hidrogjen. Gjendja e oksidimit të hidrogjenit është -1. Për shembull, hidridi i natriumit NaH.
Komponimet e avullueshme të hidrogjenit H x E janë komponime të jometaleve me hidrogjen në të cilat gjendja e oksidimit të hidrogjenit është +1. Për shembull, amoniak NH 3, fosfinë PH 3.
Kimia studion transformimet e substancave kimike, nga të cilat sot njihen më shumë se 20 milionë. Prandaj, klasifikimi i përbërjeve kimike është i rëndësishëm, d.m.th., kombinimi i tyre në grupe ose klasa që kanë veti të ngjashme. Ky mësim do t'ju ndihmojë të studioni klasifikimin modern të substancave inorganike dhe t'ju prezantojë me rregullat për përpilimin e emrave të tyre duke përdorur formula kimike.
Tema: Klasat kryesore të përbërjeve, vetitë e tyre dhe reaksionet tipike
Mësimi: Klasifikimi dhe nomenklatura e substancave inorganike
Substancat inorganike zakonisht ndahen në dy grupe sipas përbërjes së tyre: një grup i vogël substancash të thjeshta (janë rreth 400 të tilla) dhe një grup shumë i madh substancash komplekse. Substancat e thjeshta përbëhen nga një element kimik, ndërsa substancat komplekse nga disa.
Të gjitha substancat e thjeshta mund të ndahen në metale dhe jometale, pasi vetitë e tyre ndryshojnë ndjeshëm. Metalet kanë një shkëlqim metalik, përçueshmëri të lartë termike dhe elektrike, janë duktile dhe shfaqin veti restauruese. Jometalet kanë veti fizike dhe kimike shumë të ndryshme, por, si rregull, në gjendje të ngurtë janë të brishtë dhe nuk e përcjellin mirë elektricitetin dhe nxehtësinë.
Kufiri ndërmjet metaleve dhe jometaleve është arbitrar. Ka substanca që kanë vetitë e metaleve dhe jometaleve. Për shembull, arseniku gri ka një shkëlqim metalik dhe përçueshmëri elektrike (Fig. 1), ndërsa një modifikim tjetër alotropik - arseniku i verdhë - ka veti thjesht jometalike.
Oriz. 1. Arsenik gri
Substancat komplekse zakonisht ndahen në klasa: oksidet, acidet, bazat, hidroksidet amfoterike dhe kripërat (Figura 2). Ky klasifikim është i papërsosur, sepse në të nuk ka vend për amoniak, përbërje metalike me fosfor, azot, karbon etj.

Oriz. 2. Klasifikimi i substancave inorganike
Oksidet mund të jetë kripëformues ose jokripformues. Oksidet që formojnë kripë korrespondojnë me hidroksidet dhe kripërat me një element në të njëjtën gjendje oksidimi si në oksid. Oksidet që nuk formojnë kripëra nuk kanë hidrokside dhe kripëra përkatëse. Ka pak okside të tilla: N 2 O, NO, SiO, CO.
Oksidet kripëformuese, në varësi të karakterit të tyre acido-bazik, ndahen në acidike, amfoterike dhe bazike.
Oksidet bazë formohen nga metale me gjendje të vogla oksidimi +1, +2. Oksidet amfoterike formohen nga metalet kalimtare me gjendje oksidimi +3, +4, si dhe Be, Zn, Sn, Pb. Oksidet acidike formohen nga jometalet, si dhe metalet me gjendje oksidimi më të madhe se +4. Oriz. 3.

Oriz. 3. Klasifikimi i oksideve
Acidet janë substanca komplekse të përbëra nga atome hidrogjeni që mund të zëvendësohen nga metale dhe mbetje acide. Acidet mund të ndahen në grupe sipas përmbajtjes së oksigjenit: që përmbajnë oksigjen (për shembull, HNO 3, H 2 SO 4, H 3 PO 4) dhe pa oksigjen (HI, H 2 S). Oriz. 4.

Oriz. 4. Klasifikimi i acideve
Bazat janë substanca komplekse të përbëra nga katione metalike dhe një ose më shumë anione hidroksid. Klasifikimi i bazave mund të bazohet në karakteristika të ndryshme. Për shembull, marrëdhënia e tyre me ujin. Në bazë të këtij kriteri, bazat ndahen në të tretshme në ujë (alkale) dhe të patretshme në ujë. Oriz. 5.

Oriz. 5. Klasifikimi i bazave
Hidroksidet amfoterike janë substanca komplekse që kanë vetitë e acideve dhe bazave, dhe për këtë arsye formulat e tyre mund të shkruhen në forma të ndryshme:
Zn(OH) 2 = H 2 ZnO 2
forma e bazës formë acidi
Ekzistojnë disa lloje kripërash (Fig. 6).

Oriz. 6. Llojet e kripërave
Kripërat mesatare përbëhen nga katione metalike (ose amonium) dhe anione të mbetjeve acidike. Kripërat acidike, përveç kationeve metalike, përmbajnë katione hidrogjeni dhe një anion të një mbetjeje acidi. Kripërat bazë përmbajnë anione hidroksid.
Nëse një kripë formohet nga dy lloje kationesh metalike dhe një anion, atëherë ajo quhet e dyfishtë. Për shembull, sulfat alumini-kalium KAl(SO 4) 2.
Kripërat me dy anione të ndryshme dhe një kation quhen të përziera. Për shembull, Ca(OCl)Cl është klorur kalciumi-hipoklorit.
Kripërat komplekse përmbajnë një jon kompleks, i cili zakonisht mbyllet në kllapa katrore.
Bibliografi
- Kuznetsova N.E., Litvinova T.N., Levkin A.N. Kimia: Klasa e 11-të: Libër mësuesi për nxënësit e arsimit të përgjithshëm. themelimi (niveli i profilit): në 2 pjesë. Pjesa 2. - M.: Ventana-Graf, 2008. (§55)
- Radetsky A.M. Kimia. Material didaktik. Klasat 10-11. - M.: Arsimi, 2011.
- Khomchenko I.D. Koleksion problemesh dhe ushtrimesh në kimi për shkollën e mesme. - M.: RIA “Vala e Re”: Botues Umerenkov, 2008. (f. 27-30)
- Enciklopedi për fëmijë. Vëllimi 17. Kimia / Kapitulli. ed. V.A. Volodin, Ved. shkencore ed. I. Leenson. - M.: Avanta+, 2003. (f. 156-159)