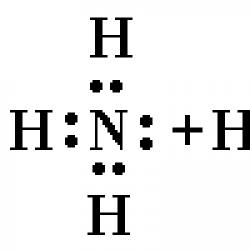Legătură chimică în clorură de amoniu. Tipuri de legături chimice. Proprietățile chimice ale clorurii de amoniu
§5. Iar pentru săruri, cea tradițională este o legătură ionică
Ce tip de legătură chimică va avea dacă este formată din atomi de elemente foarte diferiți în electronegativitate - de exemplu, un metal alcalin sodiuși halogen clor?
Electronul atomic sodiu N / A, situat la nivelul de valență exterior, este un mare fan al plimbărilor prin cartier și de multe ori chiar uită să se întoarcă acasă la nucleul său atomic nativ. Și apoi atomul de sodiu rămâne fără electronul său rătăcit și se transformă în cation Na+:
Na 0 - 1 e− = Na +
Șapte electroni ai unui atom clor Cl Dimpotrivă, sunt corpuri de casă incorigibile; nu le place să viziteze, dar primesc cu plăcere oaspeții. Dacă un electron vecin se întoarce spre ei, înseamnă atomul clor se va transforma in anion Cl¯, care se numește de obicei clorură-ion:
CI0 + 1 e− = Cl −
Ionii cu sarcină opusă se vor atrage reciproc; se formează Legătura ionică Na+ ~~~~ Cl −. Deci se dovedește clorura de sodiu NaCl, toată lumea știe sare.
Sarea naturală de masă este un mineral.
În natură, acest mineral este format din apă sărată de mare sau de lac. Când se răcește sub un strat de soluție de sare, i se descoperă cristalele - cuburi transparente clorura de sodiu. Ionii care alcătuiesc clorura de sodiu, formă cristal ionic, constând din cationi sodiu Na+Și anioni de clorură Cl −.
Când se formează un solid din ioni dizolvați, cationii și anionii sunt aranjați în cristal nu la întâmplare, ci în așa fel încât sarcinile pozitive și negative să alterneze unele cu altele. Atunci va fi puternic celulă de cristal sare NaCl, format din ioni.
Cristalele altor săruri sunt construite într-un mod similar - bicarbonat de sodiu Na2CO3 (sifon), Clorură de amoniu NH4Cl (amoniac), nitrat de argint AgNO3 (lapis) și multe altele.
Este adevărat că toate sărurile sunt construite din ioni individuali care există singuri? Adevărat, dar există un mic „dar”...
Cationul de sare reține o parte din norul de electroni, deoarece chiar și cel mai obraznic electron se întoarce acasă din când în când. Dar o parte foarte mare din acest nor este deplasată către anionul de sare. Prin urmare, se ia în considerare legătura ionică caz limitativ al legăturii polare covalente.
DEFINIȚIE
Amoniu– un ion poliatomic încărcat pozitiv.
Formula chimica NH4+
Ionul de amoniu NH 4 + este un tetraedru regulat cu atomi în centru și atomi la vârfurile tetraedrului.
În molecula de amoniac NH 3 trei perechi de electroni formează trei legături N – H, a patra pereche de electroni aparținând atomului de azot este singură. Cu ajutorul acestei perechi de electroni se formează o legătură cu un ion de hidrogen, care are un orbital gol:

Astfel, în ionul de amoniu se formează trei legături covalente prin mecanismul de schimb, iar una prin mecanismul donor-acceptor. Mecanismul de formare nu afectează caracteristicile legăturii; toate legăturile din cationul de amoniu sunt echivalente.
Compuși de amoniu
Cationul de amoniu poate forma compuși de amoniu cu diverși contraioni, în care un atom de azot încărcat pozitiv este legat covalent de ioni de hidrogen și (sau) radicali organici și legat ionic de un anion.
Compuși anorganici de amoniu
Hidrat de amoniac(hidroxid de amoniu, apă amoniacală, hidroxid de amoniu, hidroxid de amoniu). Formula: NH3H2O
Se formează atunci când amoniacul reacţionează cu apa. O bază slabă se disociază în apă pentru a forma cationi de amoniu și ioni de hidroxid:
Reacția este reversibilă, prin urmare soluțiile apoase de hidroxid de amoniu au întotdeauna un miros înțepător caracteristic de amoniac.
Săruri de amoniu
Toate sărurile de amoniu au proprietăți similare cu sărurile de sodiu corespunzătoare. Se dizolvă bine în apă, se disociază complet într-o soluție apoasă și se descompun când sunt încălzite:
În soluție se hidrolizează prin cationi:
Compuși organici de amoniuîmpărțit la numărul de radicali organici asociați atomului de azot în primari (R 1 NH 3) + X –, secundari (R 1 R 2 NH 2) + X –, terțiari (R 1 R 2 R 3 NH) + X – , şi cuaternar (R1R2R3R4N) + X – .
Compușii de amoniu primari, secundari și terțiari pot fi considerați săruri ale aminelor corespunzătoare; ei pot fi preparați prin reacția acestor amine cu acizi:
unde R1, R2, R3 sunt radicali organici sau hidrogen, X este anionul reziduului acid.
Reacție calitativă pentru ionii de amoniu - interacțiunea cu alcalii cu eliberarea de amoniac:
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | Ce valoare pH (mai mult sau mai mică de 7) are o soluție apoasă de clorură de amoniu? Notați ecuațiile moleculare și ion-moleculare ale hidrolizei. |
| Soluţie | NH 4 Cl este o sare a unei baze slabe și a unui acid puternic, deci hidroliza are loc prin cation. Ecuația moleculară: Ecuația ionică completă: Scurtă ecuație ionică: În timpul procesului de hidroliză s-a format hidrogen (H +), astfel încât soluția are un mediu acid (pH |
| Răspuns | pH-ul soluției de clorură de amoniu este mai mic de 7. |
EXEMPLUL 2
| Exercițiu | Ce masă de sare se formează prin interacțiunea a 44,8 litri de amoniac și 33,6 litri de acid clorhidric (condiții normale)? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soluţie | Să scriem ecuația reacției: Masele molare de amoniac, acid clorhidric și sarea rezultată, clorură de amoniu (NH 4 Cl), sunt egale. Legătură chimică. Celulă de cristal Răspunsurile la sarcini sunt un cuvânt, o frază, un număr sau o secvență de cuvinte, numere. Scrieți răspunsul fără spații, virgule sau alte caractere suplimentare. Începutul formei 1 Clorura de amoniu conține legături chimice: 1. ionic 2. polar covalent 3. nepolar covalent 4. Hidrogen 5. metal 2 Legăturile de hidrogen intermoleculare în stare lichidă sunt caracteristice pentru: 1. hidrogen 2. apă 3. amoniac 4. acetaldehidă 5. izobutan 3 Legăturile chimice nepolare covalente se găsesc în substanțe: 1. fosfor alb 2. acid fosforic 3. amoniac 4. alcool etilic 5. sulf rombic 4 Din lista furnizată, selectați doi compuși care conțin o legătură chimică ionică. 1. Ca(ClO 2 ) 2 2. HCIO 3 3. NH 4 CI4.HCIO 4 5. C l2O 7 5 Din lista furnizată, selectați doi compuși care conțin legătură chimică covalentă nepolară. 1. Ca 2. N 2 3. AlCl 3 4. HCIO 4 5. Cl 2 6 Sulfatul de potasiu conține legături chimice: 1. ionic 2. covalent nepolar 3. covalent polar 4. hidrogen 5. metal 7 Atât legăturile chimice ionice, cât și cele covalente sunt prezente în substanță: 1. HCI 2. H 2 ASA DE 4 3. NaOH 4. NH 4 Br 5. C 2 N 5 EL 8 Din lista propusă, selectați doi compuși dintre moleculele cărora a legătură de hidrogen. 1. fenol 2. dietil eter 3. acetat de etil 4. aldehida formica 5. acid formic 9 Din lista furnizată, selectați doi compuși care conțin un covalent legătură chimică polară. 1. CaCl 2 2. HCl 3. BaO 4. KSIO 4 5. Cl 2 10 Au o structură nemoleculară: 1. hidroxid de potasiu 2. amoniac 3. acid acetic 4. acid azotic 5. grafit 11 Legăturile ionice se realizează în fiecare dintre cele două substanțe: 1. Al 2 O 3 ȘiFeCl 3 2.K 2 SȘiNaNO 3 3. KNO 2 si nu 2 4. HF și HCI 5. NaBr și NH 4 F 12 Rețeaua cristalină atomică în stare solidă are: 1. oxigen 2. fosfor alb 3. fosfor roșu 4. diamant 5. clorură de sodiu 13 Din lista furnizată, selectați doi compuși în care se formează o legătură chimică datorită unei perechi de electroni în comun. 1. Ca 2. H 2 O 3. NaCl 4. CaO 5. Cl 2 14 Structura moleculară este: 1. propanol-2 2. acetat de potasiu 3. dioxid de carbon 4. metoxid de sodiu 5. carbonat de calciu 15 Toate substanțele cu rețele cristaline ionice 1. dur 2. plastic 3. relativ volatil 4. foarte solubil în apă 5. au puncte de topire ridicate 16 Din lista furnizată, selectați doi compuși ale căror molecule formează o legătură de hidrogen. 1. metan 2. silan 3. amoniac 4. fosfină 5. apă Sfârșitul formularului Clorura de amoniu (clorura de amoniu, amoniac) este un compus anorganic utilizat pe scară largă într-o varietate de domenii. Din punct de vedere chimic, este o sare de amoniu; formula NH4Cl. Clorura de amoniu era deja cunoscută în Grecia Antică și Egiptul Antic. Unul dintre numele sale, „amoniac” provine de la „nushadir” egiptean - o substanță pe care preoții o colectau pe pereții peșterilor pentru a-și inspira vaporii înainte de ceremonie și pentru a se acorda pentru a comunica cu forțele divine. „Amoniac” își are numele de la zeul egiptean al soarelui Amon. În Grecia Antică, substanța era extrasă din funingine care se forma pe pereții coșurilor de fum ca urmare a arderii bălegarului de cămilă, care servea drept combustibil pentru greci (clorura de amoniu se obține din descompunerea excrețiilor animale și umane). Clorura de amoniu apare in mod natural in pesterile vulcanice si in apropierea fisurilor din scoarta terestra, sub forma de placi sau cruste. ProprietățiNH4Cl este o pulbere cristalină albă (reactivul de calitate tehnică poate fi gălbui sau roz), ușor higroscopică, inodoră și cu gust sărat. Se dizolvă bine în apă și amoniac lichid; cu creșterea temperaturii, solubilitatea în apă crește. Reacționează cu alcalii formând sare, apă și amoniac. Reactivul se dizolvă într-o măsură mult mai mică în alcooli etilici și metilici. Arsuri cu degajarea de fum alb gros. Se descompune complet la temperaturi peste 338 °C, precum și sub influența curentului electric. Arderea clorurii de amoniu eliberează amoniac, care este un iritant respirator. O soluție apoasă a reactivului este amoniacul, un lichid cu miros înțepător care are un efect stimulator asupra sistemului nervos. Reactivul este utilizat ca medicament, dar tratamentul cu amoniac trebuie efectuat strict la recomandarea medicului, deoarece o supradoză poate duce la stop respirator și comă (soluțiile alcaline, de exemplu, bicarbonatul de sodiu, sunt administrate ca antidot). . În plus, acest medicament are contraindicații.
Clorura de amoniu este clasificată ca substanță moderat periculoasă (clasa 3); trebuie să lucrați cu ea purtând echipament de protecție: mănuși de cauciuc, ochelari de protecție și un respirator, într-o cameră cu ventilație de alimentare și evacuare. Trebuie avut grijă să vă asigurați că reactivul nu intră în contact cu pielea și membranele mucoase. Depozitați substanța chimică Reactivul este necesar în pungi multistrat închise ermetic, în zone interioare fără acces la umiditate. Conexiunea este periculoasă pentru mediu. AplicațieÎn metalurgia neferoasă pentru decaparea metalelor. În magazinul Prime Chemicals Group puteți cumpăra 1. Cele mai polare legături dintr-o moleculă sunt: a) HC1 b) AsH 3 c) PH 3 r) H 2 S 2. Molecula are o formă liniară: a)H 2 O b)H 2 S c)WeC1 2 d) DIN 2 3. Forma geometrică a moleculei de metan CH4: a) unghiular b) piramidal b) triunghiular d) tetraedric 4. Molecula are formă piramidală: a) BC1 3 b) SiBr 4 c) A1Br 3 d) PC1 3 5. O moleculă polară este: a) CO 2 b) CH 4 b) NH 3 r) N 2 6. Numărul de legături σ este de trei ori mai mare decât numărul de legături π din moleculă: a) acid cloros b) acid ortofosforic c) acid sulfuros d) acid percloric 7. În ce serie sunt prezentate formulele compuşilor cu doar legături covalente? a) BaCl2, CdC12, LiF c) NaCl, CuSO4, Fe(OH)3 b) H2O, SiO2, CH3COOH d) N2, HNO3, NaNO3 8. Ce tip de legături chimice lipsesc în clorura de amoniu? a) polar covalent b) covalent nepolar c) donator-acceptor d) ionică 9. Legătura chimică formată între atomii elementelor cu numere atomice 3 și 9: a) polar covalent b) metal c) covalent nepolar d) ionică 10. Câţi electroni sunt conţinuţi într-o moleculă de etilenă? Nu participă la formarea legăturilor chimice? a) 4 b) 8 c) 12 d) 16 11. Numărul de electroni implicați în formarea legăturilor chimice este cel mai mare într-o moleculă: a)H2O b)C12b)H2Sr)N2 12. Rețeaua cristalină atomică are: a) hidroxid de sodiu c) fier b) diamant d) gheață 13. Ce tip de rețea cristalină este caracteristic compușilor s-metale cu elemente p care au electronegativitate mare? a) metalice b) atomice b) ionic d) molecular 14. În ce rând sunt enumerate substanțele cu rețele cristaline atomice, moleculare și, respectiv, ionice în stare solidă? a) diamant, clorură de sodiu, grafit b) fosfor alb, apă, cretă c) oxid de siliciu (IV), cupru, azot d) diamant, dioxid de carbon, fluorură de potasiu 15. Ce se schimbă atunci când clorura de amoniu se formează din amoniac și clorură de hidrogen? a) starea de oxidare a atomului de azot b) starea de oxidare și valența atomului de azot c) valenţa atomului de azot d) starea de oxidare a atomului de hidrogen 16. Care dintre următoarele particule a fost formată printr-un mecanism donor-acceptor? a)F 2 b)HF c)BF 4 – d)BF 3 17. În ce substanță starea de oxidare și valența azotului sunt egale în valoare absolută? a)N 2 b) NH 3 b) HNO 3 d) NH 4 C1 18. Care moleculă este cel mai puțin stabilă? a)H2O6)H2S B)H2Se d) H2Te 19. Care legătură chimică este cea mai puțin puternică? a) metalice b) hidrogen b) ionic d) covalent 20. Atomul al cărui element prezintă cea mai mare tendință de a forma legături ionice? a) C b) Si c) F d) P 21. Cum se schimbă polaritatea și puterea legăturii într-o serie de molecule HF → HC1 → HI? a) atât polaritatea cât și puterea legăturii cresc b) polaritatea crește, puterea scade c) atât polaritatea cât și puterea legăturii scad d) polaritatea scade, puterea crește 22. Ce tip de orbitali ai atomilor de hidrogen și respectiv de clor se suprapun atunci când formează o moleculă de clorură de hidrogen? A) sȘi s b) sȘi R V) RȘi R G) pȘi s 23. În ce moleculă sunt toate legăturile polare covalente? a) H 2 O 2 b) C 2 H 4 c) C 2 H 2 d) CO 2 24. Care element are cea mai mare valoare algebrică cu cea mai mare stare de oxidare? a) fluor b) crom c) carbon d) clor 25. Care element are cea mai mică valoare algebrică a stării de oxidare minime? a) azot b) sulf c) hidrogen d) brom 26. În ce compus hidrogenul are o stare de oxidare negativă? a) NH 4 Cl b) CaH 2 c) H 2 O 2 d) HF 27. În compușii BC1 3, Be1 2 și SiBr 4, orbitalii de valență ai atomilor centrali se află respectiv în următoarele stări hibride: A) sp, sp 2, sp 3 V) sp, sp 3, sp 2 b) sp2,sp, sp3 G) sp 3 , sp 2 , sp 28. Valența azotului în următorii compuși: N 2, NH 3, NH 4 +, CH 3 NH 2, HNO 3 - sunt egali, respectiv: a) 0, III, IV, V, V c) III, III, IV, III, IV b) I, III, III, IV, IV r) III, III, III, IV, V 29. Caracteristica corectă a unei legături ionice este: b) direcţional, nesaturat c) dirijat, saturabil d) nedirectional, saturabil 30. Caracteristica corectă a unei legături covalente este: a) nedirectional, nesaturabil b) direcţional, nesaturat c) dirijat, saturabil d) nedirectional, saturabil 31. Legături duble între atomi există în fiecare compus inclus în grupul: a) CO, CO2 c) S8, C2H4 b) C2H2, SO2 d) CO2, C2H4 32. Legături triple între atomi există în fiecare compus inclus în grupul: a) CO, N 2 b) N 2, SO 2 c) S 8, C 2 H 2 d) CO 2, C 2 H 4 33.Pentru ce element cea mai mare stare de oxidare este mai mare decât numărul grupului în care se află în tabelul periodic? a) mangan b) aur c) bor d) azot 34. O caracteristică cantitativă a elementelor, care ne permite să judecăm tipul de legătură chimică dintre atomii acestor elemente, este: a) raza atomică c) electronegativitatea b) sarcina nucleara d) masa atomica 35. Legături unice polare, duble nepolare, simple nepolare, triple polare există în moleculele următoarelor substanțe, respectiv: a) HF, C2H4, Br2, CO c) H2, CO2, HC1, N2 b) HBr, SO3, N2, C2H2 d) C12, O2, C2H6, CO 36. Numărul total și legăturile π dintr-o moleculă de acid dicromic sunt, respectiv: a) 10 și 4 b) 4 și 10 c) 6 și 2 d) 2 și 6 37. Substanțe date: clorură de cesiu, cupru, diamant, sulf rombic, gheață, oxid de sodiu, iod, „gheață carbonică” (CO 2 solid), grafit, platină, hidrură de potasiu. Printre acestea, numărul de substanțe cu o rețea cristalină atomică este egal cu: a) 4 b)3 c) 2 d)1 38. Substanțe date: clorură de cesiu, cupru, diamant, sulf rombic, gheață, oxid de sodiu, iod, „gheață carbonică” (CO 2 solid), grafit, platină, hidrură de potasiu. Printre acestea, numărul de substanțe cu o rețea cristalină moleculară este egal cu: a) 4 b) 3 c) 2 d) 1 39. Substanțe date: clorură de cesiu, cupru, diamant, sulf rombic, gheață, oxid de sodiu, iod, „gheață carbonică” (CO 2 solid), grafit, platină, hidrură de potasiu. Printre acestea, numărul de substanțe cu o rețea cristalină ionică este egal cu: a) 4 b) 3 c) 2 d) 1 40. Substanțe date: clorură de cesiu, cupru, diamant, sulf rombic, gheață, oxid de sodiu, iod, „gheață carbonică” (CO 2 solid), grafit, platină, hidrură de potasiu. Printre acestea, numărul de substanțe cu o rețea cristalină metalică este egal cu: a) 4 b) 3 c) 2 d) 1
|

 În industrie, clorura de amoniu este obținută ca produs secundar în producția de sifon. În laborator, compusul poate fi sintetizat din clor și amoniac sau prin trecerea amoniacului și a acidului clorhidric printr-o soluție de sare de masă.
În industrie, clorura de amoniu este obținută ca produs secundar în producția de sifon. În laborator, compusul poate fi sintetizat din clor și amoniac sau prin trecerea amoniacului și a acidului clorhidric printr-o soluție de sare de masă.