Kemijska svojstva sumpora. Karakteristike i vrelište sumpora. Fizikalno-kemijske osnove procesa izgaranja sumpora. Peći za spaljivanje tekućeg sumpora. Iskorištavanje topline izgaranja sumpora Izgaranje sumpora u zraku
Fizikalno-kemijske osnove procesa izgaranja sumpora.
Do izgaranja S dolazi uz oslobađanje velike količine topline: 0,5S 2g + O 2g = SO 2g, ΔH = -362,43 kJ
Izgaranje je kompleks kemijskih i fizikalnih pojava. U uređaju za izgaranje moramo se nositi sa složenim poljima brzina, koncentracija i temperatura koje je teško matematički opisati.
Izgaranje rastaljenog S ovisi o uvjetima međudjelovanja i izgaranja pojedinih kapljica. Učinkovitost procesa izgaranja određena je vremenom potpunog izgaranja svake čestice sumpora. Izgaranju sumpora, koje se događa samo u plinovitoj fazi, prethodi isparavanje S, miješanje njegovih para sa zrakom i zagrijavanje smjese na t, čime se osigurava potrebna brzina reakcije. Budući da intenzivnije isparavanje s površine kapi počinje tek pri određenoj t, svaka kap tekućeg sumpora mora se zagrijati na tu t. Što je veći t, više će vremena trebati da se zagrije kap. Kada se iznad površine kapi stvori zapaljiva smjesa pare S i zraka maksimalne koncentracije i t dolazi do paljenja. Proces izgaranja kapljice S ovisi o uvjetima izgaranja: t i relativnoj brzini strujanja plina, te fizikalnim i kemijskim svojstvima tekućeg S (primjerice, prisutnost krutih nečistoća pepela u S), a sastoji se od faze: 1-miješanje kapi tekućine S sa zrakom; 2-zagrijavanje ovih kapi i isparavanje; 3-toplinsko cijepanje S para; 4-stvaranje plinovite faze i njeno paljenje; 5-izgaranje plinovite faze.
Ove faze se javljaju gotovo istovremeno.
Kao rezultat zagrijavanja, kapljica tekućeg S počinje isparavati, S pare difundiraju u zonu izgaranja, gdje pri visokom t počinju aktivno reagirati s O 2 u zraku, a proces difuzijskog izgaranja S događa se s stvaranje SO2.
Pri visokim t brzina oksidacijske reakcije S veća je od brzine fizikalnih procesa, stoga je ukupna brzina procesa izgaranja određena procesima prijenosa mase i topline.
Molekularna difuzija uvjetuje miran, relativno spor proces izgaranja, dok ga turbulentna difuzija ubrzava. Kako se veličina kapljice smanjuje, vrijeme isparavanja se smanjuje. Fina atomizacija čestica sumpora i njihova ravnomjerna raspodjela u struji zraka povećava kontaktnu površinu, olakšavajući zagrijavanje i isparavanje čestica. Prilikom izgaranja svake pojedinačne kapi S u sastavu baklje treba razlikovati 3 razdoblja: ja-inkubacija; II- intenzivno sagorijevanje; III- razdoblje naknadnog sagorijevanja.
Kada kap gori, s njene površine izbijaju plamenovi koji podsjećaju na sunčeve baklje. Za razliku od običnog difuzijskog izgaranja s emisijom plamena s površine goruće kapi, ono se naziva "eksplozivno izgaranje".
Izgaranje kapljice S u difuzijskom načinu odvija se isparavanjem molekula s površine kapljice. Brzina isparavanja ovisi o fizikalnim svojstvima tekućine i t okoline, a određena je karakteristikom brzine isparavanja. U diferencijalnom načinu rada, S svijetli u razdobljima I i III. Eksplozivno izgaranje kapi opaža se samo u razdoblju intenzivnog izgaranja u razdoblju II. Trajanje perioda intenzivnog gorenja proporcionalno je kubu početnog promjera kapi. To je zbog činjenice da je eksplozivno izgaranje posljedica procesa koji se odvijaju u volumenu kapi. Karakteristike brzine gorenja kalk. od strane f-le: DO= /τ sg;
d n – početni promjer kapi, mm; τ – vrijeme potpunog izgaranja kapi, s.
Karakteristika brzine gorenja kapljice jednaka je zbroju karakteristika difuzije i eksplozivnog izgaranja: DO= K in + K diff; Kvz= 0,78∙exp(-(1,59∙r) 2,58); K dif= 1,21∙r +0,23; K T2= K T1 ∙exp(E a /R∙(1/T 1 – 1/T 2)); K T1 – konstanta brzine izgaranja pri t 1 = 1073 K. K T2 – konstanta. brzina zagrijavanja pri t različita od t 1. E a – energija aktivacije (7850 kJ/mol).
DA. Glavni uvjeti za učinkovito izgaranje tekućine S su: dovod cjelokupne potrebne količine zraka do ušća baklje, fino i ravnomjerno raspršivanje tekućine S, turbulencija strujanja i visoka t.
Opća ovisnost intenziteta isparavanja tekućine S o brzini plina i t: K 1= a∙V/(b+V); a, b su konstante ovisne o t. V – brzina plin, m/s. Pri višim t, ovisnost intenziteta isparavanja S o brzini plina je: K 1= K o ∙ V n ;
| t, o C | lgK otprilike | n |
| 4,975 | 0,58 | |
| 5,610 | 0,545 | |
| 6,332 | 0,8 |
S porastom t od 120 do 180 o C intenzitet isparavanja S raste 5-10 puta, a od 180 do 440 o C 300-500 puta.
Brzina isparavanja pri brzini plina od 0,104 m/s određena je: = 8,745 – 2600/T (pri 120-140 o C); = 7.346 –2025/T (na 140-200 o C); = 10.415 – 3480/T (na 200-440 o C).
Da bi se odredila brzina isparavanja S pri bilo kojoj t od 140 do 440 o C i brzini plina u rasponu od 0,026-0,26 m/s, najprije se nalazi za brzinu plina od 0,104 m/s i preračunava na drugu brzinu: lg = lg + n ∙ lgV `` /V ` ; Usporedba intenziteta isparavanja tekućeg sumpora i brzine izgaranja sugerira da intenzitet izgaranja ne može biti veći od intenziteta isparavanja na vrelištu sumpora. Time se potvrđuje ispravnost mehanizma izgaranja, prema kojem sumpor gori samo u parovitom stanju. Konstanta brzine oksidacije sumpornih para (reakcija se odvija prema jednadžbi drugog reda) određena je kinetičkom jednadžbom: -dS S /d = K∙S S ∙S O2 ; S S – koncentracija pare S; C O2 – koncentracija O 2 para; K je konstanta brzine reakcije. Ukupna koncentracija para S i O 2 je: sa S= a(1-x); S O2= b – 2ax; a je početna koncentracija pare S; b – početna koncentracija para O 2 ; x je oksidacijsko stanje pare S. Tada:
K∙τ= (2,3 /(b – 2a)) ∙ (log(b – ax/b(1 - x))));
Konstanta brzine za oksidaciju S u SO 2: lgK= B – A/T;
| o C | 650 - 850 | 850 - 1100 |
| U | 3,49 | 2,92 |
| A |
Sumporne kapi d< 100мкм сгорают в диффузионном режиме; d>100 µm u eksploziji, u području od 100-160 µm vrijeme gorenja kapljica se ne povećava.
Da. Za intenziviranje procesa izgaranja preporučljivo je raspršiti sumpor u kapljice d = 130-200 μm, što zahtijeva dodatnu energiju. Spaljivanjem iste količine dobiva se S. SO 2 je koncentriraniji, što je manji volumen ložišnog plina i veća njegova t.
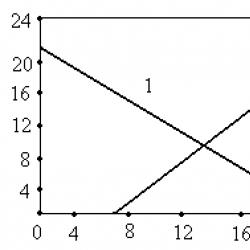
 1 – C O2; 2 – S SO2
1 – C O2; 2 – S SO2
Na slici je prikazan približan odnos između t i koncentracije SO 2 u ložišnom plinu nastalom tijekom adijabatskog izgaranja sumpora u zraku. U praksi se dobiva visoko koncentrirani SO 2, ograničen činjenicom da pri t > 1300 obloga peći i plinskih kanala brzo propada. Osim toga, pod ovim uvjetima mogu se pojaviti sporedne reakcije između O 2 i N 2 zraka uz stvaranje dušikovih oksida, koji je nepoželjna nečistoća u SO 2, stoga se u sumpornim pećima obično održava t = 1000-1200. A plinovi iz peći sadrže 12-14 vol% SO 2. Iz jednog volumena O 2 nastaje jedan volumen SO 2, stoga je najveći teorijski sadržaj SO 2 u plinu za kalciniranje pri izgaranju S u zraku 21%. Pri gorenju S na zraku gori. Sadržaj O 2 SO 2 u plinskoj smjesi može se povećati ovisno o koncentraciji O 2 . Teorijski sadržaj SO 2 pri izgaranju S u čistom O 2 može doseći 100%. Mogući sastav plina za pečenje dobivenog izgaranjem S u zraku iu raznim smjesama kisika i dušika prikazan je na slici:

Peći za spaljivanje sumpora.
Izgaranje S u proizvodnji sumporne kiseline provodi se u pećima u atomiziranom ili krutom stanju. Za izgaranje rastaljenog S koriste se peći s mlaznicama, ciklonske i vibracijske peći. Najviše se koriste ciklon i mlaznica. Ove peći su klasificirane prema sljedećim kriterijima:- prema vrsti ugrađenih mlaznica (mehaničke, pneumatske, hidraulične) i njihovom položaju u peći (radijalne, tangencijalne); - prisutnost zaslona unutar komora za izgaranje; - prema izvedbi (vodoravno, okomito); - prema mjestu ulaznih otvora za dovod zraka; - na uređajima za miješanje strujanja zraka s parama S; - na opremi za korištenje topline izgaranja S; - prema broju kamera.
Peć s mlaznicom (riža)

1 - čelični cilindar, 2 - obloga. 3 - azbest, 4 - pregrade. 5 - mlaznica za raspršivanje goriva, 6 - mlaznica za raspršivanje sumpora,
7 - kutija za dovod zraka u peć.
Prilično je jednostavnog dizajna, jednostavan za održavanje, proizvodi plin s konstantnom koncentracijom SO 2. Do ozbiljnih nedostataka uključuju: postupno uništavanje pregrada zbog visokog t; niski toplinski stres komore za izgaranje; poteškoće u dobivanju plina visoke koncentracije, jer potrošiti veliki višak zraka; ovisnost postotka izgaranja o kvaliteti atomizacije S; znači potrošnja goriva pri pokretanju i zagrijavanju peći; relativno velike dimenzije i težinu, a kao rezultat značajna kapitalna ulaganja, izvedene površine, pogonske troškove i velike gubitke topline u okoliš.
Savršeniji ciklonske peći.

1 - predkomora, 2 - kutija za zrak, 3, 5 - komore za naknadno izgaranje, 4. 6 - stezni prstenovi, 7, 9 - mlaznice za dovod zraka, 8, 10 - mlaznice za dovod sumpora.
Pristup: tangencijalni ulaz zraka i S; osigurava ravnomjerno izgaranje S u ložištu zbog bolje turbulizacije strujanja; mogućnost dobivanja koncentriranog procesnog plina do 18 vol% SO 2; visoki toplinski napon prostora za izgaranje (4,6 10 6 W/m 3); volumen aparata će se smanjiti za 30-40 puta u usporedbi s volumenom peći s mlaznicom iste produktivnosti; konstantna koncentracija SO 2; jednostavna regulacija postotka izgaranja S i njegova automatizacija; niska potrošnja vremena i zapaljivog materijala za zagrijavanje i pokretanje peći nakon dugog zaustavljanja; niži sadržaj dušikovih oksida nakon peći. Glavni tjedni povezan s visokim t u postotku izgaranja; moguće je pucanje obloge i zavara; nezadovoljavajuća atomizacija S dovodi do proboja njegovih para u izmjenjivač iza peći, a posljedično i do korozije opreme i nestabilnosti t na ulazu u izmjenjivač.
Talina S može ući u peć kroz mlaznice s tangencijalnim ili aksijalnim rasporedom. S aksijalnim rasporedom mlaznica, zona izgaranja je bliža periferiji. S tangen - bliže središtu, zbog čega se smanjuje učinak visokog t na podstavu. (fig) Brzina strujanja plina je 100-120 m/s - to stvara povoljne uvjete za prijenos mase i topline, te povećava brzinu izgaranja S.
Vibrirajuća pećnica (riža).

1 – glava peći plamenika; 2 – povratni ventili; 3 – vibracijski kanal.
Tijekom vibracijskog izgaranja povremeno se mijenjaju svi parametri procesa (tlak u komori, brzina i sastav plinske smjese, t). Uređaj za vibracije izgaranje S naziva se peć s plamenikom. Prije ložišta S i zrak se miješaju i struje kroz povratne ventile (2) u glavu ložišta-plamenika, gdje smjesa izgara. Opskrba sirovinama vrši se u dijelovima (ciklički). U ovoj verziji peći, toplinski stres i brzina izgaranja će se značajno povećati, ali prije paljenja smjese potrebno je dobro miješanje raspršenog S sa zrakom kako bi se proces dogodio trenutno. U ovom slučaju, proizvodi izgaranja su dobro izmiješani, SO 2 plinski film koji okružuje S čestice je uništen i olakšava pristup novim dijelovima O 2 u zoni izgaranja. U takvoj peći nastali SO 2 ne uklanja neizgorene čestice, njegova je koncentracija visoka.
Ciklonsku peć u usporedbi s peći s mlaznicom karakterizira 40-65 puta veće toplinsko naprezanje, mogućnost dobivanja koncentriranijeg plina i veće proizvodnje pare.
Najvažnija oprema za peći za izgaranje su mlaznice za tekućinu S, koje moraju osigurati fino i ravnomjerno raspršivanje tekućine S, njeno dobro miješanje sa zrakom u samoj mlaznici i iza nje, brzo podešavanje protoka tekućine S uz održavanje potreban njegov odnos sa zrakom, stabilnost određenog oblika, duljina baklje, a također imaju izdržljiv dizajn, pouzdan i jednostavan za korištenje. Za nesmetan rad brizgaljki važno je da je S dobro očišćen od pepela i bitumena. Mlaznice mogu biti mehaničke (tekućina pod vlastitim pritiskom) ili pneumatske (u prskanju sudjeluje i zrak).
Iskorištavanje topline izgaranja sumpora.
Reakcija je izrazito egzotermna, zbog čega se oslobađa velika količina topline, a temperatura plina na izlazu iz peći je 1100-1300 0 C. Za kontaktnu oksidaciju SO 2 temperatura plina na ulazu u 1. sloja peći ne smije prijeći 420 - 450 0 C. Stoga je prije stupnja oksidacije SO 2 potrebno ohladiti protok plina i iskoristiti višak topline. U sustavima sumporne kiseline koji koriste sumpor za povrat topline, najčešće se koriste vodocijevni kotlovi za otpadnu toplinu s prirodnom cirkulacijom topline. SETA – C (25 - 24); RKS 95/4,0 – 440.
Energetsko-tehnološki kotao RKS 95/4,0 – 440 je vodocijevni, prirodno optočni, plinonepropusni kotao, namijenjen za rad pod tlakom. Kotao se sastoji od uređaja za isparavanje 1. i 2. stupnja, daljinskih ekonomajzera 1. i 2. stupnja, daljinskih pregrijača 1. i 2. stupnja, bubnja i peći za spaljivanje sumpora. Ložište je dizajnirano za spaljivanje do 650 tona tekućine. Sumpora dnevno. Peć se sastoji od dva ciklona međusobno spojena pod kutom od 110 0 i prijelazne komore.

Unutarnje kućište ima promjer od 2,6 m i slobodno leži na nosačima. Vanjski omotač ima promjer 3 m. U prstenasti prostor koji čine unutarnje i vanjsko kućište uvodi se zrak koji zatim kroz mlaznice ulazi u komoru za izgaranje. Sumpor se dovodi u peć pomoću 8 mlaznica za sumpor, po 4 na svakom ciklonu. Izgaranje sumpora događa se u vrtložnom strujanju plina i zraka. Vrtložno strujanje postiže se tangencijalnim uvođenjem zraka u ciklon za izgaranje kroz zračne mlaznice, po 3 u svakom ciklonu. Količina zraka regulirana je električno pokretanim klapnama na svakoj zračnoj mlaznici. Prijelazna komora je dizajnirana za usmjeravanje protoka plina iz vodoravnih ciklona u okomiti plinski kanal uređaja za isparavanje. Unutarnja površina ložišta obložena je mulit-korund opekom, razreda MKS-72, debljine 250 mm.

1 – cikloni
2 - prijelazna komora
3 – uređaji za isparavanje
Sumpor je kemijski element koji se nalazi u šestoj skupini i trećoj periodi periodnog sustava elemenata. U ovom ćemo članku detaljno pogledati njegova kemijska svojstva, proizvodnju, upotrebu i tako dalje. Fizička svojstva uključuju karakteristike kao što su boja, razina električne vodljivosti, vrelište sumpora itd. Kemijska svojstva opisuju njegovu interakciju s drugim tvarima.
Sumpor s fizičke točke gledišta
Ovo je krhka tvar. U normalnim uvjetima ostaje u čvrstom agregatnom stanju. Sumpor ima limun-žutu boju.
I većinom svi njegovi spojevi imaju žute nijanse. Ne otapa se u vodi. Ima nisku toplinsku i električnu vodljivost. Ove karakteristike ga karakteriziraju kao tipičan nemetal. Unatoč činjenici da kemijski sastav sumpora nije nimalo kompliciran, ova tvar može imati nekoliko varijacija. Sve ovisi o strukturi kristalne rešetke, uz pomoć koje su atomi povezani, ali ne tvore molekule.
Dakle, prva opcija je rombični sumpor. Najstabilniji je. Vrelište ove vrste sumpora je četiri stotine četrdeset pet stupnjeva Celzijusa. Ali da bi određena tvar prešla u plinovito agregatno stanje, prvo mora proći kroz tekuće stanje. Dakle, topljenje sumpora događa se na temperaturi od stotinu i trinaest stupnjeva Celzijusa.
Druga opcija je monoklinski sumpor. To je igličasti kristal tamnožute boje. Taljenjem prve vrste sumpora i zatim polaganim hlađenjem dolazi do stvaranja ove vrste. Ova sorta ima gotovo iste fizičke karakteristike. Na primjer, vrelište ove vrste sumpora je isto četiri stotine četrdeset pet stupnjeva. Osim toga, postoji takva vrsta ove tvari kao plastika. Dobiva se tako da se u hladnu vodu ulije rombična voda zagrijana gotovo do vrenja. Vrelište ove vrste sumpora je isto. Ali tvar ima svojstvo istezanja poput gume.
Druga komponenta fizičkih karakteristika o kojoj bih želio govoriti je temperatura paljenja sumpora.

Ovaj pokazatelj može varirati ovisno o vrsti materijala i njegovom podrijetlu. Na primjer, temperatura paljenja tehničkog sumpora je sto devedeset stupnjeva. Ovo je prilično niska brojka. U drugim slučajevima, plamište sumpora može biti dvjesto četrdeset i osam stupnjeva, pa čak i dvjesto pedeset i šest. Sve ovisi iz kojeg je materijala izvađen i koja mu je gustoća. Ali možemo zaključiti da je temperatura izgaranja sumpora prilično niska u usporedbi s drugim kemijskim elementima; on je zapaljiva tvar. Osim toga, ponekad se sumpor može kombinirati u molekule koje se sastoje od osam, šest, četiri ili dva atoma. Sada, nakon što smo razmotrili sumpor sa stajališta fizike, prijeđimo na sljedeći odjeljak.
Kemijska svojstva sumpora
Ovaj element ima relativno nisku atomsku masu, jednaku trideset i dva grama po molu. Karakteristike elementa sumpora uključuju takvu značajku ove tvari kao sposobnost različitih stupnjeva oksidacije. Ovo se razlikuje od, recimo, vodika ili kisika. Razmatrajući pitanje koja su kemijska svojstva elementa sumpora, nemoguće je ne spomenuti da, ovisno o uvjetima, pokazuje i redukcijska i oksidacijska svojstva. Dakle, pogledajmo redom interakciju ove tvari s različitim kemijskim spojevima.
Sumpor i jednostavne tvari
Jednostavne tvari su tvari koje sadrže samo jedan kemijski element. Njegovi se atomi mogu spajati u molekule, kao, na primjer, u slučaju kisika, ili se ne mogu spajati, kao što je slučaj s metalima. Dakle, sumpor može reagirati s metalima, drugim nemetalima i halogenima.
Interakcija s metalima
Za izvođenje ovakvog procesa potrebna je visoka temperatura. U tim uvjetima dolazi do reakcije adicije. To jest, atomi metala spajaju se s atomima sumpora, tvoreći složene tvari sulfide. Na primjer, ako zagrijete dva mola kalija i pomiješate ih s jednim molom sumpora, dobit ćete jedan mol sulfida ovog metala. Jednadžba se može napisati na sljedeći način: 2K + S = K 2 S.

Reakcija s kisikom
Ovo je izgaranje sumpora. Kao rezultat ovog procesa nastaje njegov oksid. Potonji mogu biti dvije vrste. Stoga se izgaranje sumpora može odvijati u dvije faze. Prvi je kada jedan mol sumporovog dioksida nastane iz jednog mola sumpora i jednog mola kisika. Jednadžba za ovu kemijsku reakciju može se napisati na sljedeći način: S + O 2 = SO 2. Druga faza je dodavanje još jednog atoma kisika u dioksid. To se događa ako dodate jedan mol kisika na dva mola na visokim temperaturama. Rezultat su dva mola sumporovog trioksida. Jednadžba za ovu kemijsku interakciju izgleda ovako: 2SO 2 + O 2 = 2SO 3 . Kao rezultat ove reakcije nastaje sumporna kiselina. Dakle, nakon što ste proveli dva opisana procesa, možete propustiti dobiveni trioksid kroz struju vodene pare. I dobivamo. Jednadžba za takvu reakciju napisana je na sljedeći način: SO 3 + H 2 O = H 2 SO 4.
Interakcija s halogenima
Kemikalije, kao i drugi nemetali, dopuštaju reakciju s određenom skupinom tvari. Uključuje spojeve kao što su fluor, brom, klor, jod. Sumpor reagira s bilo kojim od njih osim s posljednjim. Kao primjer možemo navesti proces fluoridacije elementa periodnog sustava koji razmatramo. Zagrijavanjem spomenutog nemetala s halogenom mogu se dobiti dvije varijante fluorida. Prvi slučaj: ako uzmemo jedan mol sumpora i tri mola fluora, dobit ćemo jedan mol fluorida, čija je formula SF 6. Jednadžba izgleda ovako: S + 3F 2 = SF 6. Osim toga, postoji i druga opcija: ako uzmemo jedan mol sumpora i dva mola fluora, dobit ćemo jedan mol fluorida kemijske formule SF 4. Jednadžba se piše na sljedeći način: S + 2F 2 = SF 4. Kao što vidite, sve ovisi o omjerima u kojima se komponente miješaju. Na potpuno isti način može se provesti proces kloriranja sumpora (također mogu nastati dvije različite tvari) ili bromiranja.

Interakcija s drugim jednostavnim tvarima
Karakteristike elementa sumpora tu ne završavaju. Tvar također može kemijski reagirati s vodikom, fosforom i ugljikom. Zbog interakcije s vodikom nastaje sulfidna kiselina. Kao rezultat njegove reakcije s metalima mogu se dobiti njihovi sulfidi, koji se pak također dobivaju izravnom reakcijom sumpora s istim metalom. Adicija atoma vodika na atome sumpora događa se samo u uvjetima vrlo visoke temperature. Kada sumpor reagira s fosforom, nastaje njegov fosfid. Ima sljedeću formulu: P 2 S 3. Da biste dobili jedan mol ove tvari, trebate uzeti dva mola fosfora i tri mola sumpora. Kada sumpor stupa u interakciju s ugljikom, nastaje karbid dotičnog nemetala. Njegova kemijska formula izgleda ovako: CS 2. Da biste dobili jedan mol određene tvari, trebate uzeti jedan mol ugljika i dva mola sumpora. Sve gore opisane reakcije dodavanja događaju se samo kada se reagensi zagriju na visoke temperature. Pogledali smo interakciju sumpora s jednostavnim tvarima, a sada prijeđimo na sljedeću točku.
Sumpor i kompleksni spojevi
Složene tvari su one tvari čije se molekule sastoje od dva (ili više) različitih elemenata. Kemijska svojstva sumpora omogućuju mu da reagira sa spojevima kao što su lužine, kao i koncentrirana sulfatna kiselina. Njegove reakcije s tim tvarima prilično su neobične. Prvo, pogledajmo što se događa kada se dotični nemetal pomiješa s alkalijom. Na primjer, ako uzmete šest mola i dodate tri mola sumpora, dobit ćete dva mola kalijevog sulfida, jedan mol kalijevog sulfita i tri mola vode. Ova vrsta reakcije može se izraziti sljedećom jednadžbom: 6KOH + 3S = 2K 2 S + K2SO 3 + 3H 2 O. Isti princip interakcije događa se ako dodate Zatim, razmotrite ponašanje sumpora kada koncentrirana otopina sulfatne kiseline dodaje mu se. Ako uzmemo jedan mol prve i dva mola druge tvari, dobivamo sljedeće proizvode: sumporni trioksid u količini od tri mola, kao i vodu - dva mola. Ova kemijska reakcija može se dogoditi samo kada se reaktanti zagriju na visoku temperaturu.

Dobivanje predmetnog nemetala
Postoji nekoliko glavnih načina na koje se sumpor može ekstrahirati iz raznih tvari. Prva metoda je izolacija iz pirita. Kemijska formula potonjeg je FeS 2. Kada se ova tvar zagrije na visoku temperaturu bez pristupa kisiku, može se dobiti još jedan željezni sulfid - FeS - i sumpor. Jednadžba reakcije napisana je na sljedeći način: FeS 2 = FeS + S. Drugi način dobivanja sumpora, koji se često koristi u industriji, je izgaranje sumpornog sulfida uz malu količinu kisika. U ovom slučaju možete dobiti dotični nemetal i vodu. Da biste proveli reakciju, morate uzeti komponente u molarnom omjeru od dva prema jedan. Kao rezultat toga dobivamo konačne proizvode u omjerima dva prema dva. Jednadžba za ovu kemijsku reakciju može se napisati na sljedeći način: 2H 2 S + O 2 = 2S + 2H 2 O. Osim toga, sumpor se može dobiti raznim metalurškim procesima, na primjer, u proizvodnji metala kao što je nikal , bakar i drugi.
Industrijska uporaba
Nemetal koji razmatramo našao je svoju najširu primjenu u kemijskoj industriji. Kao što je gore spomenuto, ovdje se koristi za proizvodnju sulfatne kiseline iz nje. Osim toga, sumpor se koristi kao komponenta za izradu šibica, zbog činjenice da je zapaljivi materijal. Nezaobilazan je i u proizvodnji eksploziva, baruta, prskalica itd. Osim toga, sumpor se koristi kao jedan od sastojaka sredstava za suzbijanje štetočina. U medicini se koristi kao komponenta u proizvodnji lijekova za kožne bolesti. Dotična tvar se također koristi u proizvodnji raznih boja. Osim toga, koristi se u proizvodnji fosfora.
Elektronska struktura sumpora
Kao što znate, svi se atomi sastoje od jezgre u kojoj se nalaze protoni - pozitivno nabijene čestice - i neutroni, tj. čestice bez naboja. Elektroni s negativnim nabojem rotiraju oko jezgre. Da bi atom bio neutralan, mora imati isti broj protona i elektrona u svojoj strukturi. Ako je potonjih više, radi se već o negativnom ionu – anionu. Ako je, naprotiv, broj protona veći od broja elektrona, radi se o pozitivnom ionu, odnosno kationu. Anion sumpora može djelovati kao kiselinski ostatak. Dio je molekula tvari kao što su sulfidna kiselina (sumporovodik) i metalni sulfidi. Anion nastaje tijekom elektrolitičke disocijacije, koja se događa kada se tvar otopi u vodi. U tom slučaju molekula se raspada na kation, koji se može predstaviti u obliku metalnog ili vodikovog iona, kao i kation - ion kiselinskog ostatka ili hidroksilne skupine (OH-).

Kako je redni broj sumpora u periodnom sustavu šesnaest, možemo zaključiti da njegova jezgra sadrži upravo toliki broj protona. Na temelju toga možemo reći da postoji i šesnaest elektrona koji rotiraju okolo. Broj neutrona može se pronaći tako da se od molarne mase oduzme redni broj kemijskog elementa: 32 - 16 = 16. Svaki elektron ne rotira kaotično, već u određenoj orbiti. Budući da je sumpor kemijski element koji pripada trećoj periodi periodnog sustava, postoje tri orbite oko jezgre. Prvi od njih ima dva elektrona, drugi osam, a treći šest. Elektronska formula atoma sumpora napisana je na sljedeći način: 1s2 2s2 2p6 3s2 3p4.
Rasprostranjenost u prirodi
U osnovi, dotični kemijski element nalazi se u mineralima, koji su sulfidi raznih metala. Prije svega, to je pirit - sol željeza; Također je olovo, srebro, bakreni sjaj, cinkova mješavina, cinober - živin sulfid. Osim toga, sumpor također može biti dio minerala, čija je struktura predstavljena s tri ili više kemijskih elemenata.

Na primjer, halkopirit, mirabilit, kieserite, gips. Svaki od njih možete detaljnije razmotriti. Pirit je željezov sulfid ili FeS 2 . Ima svijetlo žutu boju sa zlatnim sjajem. Ovaj se mineral često može naći kao nečistoća u lapis lazuliju, koji se široko koristi za izradu nakita. To je zbog činjenice da ova dva minerala često imaju zajedničko ležište. Bakreni sjaj - kalkozit ili halkocit - je plavkasto-siva tvar slična metalu. i srebrni sjaj (argentit) imaju slična svojstva: oba izgledom podsjećaju na metale i imaju sivu boju. Cinobarit je mutno smeđe-crveni mineral sa sivim mrljama. Halkopirit, čija je kemijska formula CuFeS 2, zlatno je žut, naziva se i zlatna mješavina. Cinkova mješavina (sfalerit) može varirati u boji od jantara do vatreno narančaste. Mirabilit - Na 2 SO 4 x10H 2 O - prozirni ili bijeli kristali. Također se zove koristi se u medicini. Kemijska formula kiezerita je MgSO 4 xH 2 O. Izgleda kao bijeli ili bezbojni prah. Kemijska formula gipsa je CaSO 4 x2H 2 O. Osim toga, ovaj kemijski element je dio stanica živih organizama i važan je element u tragovima.
Kod proizvodnje plina za pečenje spaljivanjem sumpora nema potrebe za njegovim pročišćavanjem od nečistoća. Faza pripreme uključuje samo sušenje plina i uklanjanje kiseline. Kada se sumpor spali, dolazi do nepovratne egzotermne reakcije:
S + O 2 = TAKO 2 (1)
uz oslobađanje vrlo velike količine topline: promjena H = -362,4 kJ/mol, odnosno izraženo jediničnom masom 362,4/32 = 11,325 kJ/t = 11325 kJ/kg S.
Rastaljeni tekući sumpor koji se isporučuje za izgaranje isparava (vrije) na temperaturi od 444,6 * C; toplina isparavanja je 288 kJ/kg. Kao što se može vidjeti iz prikazanih podataka, toplina reakcije izgaranja sumpora sasvim je dovoljna za isparavanje sirovine, stoga se interakcija sumpora i kisika događa u plinovitoj fazi (homogena reakcija).
Izgaranje sumpora u industriji provodi se na sljedeći način. Sumpor se prethodno topi (za to možete koristiti vodenu paru dobivenu recikliranjem topline glavne reakcije izgaranja sumpora). Budući da je talište sumpora relativno nisko, taloženjem i naknadnom filtracijom iz sumpora lako je odvojiti mehaničke nečistoće koje nisu prešle u tekuću fazu i dobiti sirovinu dovoljnog stupnja čistoće. Dvije vrste peći koriste se za spaljivanje rastaljenog sumpora - mlaznica i ciklon. Moraju omogućiti raspršivanje tekućeg sumpora kako bi brzo ispario i osigurali pouzdan kontakt sa zrakom u svim dijelovima aparata.
Iz peći plin za pečenje ulazi u kotao za otpadnu toplinu, a zatim u sljedeće uređaje.
Koncentracija sumpornog dioksida u plinu za kalciniranje ovisi o omjeru sumpora i zraka koji se dovodi za izgaranje. Ako se zrak uzima u stehiometrijskoj količini, tj. na svaki mol sumpora dolazi 1 mol kisika tada će kod potpunog izgaranja sumpora koncentracija biti jednaka volumnom udjelu kisika u zraku C pa 2. max = 21%. Međutim, obično se uzima previše zraka jer će inače temperatura u pećnici biti previsoka.
Tijekom adijabatskog izgaranja sumpora, temperatura pečenja za reakcijsku smjesu stehiometrijskog sastava bit će ~ 1500*C. U praktičnim uvjetima, mogućnosti povećanja temperature u peći ograničene su činjenicom da se iznad 1300 * C obloga peći i plinskih kanala brzo urušava. Tipično, kada se sumpor spaljuje, dobiva se kalcinirajući plin koji sadrži 13-14% SO 2 .
2. Kontaktna oksidacija so2 u so3
Kontaktna oksidacija sumporovog dioksida tipičan je primjer heterogene oksidativne egzotermne katalize.
Ovo je jedna od najviše proučavanih katalitičkih sinteza. U SSSR-u je najtemeljitiji rad na proučavanju oksidacije SO 2 u SO 3 i razvoju katalizatora proveo G.K. Boreskov. Reakcija oksidacije sumpor dioksida
TAKO 2 + 0,5 O 2 = TAKO 3 (2)
karakteriziran vrlo visokom aktivacijskom energijom i stoga je njegova praktična provedba moguća samo u prisutnosti katalizatora.
U industriji je glavni katalizator za oksidaciju SO 2 katalizator na bazi vanadijevog oksida V 2 O 5 (vanadijeva kontaktna masa). Drugi spojevi, prvenstveno platina, također pokazuju katalitičku aktivnost u ovoj reakciji. Međutim, platinski katalizatori iznimno su osjetljivi čak i na tragove arsena, selena, klora i drugih nečistoća te su stoga postupno zamijenjeni vanadijevim katalizatorom.
Brzina reakcije raste s porastom koncentracije kisika, pa se proces u industriji odvija prekomjerno.
Budući da je reakcija oksidacije SO2 egzotermna, temperaturni režim za njezinu provedbu trebao bi se približiti optimalnoj temperaturnoj liniji. Izbor temperaturnog režima dodatno je podložan dvama ograničenjima koja se odnose na svojstva katalizatora. Donja temperaturna granica je temperatura paljenja vanadijevih katalizatora, koja, ovisno o vrsti katalizatora i sastavu plina, iznosi 400 - 440*C. gornja granica temperature je 600 – 650*C i određena je činjenicom da se iznad ovih temperatura struktura katalizatora restrukturira i on gubi svoju aktivnost.
U rasponu od 400 - 600*C nastoje provesti proces tako da s povećanjem stupnja pretvorbe temperatura pada.
Najčešće se u industriji koriste kontaktni uređaji s policama s vanjskom izmjenom topline. Shema izmjene topline uključuje maksimalno korištenje topline reakcije za zagrijavanje izvornog plina i istovremeno hlađenje plina između polica.
Jedan od najvažnijih zadataka industrije sumporne kiseline je povećanje stupnja pretvorbe sumpornog dioksida i smanjenje njegove emisije u atmosferu. Ovaj problem se može riješiti na nekoliko načina.
Jedna od najracionalnijih metoda za rješavanje ovog problema, široko korištena u industriji sumporne kiseline, je metoda dvostrukog kontakta i dvostruke apsorpcije (DCDA). Za pomicanje ravnoteže udesno i povećanje iskorištenja procesa, kao i za povećanje brzine procesa, postupak se provodi ovom metodom. Njegova bit leži u činjenici da se reakcijska smjesa, u kojoj je stupanj pretvorbe SO 2 90 - 95%, hladi i šalje u međuapsorber za odvajanje SO 3. U preostalom reakcijskom plinu omjer O 2:SO 2 značajno raste, što dovodi do pomaka reakcijske ravnoteže udesno. Novozagrijani reakcijski plin ponovno se dovodi u kontaktni aparat, gdje se na jednom ili dva sloja katalizatora postiže 95% stupnja konverzije preostalog SO 2. Ukupni stupanj konverzije SO 2 u ovom procesu je 99,5%. - 99,8 posto.