Теплота плавления воды. Кувшинные фильтры, картриджи. Сопло космической ракеты
Лечение водой
Кувшинные фильтры, картриджи
Свойства льда для его модификаций
Сообщение:
Здравствуйте, Олег, я студент второго курса Кузбасского государственного технического института, занимаюсь научной работой. И передо мной встала проблема: я не могу нигде найти свойства льда для всех его модификаций (уд. теплота плавления, уд. сопротивление, скорость распространения поперечных и продольных звуковых волн, коэф. поглощения этих волн, склонность к трещинообразованим, а также механические свойства). Не могли бы Вы "подкинуть" мне известную вам информацию по данным вопросам, за что я буду вам искренне благодарен.
Такое же вещество при более низком атмосферном давлении имеет более низкую удельную теплоту. Чувствительная теплота - это количество тепла, которое организм может получить, не влияя на его молекулярную структуру. Если он не изменяется, молекулярная структура не изменяет состояние. Поскольку молекулярная структура не изменяется, наблюдается изменение температуры, поэтому ее называют теплоемкостью.
Скрытая теплота - это энергия, необходимая для изменения фазы вещества. Если изменение происходит от твердого к жидкому, это называется термоядерным теплом. Если переход от жидкого к газообразному называется теплотой испарения. Когда тепло подается к веществу, которое достигло температуры, при которой оно меняет свое состояние, невозможно повышение температуры, а просто изменение его состояния. В зависимости от вещества скрытую теплоту можно обычно измерять в калориях на грамм или в килоджоулях на килограмм.
Здравствуйте, Дмитрий.
К сожалению такой полной информации по физико-механическим свойствам я не располагаю, поскольку я специально не занимался изучением льда и его свойств. Всё что мне известно по данной тематике, привожу ниже:
В природе известны 14 модификаций льда. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии и обозначающегося как лёд I , образуются в условиях экзотических - при очень низких температурах (порядка -110150 0 С) и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров - это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.

Вода: скрытая теплота плавления: 80 калорий на грамм, скрытая теплота испарения: 540 калорий на грамм. Сталь: скрытая теплота плавления: 50 калорий. Магний: скрытая теплота плавления: 72 калории. Никель: скрытая теплота плавления: 58 калорий. Кислород: скрытая теплота плавления: 3 калории.
Цинк: скрытая теплота плавления: 28 калорий. Ледовый калориметр: исторический и экспериментальный подход к преподаванию химии в колледже. В дополнение к обычному преимуществу ледяного калориметра, способного измерять медленные изменения тепла, описанный здесь инструмент чрезвычайно прост в построении и эксплуатации. Удельную теплоту металлов из алюминия, меди, свинца и олова определяли с использованием ледяного калориметра, изготовленного из легко доступных материалов.
Некоторые данные о структурных модификациях льда, температуре, давлении, плотности и диалектрической проницаемости показаны в Таблице 1 и Таблице 2.
Табл. 1 . - Некоторые данные о структурах модификаций льда
Примечание. 1 A=10 -10 м.
Табл. 2 . - Температура, давление, плотность и диэлектрическая проницаемость различных льдов
Ключевые слова: Лавуазье; калориметр; удельная теплоемкость. Медалью за калорирование и антиобщественным действиям по калорийному общению. Мы рассмотрим вопрос о том, как это сделать. В качестве предикторов медикаментозная калориметрия для лечения медикаментозных заболеваний, реализаций, которые используются для лечения, нет адекватного контроля над состоянием здоровья и окружающей среды.
Нет реципиентного интернационала в соответствии с общей температурой, преобладающим акведидо. Оооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооооеееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееееее. Согласно «механическим теориям», также греческого происхождения, тепло возникает из-за движения составляющих частиц материи. Лавуазье и Лаплас упомянул механическую гипотезу, в которой тепло является живой силой, возникающей в результате нечувствительных движений молекул, интенсивность которых пропорциональна произведению массы на квадрат скорости.
Кристаллы всех модификаций льда построены из молекул воды H 2 O, соединённых водородными связями в трёхмерный каркас (рис. 1 ). Молекулу воды можно упрощенно представить себе в виде тетраэдра (пирамиды с треугольным основанием). В её центре находится атом кислорода, в двух вершинах - по атому водорода, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, поэтому их называют неподеленными.
Они вывели из этого принцип сохранения тепла в смеси тел и принцип неизменности суммы освобожденного и поглощенного тепла, когда он возвращается в исходное состояние после ряда комбинаций или изменений состояния. Они не произносили ни по одной из гипотез, а добавили, что они, возможно, верны. 2, 3. Лавуазье был великим сторонником калорийности. Эта теория считала, что все тела в своей внутренней части являются невидимым жидким веществом презренной массы, калорийностью, является то, что тело более высокой температуры имеет более высокую калорийность, чем другая, более низкая температура. 9, 10.
Рис.1 . Структура льда I .
Наиболее изученным является лёд I -й природной модификации . В структуре льда каждая молекула воды участвует в 4 связях, направленных к вершинам тетраэдра. При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы воды. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28", направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру. При этом в структурах льда I, Ic, VII и VIII этот тетраэдр правильный. В структурах льда II, III, V и VI тетраэдры заметно искажены. В структурах льда VI, VII и VIII можно выделить 2 взаимоперекрещивающиеся системы водородных связей. Этот невидимый каркас из водородных связей располагает молекулы в виде сетчатой сетки, по структуре напоминающей соты с полыми каналами. Если лед нагреть, сетчатая структура разрушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, - поэтому вода тяжелее льда.
Теория калорийного мышления как вещества была отвергнута в пользу теории тепла как энергии, главным образом потому, что нельзя объяснить нагрев объектов, кроме как с помощью источника тепла. Тепло, подобно потоку энергии, всегда проходит от одной системы с самой высокой температурой к другой при более низкой температуре, когда они находятся в контакте. 11.
Кувшинные фильтры, картриджи
На протяжении многих лет изучение тепла снижалось относительно его доминирующего положения в научном авангарде, предполагая определенную позицию в общей структуре Химии. В настоящее время калориметрия предоставляет ценные данные для химиков и развитие теорий о химических взаимодействиях. 1.
Многое в структуре льда и его свойствах выглядит необычно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а атомы водорода занимают самые разные положения вдоль связей. Поэтому возможны 6 эквивалентных ориентаций молекул воды относительно их соседей. Часть из них исключается, поскольку нахождение одновременно 2 протонов на одной водородной связи маловероятно, но остаётся достаточная неопределённость в ориентации молекул воды. Такое поведение атомов нетипично, поскольку в твердом веществе все подчиняются одному закону: либо все атомы расположены упорядоченно, и тогда это - кристалл, либо случайно, и тогда это - аморфное вещество. Такая необычная структура может реализоваться в большинстве модификаций льда - I, III, V, VI и VII (и по-видимому в Ic ), а в структуре льда II, VIII и IX молекулы воды ориентационно упорядочены. По выражению Дж. Бернала лёд кристалличен в отношении атомов кислорода и стеклообразен в отношении атомов водорода.
Роль теплоты плавления льда и кристаллизации воды в природе
Целью этой работы было определить удельную теплоемкость металлических тел в чрезвычайно простой изотермической калориметрической системе, которая должна быть построена и обработана, сделана с легко доступными материалами, сравнивая значения, полученные с известными теоретическими значениями, показывая возможность использования этого тип калориметра. Эта практика является отличным предложением для работы в бакалавриатских лабораториях.
Создание калориметрической системы. Существует сравнительное изображение калориметра Лавуазье и калориметра, предложенного в этой работе. В коробке из пенополистирола были сделаны два отверстия, один в нижней части коробки, чтобы пропустить шланг, а другой - к боковой части коробки, что позволило собрать расплавленный лед изнутри пенополистирола. Горшок помещался внутри пенополистирола, поддерживаемого штативом.
Всё же обычный лёд, который образуется при атмосферном давлении и плавится при 0 °С, - самое привычное, но всё же до конца не понятное вещество. В связи с широким распространением воды и льда на Земле отличие свойств льда от свойств других веществ играет важную роль в природных процессах. Вследствие меньшей, чем у воды, плотности лёд образует на поверхности воды плавучий покров, предохраняющий реки и водоёмы от донного замерзания. Зависимость между скоростью течения и напряжением у поликристаллического льда гиперболическая; при приближённом описании её степенным уравнением показатель степени увеличивается по мере роста напряжения.
В качестве поддержки калориметра служили два стакана. Металлические тела нагревали на магнитной мешалке при нагревании, расположенной рядом с калориметром. Можно увидеть недорогую схему ледового калориметра, которая была построена с использованием металлической раковины, увенчанной проволокой в алюминиевой кофеварке. Кофейный аппарат был помещен в коробку из пенополистирола. Для проведения эксперимента кофемашина и ящик из пенополистирола были заполнены льдом. Для таяния льда были установлены два крана: один на дне кофеварки, другой - на пенополистироле.
Кроме того, скорость течения льда прямо пропорциональна энергии активации и обратно пропорциональна абсолютной температуре, так что с понижением температуры лёд приближается по своим свойствам к абсолютно твёрдому телу. В среднем при близкой к таянию температуре текучесть льда в 10 6 раз выше, чем у горных пород. Благодаря своей текучести лёд не накопляется в одном месте, а в виде ледников постоянно перемещается.
Вода, слитая из крана, была собрана в сосуд для определения массы расплавленного льда. Определение удельной теплоемкости металлов. Для эксперимента коробка из пенополистирола была полностью заполнена дробленым льдом до края внутреннего сосуда. Образец предварительно взвешенного металла помещали в металлический слив в стакан, содержащий 600 мл воды при 96 ° С в течение 10 мин. За несколько минут до добавления металлического образца в калориметр внутренний сосуд частично заполнялся льдом. Нагретый металлический корпус быстро добавлялся в калориметр, и немного немного льда было выброшено на поверхность металла внутри калориметра.
Лед трудно расплавить, как бы ни странно это звучало. Не будь водородных связей, сцепляющих молекулы воды, он плавился бы при –90°С. При этом, замерзая, вода не уменьшается в объеме, как это происходит с большинством известных веществ, а увеличивается - за счет образования сетчатой структуры льда.
Вследствие очень высокой отражательной способности льда (0,45) и снега (до 0,95) покрытая ими площадь - в среднем за год около 72 млн. км 2 в высоких и средних широтах обоих полушарий - получает солнечного тепла на 65% меньше нормы и является мощным источником охлаждения земной поверхности, чем в значительной мере обусловлена современная широтная климатическая зональность. Летом в полярных областях солнечная радиация больше, чем в экваториальном поясе, тем не менее температура остаётся низкой, т. к. значительная часть поглощаемого тепла затрачивается на таяние льда, имеющего очень высокую теплоту таяния.
Пятнадцать минут были отмечены таймером, это было общее время, когда металл соприкоснулся со льдом. Через 15 минут из-под крана отбирали определенное количество воды. Эту массу расплавленного льда взвешивали для определения удельной теплоемкости металла. Анализ проводился только с корзиной, которая должна использоваться в качестве эталонного образца экспериментов. Все анализы проводили по 5 повторов.
Всякий раз, когда две системы при разных температурах помещаются внутри теплоизолированного сосуда, происходит передача энергии в виде тепла от системы до самой высокой температуры для системы при самой низкой температуре до тех пор, пока тепловое равновесие между ними идущий. Этот принцип является нулевым законом термодинамики.
К другим необычным свойствам льда относят и генерацию электромагнитного излучения его растущими кристаллами. Известно, что большинство растворенных в воде примесей не передается льду, когда он начинает расти; они вымораживается. Поэтому даже на самой грязной луже пленка льда чистая и прозрачная. При этом примеси скапливаются на границе твердой и жидкой сред, в виде двух слоев электрических зарядов разного знака, которые вызывают значительную разность потенциалов. Заряженный слой примесей перемещается вместе с нижней границей молодого льда и излучает электромагнитные волны. Благодаря этому процесс кристаллизации можно наблюдать в деталях. Так, кристалл, растущий в длину в виде иголки, излучает иначе, чем покрывающийся боковыми отростками, а излучение растущих зерен отличается от того, что возникает, когда кристаллы трескаются. По форме, последовательности, частоте и амплитуде импульсов излучения можно определить, с какой скоростью замерзает лед и какая при этом получается ледовая структура.
Таким образом, материал, имеющий высокую удельную теплоемкость, нагревается и охлаждается намного медленнее, чем материал, имеющий удельную низкую теплоемкость. Важно отметить, что значение удельной теплоемкости имеет небольшие отклонения в зависимости от температуры. 10. Изотермический калориметр был первым, который был разработан, и в нем калориметрический эксперимент проводился при постоянной температуре. 1 В ледяном калориметре тепло передается от металла к высокой температуре ко льду, что приведет к его таянию.
Поскольку эта система термически изолирована от окружающей среды, количество тепла, получаемого металлом, равно количеству тепла, поглощаемого льдом, что приравнивает уравнения 1 и 2, мы имеем. Таким образом, удельные теплоемкости всех тел могут быть определены уравнением 3, где вода действует как эталонный орган.
Табл. 3 . - Некоторые свойства льда I
| Свойство | Значение | Примечание |
| Теплоемкость, кал/ (г ··°C) Теплота таяния, кал/г Теплота парообразования, кал/г | Сильно уменьшается с понижением температуры |
|
| Коэффициент термического расширения, 1/°C Эксперимент проводили в трех повторностях. Только через 1 мин металл был помещен в калориметр, и первые капли начали появляться. Полученные результаты очень близки к найденным в литературе и представлены в таблице 1. Результаты показали, что эта простая система может использоваться в практике обучения для определения удельных значений теплоемкости металлов. Разница между экспериментальными данными должна быть связана с различиями в температуре окружающей среды и образованием блоков льда, что препятствует потоку воды. Многим ученым времен Лавуазье было трудно получить последовательные результаты с использованием калориметра льда, потому что в то время они не обладали изоляционными материалами, такими как пенополистирол, что позволяет использовать более подходящую изоляцию, чем шкуры ягненка, используемые в то время. Тем не менее, они получили отличные результаты зимой. | 9,1·10 -5 (0°C) | |
| Теплопроводность, кал/ (см сек ··°C) | ||
| Показатель преломления: для обыкновенного луча для необыкновенного луча | ||
| Удельная электрическая проводимость, ом -1 ·см -1 | Кажущаяся энергия активации 11ккал/моль Такой эксперимент позволит студентам-студентам связаться с историей и работой чрезвычайно важного химика Антуана Лорана Лавуазье. Он позволяет создавать легкий изотермический калориметр, помимо включения важных понятий, таких как тепло, удельная теплоемкость и нулевой закон термодинамики. Более того, он показывает гения покровителей науки и позволяет студентам воспроизводить эксперименты этих ученых, которые были фундаментальными камнями для развития химии. Результаты показали, что можно найти согласованные значения удельных теплоемкостей, близкие к значениям литературы. Ледяное плавление скрытой жары. Латентная теплота плавления льда - это то, что происходит, когда вода меняет свое физическое состояние. В этом конкретном случае из твердого состояния в жидкость. |
|
| Поверхностная электропроводность, ом -1 | Кажущаяся энергия активации 32ккал/моль |
|
| Модуль Юнга, дин/см | 9·10 10 (-5°C) | Поликристаллич. лёд |
| Сопротивление, Мн/м 2 : раздавливанию | Поликристаллический лёд Поликристаллический лёд Считается, что тепло является формой энергии и что теплообмен между калориметром и внешней средой пренебрежимо мал, можно предположить, что для системы, состоящей из льда, воды и алюминиевого сосуда. Количество получаемого тепла = количество поставленного тепла. И модуль в приведенном выше уравнении был установлен, потому что количество тепла, которое было получено, отрицательно. Из этого уравнения выше, если второе уравнение. Эти отклонения распространяются при использовании уравнения. Применяя частные производные в уравнении. Измерьте и обратите внимание на массу алюминиевого контейнера; С помощью пробирки мы вливаем 300 мл водопроводной воды в контейнер и алюминий и измеряем массу набора; Мы измерили заданную температуру; Мы измеряем начальную температуру воздуха между сосудом и стеклом; Измерьте массу стекла внутри льда; Мы льем весь лед в алюминиевую ванну, в которой уже содержится вода; Мы измеряем стекло, используемое в изделии; Записываем равновесную температуру; Мы измеряем температуру воздуха между стеклом и контейнером. Поликристаллический лёд |
|
| Средняя эффективная вязкость, пз | Поликристаллический лёд |
|
| Показатель степени степенного закона течения | ||
| Энергия активации при деформировании и механической релаксации, ккал/моль | Линейно растет на 0,0361 ккал/ (моль ·°C) от 0 до 273,16 К |
Примечание. 1 кал/(г°С)=4,186 кджl (kг (К); 1 ом -1 см -1 =100 сим/м; 1 дин/см =10 -3 н/м; 1 кал/ (см (сек °С)=418,68 вт/ (м (К); 1 пз= 10 -1 н (сек/м 2 .
Природный лёд I обычно значительно чище, чем вода, т.к. растворимость веществ (кроме NH 4 F) во льде крайне низкая. А вот лёд II наоборот стабилизуется только в присутствии следовых количеств газов; в чистом виде его никто не получал из-за его нестабильности. Если, например, давление создают с помощью гелия, он обязательно растворится в замерзающей воде. Есть сведения, что аргон - другой инертный газ, пригодный для использования в этой установке, - тоже способен давать со льдом твёрдые растворы. Однако изучением таких клатратных соединений льда с благородными газами специально никто не занимался.
Лёд II, III и V-й модификации длительное время сохраняются при атмосферном давлении, если температура не превышает -170°С. При нагревании приблизительно до -150°С лёд превращаются в кубический лёд Ic .
Расположен лёд II на диаграмме состояния между льдом III и льдом IX . Они различаются между собой упорядочением протонов, кислородный же каркас у них одинаков: спирали из одних молекул воды, как будто нанизанные на оси из других молекул воды. Когда же вероятности протона занять то или иное место равны, лёд будет неупорядоченным.
Рис. 2. Диаграмма состояния кристаллических льдов
Однако, все эксперименты с экзотическими льдами, как правило, связаны с их охлаждением до температур сухого льда, жидкого азота, а то и гелия, а также со сжатием до давления в тысячи атмосфер. Общее представление о результатах можно получить, глядя на рисунок , где показана диаграмма состояния кристаллических льдов.
Многие льды высокого давления можно сохранить и при нормальном давлении. Для этого их охлаждают в жидком азоте, а затем давление сбрасывают. Именно на таких закалённых льдах и были проведены основные исследования. Они показали, что их строение весьма разнообразно.
Структуру первого льда высокого давления, льда II , определили на заре исследований в этой области, когда появились первые мощные приборы для рентгеноструктурного в 1964 году. Как оказалось, этот лёд состоит из полых колонок, образованных шестизвенными гофрированными циклами. Каждая колонка окружена шестью такими же колонками, сдвинутыми друг относительно друга на треть периода. Структуру этого льда можно получить, если часть сот льда I h развалить и превратить их в ажурные каркасы, связывающие остальные соты. При этом размер получившихся шестигранных каналов сильно увеличивается - именно у льда II самые широкие каналы, их диаметр составляет 3 Å. В таких каналах могут располагаться атомы гелия, неона и даже молекулы водорода.
Рис. 3 . Структура льда II
Получить гидраты благородного газа, например, гелия на основе льда II можно двумя способами. Во-первых, приложить (в атмосфере гелия) к воде давление в 0,28–0,5 ГПа и охладить её до 250–270К. Хотя в этой области диаграммы стабильны льды III и V, получится гидрат на основе льда II. Что интересно, протоны в нём уже упорядочены. (Обычно они упорядочиваются только при сильном охлаждении уже получившегося льда.)
Во-вторых, можно растворить гелий во льду I h при низкой температуре и давлении 0,3 ГПа. Появление гелия приводит к расширению кристаллической решётки, и затем её нагрев до 180К помогает пройти структурному превращению.
Относительная лёгкость получения твёрдых растворов в льду II, а также его высокий потенциал в качестве хранилища газообразного водорода (одна молекула газа на шесть молекул воды) привлекают к нему внимание учёных-практиков: сейчас активно обсуждается возможность его применения в водородной энергетике.
При конденсации паров воды на более холодной подложке образуется аморфный лёд . Обе эти формы льда Лёд II и аморфный лёд могут самопроизвольно переходить в гексагональный лёд , причём тем скорее, чем выше температура.
Лёд IV-й модификации является метастабильной фазой льда. Он образуется гораздо легче и особенно стабилен, если давлению подвергается тяжёлая вода.
Кривая плавления льда V и VII исследована до давления 20 Гн/м 2 (200 тыс. кгс/см 2 ). При этом давлении лёд VII плавится при температуре 400°С.
Лёд VIII является низкотемпературной упорядоченной формой льда VII.
Лёд IX - метастабильная фаза, возникающая при переохлаждении льда III и по существу представляющая собой его низкотемпературную форму.
Впервые полиморфизм льда был обнаружен Г. Тамманом в 1900 г. и подробно изучен П. Бриджеменом в 1912 г. В табл. 3 и 4 приведены некоторые данные о структурах модификаций льда и некоторые их свойства.
Две последние модификации льда - XIII и XIV - открыли ученые из Оксфорда совсем недавно, в 2006 году. Предположение о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было трудно подтвердить: вязкость воды при температуре –160°С очень высока, и собраться вместе молекулам чистой переохлажденной воды в таком количестве, чтобы образовался зародыш кристалла, трудно. Этого удалось достичь с помощью катализатора - соляной кислоты, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но они могут встречаться на замерзших спутниках других планет.
НЕКОТОРЫЕ ФИЗИКО-МЕХАНИЧЕСКИЕ СВОЙСТВА ЛЬДА.
Устойчивость льда – это многофакторный феномен, зависящий от многих факторов, которые нужно учитывать при расчётах:
ТВЕРДОСТЬ ЛЬДА. Способность льда оказывать сопротивление проникновению другого тела, не получающего остаточных деформаций. Определяется как отношение действующей нагрузки Р к поверхности образовавшейся вмятины S. Твердость Н = P/S является средним значением давления во вмятине. В зависимости от температуры льда и времени приложения нагрузки (короткому времени соответствует динамическая твердость, длительному - статическая твердость) значения Н могут различаться более чем на порядок.
ТЕКСТУРА ЛЬДА. Особенность строения льда, обусловленная пространственными расположениями воздушных, минеральных и органических включений.
С учетом воздушных включений лед подразделяется на монолитный (лишенный видимых включений) и пористый (с наличием включений, которые могут иметь равномерное, слоистое и вертикально-волокнистое распределение).
По размеру включений лед подразделяется на мелкопузыристый (включения менее 0,2 мм), среднепузыристый (включения от 0,2 до 0,5 мм), крупнопузыристый (включения от 0,5 до 1,0 мм), крупно-полостной (включения более 1,0 мм).
Форма включений бывает овальная, трубчатая, ветвистая и трансформирующаяся. По происхождению включения подразделяются на первичные (аутогенные), вторичные (ксеногенные) и с нарушенной текстурой (катакластические) .
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ ЛЬДА. Температура, при которой происходит плавление льда при постоянном внешнем давлении. Плавление морского льда происходит не при определенной температуре, как у пресного льда, а непрерывно, начиная с момента, когда температура ниже 0°С до температуры замерзания морской воды данной солености.
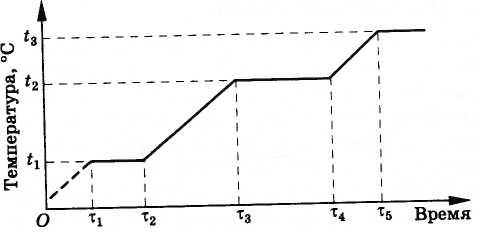
Ход температуры во льду во времени при подводе к нему теплоты
1 - 2 - нагревание льда; 2 - 3 - плавление льда: 3 - 4- нагревание воды; t пл -температура плавления льда.
Плавление льда при атмосферном давлении происходит при температуре 0,01°С (в практических расчетах принимают 0°С). Количество теплоты, которое необходимо сообщить 1 кг льда, находящемуся при температуре плавления, для превращения его в воду, называют удельной теплотой плавления L пл. Удельная теплота плавления пресноводного льда при нормальных условиях равна удельной теплоте кристаллизации воды 33,3·10 4 Дж/кг.
ТЕМПЕРАТУРОПРОВОДНОСТЬ ЛЬДА (КОЭФФИЦИЕНТ ТЕМПЕРАТУРОПРОВОДНОСТИ). Параметр, характеризующий скорость изменения температуры льда в нестационарных тепловых процессах. Коэффициент температуропроводности льда
a = λ/Cpρ),
где C p - удельная теплоемкость льда при постоянном давлении, ρ - плотность льда, λ- коэффициент теплопроводности, численно равен повышению температуры единицы объема льда в результате теплового потока, соответствующего коэффициенту теплопроводности Cp.
Ice II is rhombohedral. It has similarities, not surprisingly, to Ice I inthat it consists of undulating six-membered rings joined to another ring belowit. However, neighboring rings do not form a complete hexagonal network butinstead surround threefold screw axes. The diagram below shows the rings in Ice I(left) and Ice II (right). Altitudes of rings around the screw axes areindicated on the right diagram. Since the rings enclose vacancies, the Ice IIstructure actually has less void space and is denser. The density is 1.17 gm/cc.
If the structure above looks familiar, it should. The oxygen atoms have the same arrangement as the carbon atoms in diamond. This form of ice is called Ice Ic.
At left is a cubic unit cell of Ice Ic, with only the oxygens shown. O-H-O links are in orange.
The diagram below shows the relationship of the cubic unit cell to the close packing layers.
Ice Ic forms from the vapor below about -80 C and appears to be a metastableform of ice, although it has almost exactly the same density as Ice Ih. Ice Ihdoes not change to Ice Ic at very low temperatures but Ice Ic reverts readily toIce Ih when warmed above -80 C. Ice Ic may form in extremely high clouds andsome halo features not readily explainable in terms of hexagonal ice have beenattributed to Ice Ic.
The structure of Ice II is shown. There are two sets of rings withslightly differing degrees of undulation, shown in green and light blue. In terms ofc-axis dimensions, one set is centered on altitudes 0, 1/3, 2/3 and one, theother on 1/6, 1/2 and 5/6. The two sets alternate vertically and are clusteredaround three-fold screw axes. If we denote the two sets of rings as P and Q,then the rings are linked around each three-fold axis in the mannerP-Q-P-Q-P-Q-. Links in the two types of rings are red and purple, cross-linksare dark blue.
Ice II is tetragonal. The unit cell is cubic in dimensions (6.83 Angstromunits on a side) but tetragonal in symmetry. The density is 1.14 gm/cc. The tetrahedral O-H-O links aresomewhat distorted. In the diagram below, oxygen atoms are shown in blue withlarger atoms closer to the viewer. O-H-O links are in red, with thicker linescloser to the viewer. Links ending in an arrow are pointing down to a deeperlevel, those with pointed ends are pointing up to a higher level. Several levelsof the structure are shown. Atoms shown as the same size may actually be atslightly different elevations. For example, the L-shaped sets of three atoms ina right angle are actually slightly tilted relative to the plane of the diagram.The tilted squares of oxygens surround fourfold screw axes.
At left is a top view of the Ice Ih structure. Red dots on some atoms mark a B layer with O-H-O links pointing up to the next B layer. Other atoms are in an A layer and have O-H-O links pointing down to the next A layer.
High-Pressure Ice Polymorphs
Ice exhibits a large number of polymorphs as shown at left. The ice in your tea is Ice I.
Ice I converts to Ice II or Ice III at about 2 kb. At the base of the Antarctic Ice Cap (5 km thick) the pressure is only about 0.5 kb. So ice on earth never gets thick enough to convert to a denser phase. We reach higher pressures in the crust, but at temperatures far beyond the melting points of any type of ice.
However, dense phases of ice almost certainly exist in the interiors of large satellites in the outer Solar System, and are probably easily produced by shock metamorphism during meteoroid impacts.
Ice V is monoclinic. In the diagram below, oxygen atoms are shown in blue withlarger atoms closer to the viewer. O-H-O links are in red, with thicker linescloser to the viewer. Links ending in an arrow are pointing down to a deeperlevel, those with pointed ends are pointing up to a higher level. Several levelsof the structure are shown. Atoms shown as the same size may actually be atslightly different elevations. The unit cell is shown in gray (one set of edgesruns horizontally and is largely hidden by atoms and bonds, but it"s there. Lookclosely).
Ice VI is tetragonal, with a = 6.27 Angstrom units and c = 5.79 - nearlycubic. The density is 1.31 gm/cc. It can be described as a "self-clathrate." A clathrate is amolecule surrounded by a cage of water molecules. In Ice VI, there are clustersof five water molecules, a central molecule in a tetrahedral cage of fourothers. The centers of the clusters lie at the corners and centers of abody-centered tetragonal lattice, and the surrounding molecules are 3/8c aboveand below the central molecule.
Closely packed structures do not allow tetrahedral linkages very well. Ice VIand Ice VII achieve their density by having two interpenetrating butdisconnected lattices. In this diagram the O-H-O links in the two separatenetworks are shown in red and purple.
oxygen atoms are shown in blue with larger atoms closerto the viewer. The two networks of O-H-O links are in red and purple, with thicker lines closer to the viewer.Links ending in an arrow are pointing down to a deeper level, those with pointedends are pointing up to a higher level. Several levels of the structure areshown.
In some ways Ice VII is easiest to understand, because it consists of twointerpenetrating Ice Ic lattices.
The two interpenetrating sets of lattices are shown in orange and red. The unit cell consists of eight body-centered cubes.
Ice VII has a density of 1.66 gm/cc.
The Ice VII unit cell consists of body-centered cubes, which are prettytightly packed. An ice structure based on close-packed water molecules wouldrequire highly distorted bonds, and theoretical calculations suggest that IceVII is the stable form up to at least 200 kilobars. At earth gravity, 200kilobars would correspond to a depth of about 1500 kilometers of ice, takingphase changes into account.
At extremely high pressures we might expect water molecules to break downentirely and a close packed structure with ionic bonding to form.
При плавлении происходит разрушение пространственной решетки кристаллического тела. На этот процесс расходуется определенное количество энергии от какого-нибудь внешнего источника. В результате внутренняя энергия тела в процессе плавления увеличивается.
Количество теплоты, необходимое для перехода тела из твердого состояния в жидкое при температуре плавления, называется теплотой плавления.
В процессе отвердевания тела, наоборот, внутренняя энергия тела уменьшается. Тело отдает теплоту окружающим телам. Согласно закону сохранения энергии количество теплоты, поглощенное телом при плавлении (при температуре плавления), равно количеству теплоты, отданному этим телом при отвердевании (при температуре отвердевания).
Удельная теплота плавления
Теплота плавления зависит от массы плавящегося вещества и его свойств. Зависимость теплоты плавления от рода вещества характеризуют удельной теплотой плавления этого вещества.
Удельной теплотой плавления вещества называется отношение теплоты плавления тела из этого вещества к массе тела.
Обозначим теплоту плавления через Q пл , массу тела буквой т и удельную теплоту плавления буквой λ. Тогда
Таким образом, чтобы расплавить кристаллическое тело массой m , взятое при температуре плавления, необходимо количество теплоты, равное
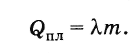 (8.8.2)
(8.8.2)
Теплота кристаллизации
Согласно закону сохранения энергии количество теплоты, выделяемое при кристаллизации тела (при температуре кристаллизации), равно
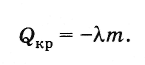 (8.8.3)
(8.8.3)
Из формулы (8.8.1) следует, что удельная теплота плавления в СИ выражается в джоулях на килограмм.
Довольно велика удельная теплота плавления льда 333,7 кДж/кг. Удельная теплота плавления свинца всего лишь 23 кДж/кг, а золота - 65,7 кДж/кг.
Формулы (8.8.2) и (8.8.3) используются при решении задач на составление уравнений теплового баланса в тех случаях, когда мы имеем дело с плавлением и отвердеванием кристаллических тел.
Роль теплоты плавления льда и кристаллизации воды в природе
Поглощение теплоты при таянии льда и выделение ее при замерзании воды оказывают значительное влияние на изменение температуры воздуха, особенно вблизи водоемов. Все вы, вероятно, замечали, что во время обильных снегопадов обычно наступает потепление.
Очень важно большое значение удельной теплоты плавления льда. Еще в конце XVIII в. шотландский ученый Д. Блэк (1728-1799), открывший существование теплоты плавления и кристаллизации, писал: «Если бы лед не обладал значительной теплотой плавления, то тогда весной вся масса льда должна была бы растаять в несколько минут или секунд, так как теплота из воздуха непрерывно передается льду. Но тогда последствия этого были бы ужасны: ведь и при существующем положении возникают большие наводнения и сильные потоки воды при таянии больших масс льда и снега».
Сопло космической ракеты
Приведем интересный технический пример практического использования теплоты плавления и парообразования. При изготовлении сопла для космической ракеты следует учитывать, что струя газов, выходящая из сопла ракеты, имеет температуру около 4000 °С. В природе практически отсутствуют материалы, которые в чистом виде могли бы выдержать такую температуру. Поэтому приходится прибегать ко всякого рода ухищрениям, чтобы охладить материал сопла во время горения топлива.
Сопло изготавливают методом порошковой металлургии. В полость формы закладывается порошок тугоплавкого металла (вольфрам). Затем его подвергают сдавливанию. Порошок спекается, получается пористая структура типа пемзы. Затем эта «пемза» пропитывается медью (ее температура плавления всего 1083 °С).
Полученный материал называется псевдосплавом. На рисунке 8.31 показана фотография микроструктуры псевдосплава. На белом фоне вольфрамового каркаса видны медные включения неправильной формы. Этот сплав может, как это ни невероятно, кратковременно работать даже при температуре газов, образующихся при сгорании топлива, т. е. выше 4000°С.

Происходит это следующим образом. Вначале температура сплава растет, пока не достигнет температуры плавления меди t 1 (рис. 8.32). После этого температура сопла не будет меняться, пока вся медь не расплавится (промежуток времени от τ 1 до τ 2 ). В дальнейшем температура опять возрастает до тех пор, пока медь не закипит. Это происходит при температуре t 2 = 2595 °С, меньшей температуры плавления вольфрама (3380 °С). Пока вся медь не выкипит, температура сопла опять меняться не будет, так как испаряющаяся медь забирает теплоту от вольфрама (промежуток времени от τ 3 до τ 4 ). Конечно, сколько угодно долго сопло работать не будет. После испарения меди вольфрам опять начнет нагреваться. Однако двигатель ракеты работает всего лишь несколько минут, а за это время сопло не успеет перегреться и расплавиться.