Oksitlerin oksijenle etkileşimi. Oksitler. Makbuz ve özellikler. Oksitlerin birbirleriyle etkileşimi
Oksitler, biri oksidasyon durumuna ($-2$) sahip oksijen olan iki kimyasal elementten oluşan karmaşık maddelerdir.
Oksitlerin genel formülü şöyledir: $E_(m)O_n$, burada $m$, $E$ elementinin atom sayısıdır ve $n$, oksijen atomlarının sayısıdır. Oksitler olabilir zor(kum $SiO_2$, kuvars çeşitleri), sıvı(hidrojen oksit $H_2O$), gazlı(karbon oksitler: karbondioksit $CO_2$ ve karbondioksit $CO$ gazları). Kimyasal özelliklerine göre oksitler tuz oluşturan ve tuz oluşturmayan olarak ikiye ayrılır.
Tuz oluşturmayan Bunlar alkaliler veya asitlerle reaksiyona girmeyen ve tuz oluşturmayan oksitlerdir. Bunlardan çok azı var, metal olmayanlar içeriyorlar.
Tuz oluşturan Bunlar asitler veya bazlarla reaksiyona girerek tuz ve su oluşturan oksitlerdir.
Tuz oluşturan oksitler arasında oksitler vardır bazik, asidik, amfoterik.
Bazik oksitler- bunlar bazlara karşılık gelen oksitlerdir. Örneğin: $CaO$ $Ca(OH)_2'ye, Na_2O ise NaOH$'a karşılık gelir.
Bazik oksitlerin tipik reaksiyonları:
1. Bazik oksit + asit → tuz + su (değişim reaksiyonu):
$CaO+2HNO_3=Ca(NO_3)_2+H_2O$.
2. Bazik oksit + asidik oksit → tuz (bileşik reaksiyonu):
$MgO+SiO_2(→)↖(t)MgSiO_3$.
3. Bazik oksit + su → alkali (bileşik reaksiyonu):
$K_2O+H_2O=2KOH$.
Asidik oksitler- bunlar asitlere karşılık gelen oksitlerdir. Bunlar metal olmayan oksitlerdir:
N2O5, $HNO_3, SO_3 - H_2SO_4, CO_2 - H_2CO_3, P_2O_5 - H_3PO_4$'a ve ayrıca yüksek oksidasyon durumlarına sahip metal oksitlere karşılık gelir: $(Cr)↖(+6)O_3$, $H_2CrO_4, (Mn_2)↖('ye karşılık gelir +7 )O_7 — HMnO_4$.
Tipik asit oksit reaksiyonları:
1. Asit oksit + baz → tuz + su (değişim reaksiyonu):
$SO_2+2NaOH=Na_2SO_3+H_2O$.
2. Asidik oksit + bazik oksit → tuz (bileşik reaksiyon):
$CaO+CO_2=CaCO_3$.
3. Asit oksit + su → asit (bileşik reaksiyonu):
$N_2O_5+H_2O=2HNO_3$.
Bu reaksiyon ancak asit oksidin suda çözünmesi durumunda mümkündür.
Amfoterik Koşullara bağlı olarak bazik veya asidik özellikler sergileyen oksitlere denir. Bunlar $ZnO, Al_2O_3, Cr_2O_3, V_2O_5$'dır. Amfoterik oksitler suyla doğrudan birleşmezler.
Amfoterik oksitlerin tipik reaksiyonları:
1. Amfoterik oksit + asit → tuz + su (değişim reaksiyonu):
$ZnO+2HCl=ZnCl_2+H_2O$.
2. Amfoterik oksit + baz → tuz + su veya kompleks bileşik:
$Al_2O_3+2NaOH+3H_2O(=2Na,)↙(\text"sodyum tetrahidroksoalüminat")$
$Al_2O_3+2NaOH=(2NaAlO_2)↙(\text"sodyum alüminat")+H_2O$.
Oksitler, biri oksijen olan iki elementten oluşan karmaşık maddelerdir. Oksitler tuz oluşturucu ve tuz oluşturucu olmayabilir: tuz oluşturucu oksitlerin bir türü bazik oksitlerdir. Diğer türlerden farkı nedir ve kimyasal özellikleri nelerdir?
Tuz oluşturan oksitler bazik, asidik ve amfoterik oksitlere ayrılır. Bazik oksitler bazlara karşılık geliyorsa, asidik oksitler asitlere ve amfoterik oksitler amfoterik oluşumlara karşılık gelir. Amfoterik oksitler, koşullara bağlı olarak bazik veya asidik özellikler gösterebilen bileşiklerdir.

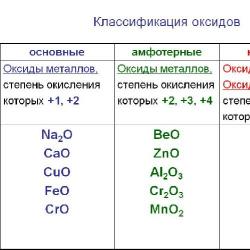
Pirinç. 1. Oksitlerin sınıflandırılması.
Oksitlerin fiziksel özellikleri çok çeşitlidir. Gazlar (CO2), katılar (Fe203) veya sıvı maddeler (H2O) olabilirler.
Ancak bazik oksitlerin çoğu çeşitli renklerde katılardır.
Elementlerin en yüksek aktiviteyi gösterdiği oksitlere yüksek oksitler denir. Karşılık gelen elementlerin yüksek oksitlerinin asidik özelliklerinin soldan sağa doğru periyotlardaki artış sırası, bu elementlerin iyonlarının pozitif yükündeki kademeli bir artışla açıklanmaktadır.
Bazik oksitlerin kimyasal özellikleri
Bazik oksitler, bazların karşılık geldiği oksitlerdir. Örneğin, bazik oksitler K2O, CaO, KOH, Ca(OH)2 bazlarına karşılık gelir.

Pirinç. 2. Bazik oksitler ve bunlara karşılık gelen bazlar.
Bazik oksitler, tipik metallerin yanı sıra en düşük oksidasyon durumunda (örneğin, CaO, FeO) değişken değerlikli metaller tarafından oluşturulur, asitler ve asit oksitlerle reaksiyona girerek tuzlar oluşturur:
CaO (bazik oksit) + CO2 (asit oksit) = CaCO3 (tuz)
FeO (bazik oksit)+H2SO4 (asit)=FeSO4 (tuz)+2H2O (su)
Bazik oksitler ayrıca amfoterik oksitlerle de reaksiyona girerek bir tuzun oluşmasına neden olur, örneğin:
Yalnızca alkali ve alkali toprak metallerin oksitleri suyla reaksiyona girer:
BaO (bazik oksit)+H 2 O (su)=Ba(OH) 2 (alkali toprak metal bazı)
Birçok bazik oksit, tek bir kimyasal elementin atomlarından oluşan maddelere indirgenme eğilimindedir:
3CuO+2NH3 =3Cu+3H2O+N2
Isıtıldığında yalnızca cıva oksitleri ve asil metaller ayrışır:

Pirinç. 3. Cıva oksit.
Ana oksitlerin listesi:
| Oksit adı | Kimyasal formül | Özellikler |
| Kalsiyum oksit | CaO | sönmemiş kireç, beyaz kristalli madde |
| Magnezyum oksit | MgO | beyaz madde, suda az çözünür |
| Baryum oksit | BaO | kübik kafesli renksiz kristaller |
| Bakır oksit II | CuO | suda pratik olarak çözünmeyen siyah madde |
| HgO | kırmızı veya sarı-turuncu katı | |
| Potasyum oksit | K2O | renksiz veya soluk sarı madde |
| Sodyum oksit | Na2O | renksiz kristallerden oluşan madde |
| Lityum oksit | Li2O | kübik kafes yapısına sahip renksiz kristallerden oluşan bir madde |
Oksitler- oksijenin -2 oksidasyon durumunu sergilediği oksijenli bir elementin ikili bileşikleri.
İsimlendirme. Oksijen ile belirli bir bileşiği oluşturan elementin sabit bir değeri varsa, o zaman buna (bileşik) basitçe oksit denir: Na20 - sodyum oksit, CaO - kalsiyum oksit, BaO - baryum oksit, ZnO - çinko oksit.
Bir elementin değişken bir değeri varsa, oksit adının yanında elementin değeri gösterilir: Cr203 - krom(III) oksit, Cl207 - klor oksit(VII), Hg2O - cıva(I) oksit.
Bir element birkaç oksit oluşturuyorsa, oksidin bileşimi dikkate alınarak adları verilir (önemsiz isimler verebilirsiniz, elementin değerini parantez içinde belirtebilirsiniz): N 2 O - nitrojen hemioksit, N 2 O 3 - nitrojen seks dioksit, NO - nitrojen monoksit, NO 2 - dioksit nitrojen, N 2 O 5 - nitrojen hemipentoksit.
Tüm oksitler 2 büyük gruba ayrılır: tuz oluşturan ve tuz oluşturmayan.
Tuz oluşturmayan oksitler (kayıtsız) - pek çoğu yok: CO, N 2 O , HAYIR.
Her ne kadar CO'yu tuz oluşturmayan oksitler olarak sınıflandırmak pek doğru olmasa da, alkali eriyiklerle reaksiyona girerek aşağıdaki formatları oluşturduğundan:
CO + NaOH (eriyik) → HCOONa.
Tuz oluşturan oksitler ikiye ayrılır: bazik, asidik ve amfoterik.
Temel oksitler. Bunlar asitlerle veya asidik oksitlerle veya amfoterik olanlarla reaksiyona girdiğinde tuz oluşturan oksitlerdir. Bazik oksitler yalnızca düşük oksidasyon durumlarına sahip metal oksitlerdir: Na 2 O, K 2 O, CaO, BaO, MnO, FeO, Fe 2 O 3, Fe 3 O 4. Metal oksitlerin tümü bazik değildir, bazıları amfoterik veya asidik.
H2S04 → CuS04 +H20;
Na 2 O+S02 → Na 2 SO 3
Asidik oksitler. Bunlar bazlarla veya bazik oksitlerle veya amfoterik olanlarla reaksiyona girdiğinde tuz oluşturan oksitlerdir. Asidik oksitlerin çoğu, suyla reaksiyona girdiğinde asit verir, bu nedenle bunlara asit anhidritler (P205 - fosforik anhidrit, N205 - nitrik anhidrit) de denir. Oksidasyon durumu 5 ve daha yüksek olan metal olmayan ve metallerin oksitleri asidiktir: NO 2, Mn207, Si02, CO2.
C02 +Na20→Na2C03;
V205 + 2NaOH→2NaVO3 + H20
Amfoterik oksitler. Bunlar hem bazik hem de asidik oksitlerle etkileşime girdiğinde tuz oluşturan oksitlerdir.Örneğin: ZnO, Al203, BeO, SnO, PbO, Fe203, Cr203, MnO2, TiO2.
PbO+2NaOH→ Na2PbO2+H20;
ZnO+2HCl→ZnCl2 +H2O
Karışık oksitler. Bunlar, farklı değerlere sahip oksitlerin bir kombinasyonu olan bileşiklerdir: Fe 3 O 4 ↔ Fe 2 O 3 ∙ FeO.
Bileşikler Pb203 ↔PbPbO 3 (kurşun(II) plumbat);Mn304 ↔Mn2MnO4 (manganez manganat IV); Fe 3 O 4 ↔ Fe (FeO 2 ) 2 (demir ferrit(II) ) çift veya karışık oksitler olarak adlandırılırlar, aynı zamanda tuz olarak da kabul edilebilirler. Sonuç olarak, karışık bir oksidin molekülleri, aynı elementin farklı oksidasyon durumlarındaki atomlarını içerir. Peroksitler. Bu bileşikler, oksitler gibi, metal ve oksijenden oluşur, ancak hidrojen peroksit tuzları oldukları için kimyasal özellikleri bakımından onlardan önemli ölçüde farklıdır ( H 2 O 2 ): Na 2 O 2 , K 2 O 2 , BaO 2 , ZnO 2 , Cs 2 O 2 .Peroksitlerde oksijenin oksidasyon durumu -1'dir. Zayıf bir peroksit grubunun varlığı nedeniyle - O-O - asitler sıradan tuzların oluşumuyla birlikte etki ettiğinde oksijen de açığa çıkarırlar:
2Na 2 O 2 +4HCl→4NaCl+2H 2 O+O 2
Alkali ve alkalin toprak metallerinin peroksitleri, karşılık gelen hidroksit ve hidrojen peroksiti oluşturmak üzere suyla reaksiyona girer.
Na 2 O 2 +2H 2 O → 2NaOH+H 2 O 2
Süperoksitler.Bu oksidasyon durumunda oksijen atomları içeren bileşikler – 1 ⁄ 2. İyi oksitlenme özelliğine sahiptir. NaO2, K02, Ba (O2) 2.
4NaO2 +2H2O→4NaOH+3O2
2NaO2 +2HCl→2NaCl+H2O2 +O2
4KO 2 +2CO 2 → K 2 CO 3 +3O 2 )
(Bu reaksiyon, gaz maskelerinde solunan havayı arıtmak için kullanıldığı için pratik öneme sahiptir)
2 NaO2 + S → Na2S04
Ozonitler.
Bunlar bağlantılar alkalin , Alkalin toprak olan metaller oksijen ozonid iyonu O3- içerir. Kırmızı amonyum ozonit de elde edildi - N H 4 Ozonitler.Tüm ozonitler güçlü oksitleyici maddelerdir.Bu maddeler, ozon akımıyla yıkanan karşılık gelen alkali metallerin katı hidroksitlerinin yüzeyinde turuncu-kırmızı bir kabuk şeklinde oluşur.Ozonitler, metal süperoksit ve oksijen oluşumu ile ayrışır. ve ayrıca karşılık gelen alkali ve oksijenin oluşumuyla suyun etkisi altında ayrışır. NaO3, KO3, CsO3, Ba(O3)2.
4 NaO3 +2 H2O →4 NaOH +5 O2
2NaO3 →2NaO2 +O2 ( Ayrışma farklı sıcaklıklarda meydana gelir; örneğin: -10°C'de sodyum ozonidin ayrışması°C , +100'de sezyum ozonit°C)
4NH 4 O 3 →4H 2 O+2NH 4 NO 3 +O 2
Oksit üretme yöntemleri.
Maddelerin oksijenle etkileşimi. Birçok madde karşılık gelen oksidi oluşturmak için oksijen içinde yanar (fosfor gibi bazı maddelerde oksidin bileşimi oksijen miktarına bağlıdır).
4 P +3O 2 →2 P 2 Ö 3 (oksijen eksikliği ile)
4 P +5 Ö 2 →2 P 2 Ö 5 (aşırı oksijen ile)
2Mg+O 2 →2MgO
Daha yüksek oksitlerin ayrışması . Bir elementin değişken bir değerliği varsa, o zaman daha az oksijen içeren oksidi, elementin daha yüksek bir oksidasyon durumu sergilediği oksidin ayrıştırılmasıyla elde edilebilir:
2 N 2 Ö 5 →4 NO 2 + Ö 2
2 SO 3 ⇌ 2 SO 2 +O 2 ( buraya tersine çevrilebilirlik işareti koymak gerekir, çünkü aksine N2O5,SO3 kararsız bir oksittir ve sentezi/ayrışması sırasında reaktanlar ve ürün arasında bir denge kurulur)
Düşük oksitlerin oksidasyonu. Bir elementin değişken bir değerliği varsa, o zaman yüksek oksijen içeriğine sahip oksidi, elementin düşük bir oksidasyon durumu sergilediği oksidin oksitlenmesiyle elde edilebilir:
2CO+O2 →2CO2
2Cr 2 Ö 3 +3O 2 →4CrO 3
Bazların ayrışması. Çözünmeyen veya az çözünen bazlar ısıtıldıklarında su kaybederek bazik oksitlere dönüşürler:
Cu(OH)2 ↓→CuO+H2O
Ca(OH)2 →CaO+H20
Asitlerin ayrışması. Oksijen içeren bazı asitler ısıtıldığında su kaybederek asit oksitler oluşturur. Ayrıca bazı asitler çözelti içinde çok kısa bir süre kalır ve neredeyse anında anhidrit ve suya ayrışır. Bir su giderici madde (P 2 O 5) * ekleyerek bir asitten asit oksit elde edebilirsiniz (üzerinden geçirilen bir maddenin buharındaki su izlerini gideren konsantre H 2 SO 4 ile karıştırılmamalıdır) .
H 2 SiO 3 ↓→ SiO 2 ↓+H 2 O
H 2 CO 3 →CO 2 +H 2 O
4HNO 3 → 4NO 2 +2H 2 O+O 2
Tuzların ayrışması. Oksijen içeren tuzların çoğu ısıtıldığında metal oksit ve asit anhidrit oluşturacak şekilde ayrışır. Metal oksit termal olarak kararsızsa tuz metal, asit oksit ve serbest oksijene ayrışır. Alkali metal tuzları termal olarak oldukça kararlıdır; ısıtıldıklarında ayrışırlarsa oksit oluşturmazlar.
CaCO3 →CaO+CO2
*Bu ilginç:
NH 4 NO 3 →N 2 O+2H 2 O
NH 4 NO 2 → N 2 +2H 2 O (azot üretmek için bir laboratuvar yöntemi, ancak aslında konsantre bir sodyum nitrit çözeltisi üzerinde amonyum klorür ile etki ederler ve elde edilen gaz daha sonra amonyak, klor vb. yabancı maddelerden arındırılır.)
(NH 4) 2 Cr 2 O 7 →N 2 +Cr 2 O 3 +4H 2 O
4AgNO3 →4Ag↓+4NO2 +O2
Bazı oksitlerin diğerleriyle yer değiştirmesi. Daha az uçucu oksitler, daha uçucu olanları tuzlarından uzaklaştırır. Bu reaksiyonlar çok yüksek sıcaklıklarda meydana gelir:
Na 2 CO 3 +SiO 2 →Na 2 SiO 3 +CO 2
Oksitleyici asitlerin metaller ve metal olmayanlarla etkileşimi. Seyreltik nitrik asit ve konsantre sülfürik asit, metalleri ve metal olmayanları oksitleyerek karşılık gelen tuzları/asitleri oluşturur ve orijinal asitlerden daha düşük bir oksidasyon durumunda nitrojen/kükürt oksitleri açığa çıkarır. (Mangenezin solundaki metallerle çok seyreltik nitrik asit, gaz değil, amonyum nitrat üretir).
3As+5HNO 3 +2H 2 O→3H 3 AsO 4 +5NO
Cu+2H 2 SO 4 →CuSO 4 +SO 2 +2H 2 O
8Al+30HNO 3 → 8Al(NO 3) 3 +3NH 4 NO 3 +9H 2 O
Peroksitler, süperoksitler, ozonitlerin üretim yöntemleri.
Alkali metaller durumunda, havada yanmaları sırasında peroksitler ve süperoksitler oluşur (bir karışım oluşur) * (havada yanma sırasında alkali metallerin normal oksidi yalnızca lityum oluşturur, sodyum, peroksit ağırlıklı bir karışım oluşturur, daha sonra hafif bir peroksit karışımıyla neredeyse tamamen süperoksit oluşumu).
2Na+O2 →Na2O2
Metal peroksitler, hidrojen peroksitin hidroksitleri üzerindeki etkisiyle elde edilebilir:
Ba(OH)2 +H2O2 →BaO2 ↓+2H2O
Süperoksitler, peroksitlerin oksidasyonu ile elde edilir (alkali metaller hariç, çünkü sodyumun ötesindeki metaller, hafif bir peroksit karışımıyla süperoksitler oluşturur).
BaO 2 +O 2 →Ba(O 2) 2
Alkali metal ozonitler, katı hidroksitlerinin okon ile etkileşimi, süperoksitlerin ozonlanmasıyla elde edilir.Amonyum ozonit, sıvı amonyağın -100°C'de ozonlanmasıyla elde edilir.
4 NaOH +4 O3 →4 NaO3 + O2 +2 H2O
NaO2 +O3 →NaO3 +O2
Oksitlerin su ile olan bileşiklerine oksit hidratlar denir.Bir okside su eklenmesi, özelliklerinde radikal bir değişikliğe yol açmaz. Oksit hidratların ortak bir adı vardır - hidroksitler.
Editör: Galina Nikolaevna Kharlamova
Oksitler.
Bunlar biri oksijen olan İKİ elementten oluşan karmaşık maddelerdir. Örneğin:
CuO – bakır(II) oksit
AI 2 O 3 – alüminyum oksit
SO3 – kükürt oksit (VI)
Oksitler 4 gruba ayrılır (sınıflandırılır):
Na 2 O– Sodyum oksit
CaO – Kalsiyum Oksit
Fe 2 O 3 - demir (III) oksit
2). Asidik– Bunlar oksitler metal olmayanlar. Ve bazen metalin oksidasyon durumu > 4 ise metaller. Örneğin:
CO 2 – Karbon monoksit (IV)
P 2 O 5 – Fosfor (V) oksit
SO 3 – Kükürt oksit (VI)
3). Amfoterik– Bunlar hem bazik hem de asidik oksitlerin özelliklerine sahip olan oksitlerdir. En yaygın beş amfoterik oksidi bilmeniz gerekir:
BeO-berilyum oksit
ZnO – çinko oksit
AI 2 O 3 – Alüminyum oksit
Cr 2 O 3 – Krom (III) oksit
Fe 2 O 3 – Demir (III) oksit
4). Tuz oluşturmayan (kayıtsız)– Bunlar, bazik veya asidik oksitlerin özelliklerini göstermeyen oksitlerdir. Hatırlanması gereken üç oksit vardır:
CO – karbon monoksit (II) karbon monoksit
NO – nitrik oksit (II)
N 2 O - nitrik oksit (I) gülme gazı, nitröz oksit
Oksit üretme yöntemleri.
1). Yanma, yani. Basit bir maddenin oksijenle etkileşimi:
4Na + Ö2 = 2Na2Ö
4P + 5O2 = 2P205
2). Yanma, yani. karmaşık bir maddenin oksijeni ile etkileşimi (aşağıdakilerden oluşur) iki element) böylece oluşur iki oksit.
2ZnS + 3O2 = 2ZnO + 2SO2
4FeS2 + 11O2 = 2Fe203 + 8SO2
3). Ayrışma üç zayıf asitler. Diğerleri ayrışmaz. Bu durumda asit oksit ve su oluşur.
H2C03 = H2O + C02
H 2 SO 3 = H 2 O + SO 2
H 2 SiO 3 = H 2 O + SiO 2
4). Ayrışma çözünmez gerekçesiyle. Bazik bir oksit ve su oluşur.
Mg(OH)2 = MgO + H20
2Al(OH)3 = Al203 + 3H20
5). Ayrışma çözünmez tuzlar Bir bazik oksit ve bir asidik oksit oluşur.
CaCO3 = CaO + CO2
MgS03 = MgO + SO2
Kimyasal özellikler.
BEN. Temel oksitler.
alkali.
Na20 + H20 = 2NaOH
CaO + H20 = Ca(OH)2
СuO + H 2 O = reaksiyon oluşmaz çünkü bakır içeren olası baz - çözünmez
2). Asitlerle etkileşime girerek tuz ve su oluşumu. (Baz oksit ve asitler HER ZAMAN reaksiyona girer)
K2O + 2HCI = 2KCl + H2O
CaO + 2HNO3 = Ca(NO3)2 + H2O
3). Asidik oksitlerle etkileşime girerek tuz oluşumuna neden olur.
Li 2 O + C02 = Li 2 C03
3MgO + P205 = Mg3 (PO4)2
4). Hidrojen ile etkileşim metal ve su üretir.
CuO + H2 = Cu + H2O
Fe203 + 3H2 = 2Fe + 3H20
II.Asidik oksitler.
1). Su ile etkileşim oluşmalı asit.(SadeceSiO 2 su ile etkileşime girmez)
C02 + H20 = H2C03
P 2 Ö 5 + 3H 2 Ö = 2H 3 PO 4
2). Çözünür bazlar (alkaliler) ile etkileşim. Bu tuz ve su üretir.
S03 + 2KOH = K2S04 + H20
N205 + 2KOH = 2KNO3 + H20
3). Bazik oksitlerle etkileşim. Bu durumda sadece tuz oluşur.
N 2 Ö 5 + K 2 Ö = 2KNO 3
Al 2 Ö 3 + 3SO 3 = Al 2 (S04) 3
Temel egzersizler.
1). Reaksiyon denklemini tamamlayın. Türünü belirleyin.
K 2 Ö + P 2 Ö 5 =
Çözüm.
Sonuç olarak ne oluştuğunu yazmak için, hangi maddelerin reaksiyona girdiğini belirlemek gerekir - burada özelliklere göre potasyum oksit (bazik) ve fosfor oksit (asidik) - sonuç TUZ olmalıdır (bkz. özellik No. 3) ) ve tuz, metal atomlarından (bizim durumumuzda potasyum) ve fosfor (yani P04-3 - fosfat) içeren bir asidik kalıntıdan oluşur.
3K 2 Ö + P 2 Ö 5 = 2K 3 RO 4
reaksiyon türü - bileşik (iki madde reaksiyona girdiği için ancak bir tane oluştuğu için)
2). Dönüşümleri gerçekleştirin (zincir).
Ca → CaO → Ca(OH) 2 → CaCO 3 → CaO
Çözüm
Bu alıştırmayı tamamlamak için her okun bir denklem (bir kimyasal reaksiyon) olduğunu hatırlamanız gerekir. Her oku numaralandıralım. Bu nedenle 4 denklemin yazılması gerekmektedir. Okun solunda yazılan madde (başlangıç maddesi) reaksiyona girer, sağda yazılan madde ise reaksiyon sonucu (reaksiyon ürünü) oluşur. Kaydın ilk bölümünü deşifre edelim:
Ca + …..→ CaO Basit bir maddenin reaksiyona girdiğini ve bir oksit oluştuğunu görüyoruz. Oksitlerin (No. 1) üretilmesine yönelik yöntemleri bilerek, bu reaksiyona -oksijen (O2) eklemenin gerekli olduğu sonucuna varıyoruz.
2Ca + Ö2 → 2CaO
2 numaralı dönüşüme geçelim
CaO → Ca(OH)2
CaO + ……→ Ca(OH)2
Burada bazik oksitlerin özelliğini - su ile etkileşimi - uygulamanın gerekli olduğu sonucuna vardık, çünkü yalnızca bu durumda oksitten bir baz oluşur.
CaO + H 2 O → Ca(OH) 2
3 numaralı dönüşüme geçelim
Ca(OH)2 → CaC03
Ca(OH)2 + ….. = CaCO3 + …….
Burada karbondioksit CO 2'den bahsettiğimiz sonucuna varıyoruz çünkü yalnızca alkalilerle etkileşime girdiğinde bir tuz oluşturur (asit oksitlerin 2 numaralı özelliğine bakın)
Ca(OH)2 + C02 = CaC03 + H20
4 numaralı dönüşüme geçelim
CaCO 3 → CaO
CaCO3 = ….. CaO + ……
Burada daha fazla CO2 oluştuğu sonucuna varıyoruz çünkü CaCO3 çözünmeyen bir tuzdur ve bu tür maddelerin ayrışması sırasında oksitler oluşur.
CaCO3 = CaO + CO2
3). Aşağıdaki maddelerden hangisi CO 2 ile etkileşime girer? Reaksiyon denklemlerini yazın.
A). Hidroklorik asit B). Sodyum hidroksit B). Potasyum oksit d). su
D). Hidrojen E). Kükürt(IV) oksit.
CO2'nin asidik bir oksit olduğunu belirledik. Ve asidik oksitler su, alkaliler ve bazik oksitlerle reaksiyona girer... Bu nedenle, verilen listeden B, C, D cevaplarını seçiyoruz ve reaksiyon denklemlerini onlarla birlikte yazıyoruz:
1). C02 + 2NaOH = Na2C03 + H20
2). CO2 + K2O = K2C03
2. Oksitlerin sınıflandırılması, hazırlanması ve özellikleri
İkili bileşikler arasında oksitler en iyi bilinenidir. Oksitler, biri oksijen olan ve oksidasyon durumu -2 olan iki elementten oluşan bileşiklerdir. Fonksiyonel özelliklerine göre oksitler ikiye ayrılır: tuz oluşturan ve tuz oluşturmayan (kayıtsız). Tuz oluşturan oksitler ise bazik, asidik ve amfoterik olarak ayrılır.
Oksitlerin isimleri, genel durumdaki “oksit” kelimesi ve elementin Rusça adı kullanılarak oluşturulur; bu, elementin Romen rakamlarıyla değerini gösterir, örneğin: S02 - kükürt oksit (IV), S03 - kükürt oksit (VI), CrO - krom oksit (II), Cr203 - krom oksit (III).
2.1. Bazik oksitler
Bazik oksitler, tuzlar oluşturmak üzere asitlerle (veya asidik oksitlerle) reaksiyona girenlerdir.
Bazik oksitler, tipik metallerin oksitlerini içerir; bazların (bazik hidroksitler) özelliklerine sahip hidroksitlere karşılık gelirler ve elementin oksidasyon durumu, oksitten hidroksite geçerken değişmez, örneğin,
Bazik oksitlerin hazırlanması
1. Oksijen atmosferinde ısıtıldığında metallerin oksidasyonu:
2Mg + O2 = 2MgO,
2Cu + O2 = 2CuO.
Bu yöntem, oksitlendiğinde genellikle peroksitler ve süperoksitler üreten alkali metaller için geçerli değildir ve yalnızca lityum yandığında oksit oluşturur. Li2O.
2. Sülfür kavurma:
2 CuS + 3 O 2 = 2 CuO + 2 SO 2,
4 FeS 2 + 11 Ö 2 = 2 Fe 2 Ö 3 + 8 SO 2.
Yöntem, sülfatlara oksitlenen aktif metallerin sülfitleri için geçerli değildir.
3. Hidroksitlerin ayrışması (yüksek sıcaklıkta):
С u (OH) 2 = CuO + H20.
Bu yöntemle alkali metal oksitler elde edilemez.
4. Oksijen içeren asitlerin tuzlarının ayrışması (yüksek sıcaklıkta):
BaCO3 = BaO + CO2,
2Pb(NO 3) 2 = 2PbO + 4NO2 + O2,
4 FeS04 = 2 Fe203 + 4S02 + O2.
Bu oksit elde etme yöntemi, bazik tuzlar da dahil olmak üzere nitratlar ve karbonatlar için özellikle kolaydır:
(ZnOH)2C03 = 2ZnO + C02 + H20.
Bazik oksitlerin özellikleri
Bazik oksitlerin çoğu, iyonik yapıya sahip katı kristalli maddelerdir; metal iyonları, O-2 oksit iyonlarıyla oldukça sıkı bir şekilde bağlantılı olan kristal kafesin düğümlerinde bulunur, bu nedenle tipik metallerin oksitleri yüksek erime ve kaynama noktalarına sahiptir.
1. Cıva oksitleri ve asil metaller hariç, çoğu temel oksit ısıtıldığında ayrışmaz:
2HgO = 2Hg + O2,
2Ag2O = 4Ag + O2.
2. Bazik oksitler ısıtıldığında asidik ve amfoterik oksitlerle, asitlerle reaksiyona girebilir:
BaO + SiO 2 = BaSiO 3,
MgO + Al 2 Ö 3 = Mg(AlO 2) 2,
ZnO + H2S04 = ZnS04 + H20.
3. (Doğrudan veya dolaylı olarak) su eklenerek bazik oksitler bazlar (bazik hidroksitler) oluşturur. Alkali ve alkali toprak metallerin oksitleri suyla doğrudan reaksiyona girer:
Li 2 O + H 2 O = 2 LiOH,
CaO + H20 = Ca(OH)2.
Bunun istisnası magnezyum oksittir MgO . Magnezyum hidroksit ondan elde edilemez Mg(OH ) 2 su ile etkileşime girdiğinde.
4. Diğer tüm oksit türleri gibi, bazik oksitler de redoks reaksiyonlarına girebilir:
Fe 2 Ö 3 + 2Al = Al 2 Ö 3 + 2Fe,
3CuO + 2NH3 = 3Cu + N2 + 3H2O,
4 FeO + O2 = 2 Fe203.
M.V. Andryukhova, L.N. Borodina