Kontrol Çalışması (90 dakika). Laboratuvar: Metan Üretimi ve Kalsiyum Karbür ile Etanol Dehidrasyonu Deneyleri
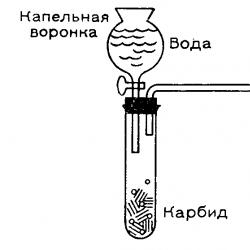
Küçük bir elektrik ark ocağına ve gerekli akım kaynağına sahip bir kimya kupasında biraz kalsiyum karbür elde edebilirsiniz. Küçük bir grafit potaya veya kalın bir karbon elektrotta oyulmuş bir girintiye, eşit miktarda (ağırlıkça) kalsiyum oksit (sönmemiş kireç) ve toplu iğne başı büyüklüğünde kok parçalarından oluşan bir karışım yerleştirin. Fazla kömür atmosferik oksijene maruz kaldığında yanacaktır. Deneyin şeması şekilde gösterilmiştir.
Üst elektrodu karışımla temas ettirerek bir elektrik arkı oluşturuyoruz. Karışım kömür parçaları sayesinde akımı iletir. Arkın mümkün olan en yüksek akımda 20-30 dakika yanmasına izin verin. Çok koyu renkli gözlüklerle (kaynak gözlüğü) gözlerinizi parlak ışıktan koruyun.
Soğutulduktan sonra karışım, deney başarılı olursa küçük karbür parçaları içeren bir eriyik haline gelir. Bunu kontrol etmek için, ortaya çıkan kütleyi suya koyuyoruz ve ortaya çıkan gaz kabarcıklarını ters çevrilmiş ve suyla doldurulmuş bir test tüpünde topluyoruz.
Laboratuvarda elektrik ark ocağı yoksa ticari olarak temin edilebilen kalsiyum karbürden kolaylıkla gaz elde edilebilir. Birkaç test tüpünü gazla dolduruyoruz - tamamen, yarım, üçte biri vb. Daha geniş kapları, örneğin bardakları gazla doldurmak imkansızdır çünkü içlerinden su akacak ve gazın hava ile karışımları elde edilecektir. gözlükler. Ateşlendiklerinde kural olarak güçlü bir patlama meydana gelir.
Kalsiyum karbür aşağıdaki denkleme göre su ile etkileşime girer:
CaC 2 + 2H 2 O \u003d Ca (OH) 2 + C 2 H 2
Kalsiyum hidroksit (hidratlı kireç) ile birlikte bu reaksiyon, üçlü bağa sahip doymamış bir hidrokarbon olan etin oluşumuna yol açar. Bu bağ nedeniyle etin yüksek reaktivite gösterir.
Etin araştırması
Bayer reaktifini veya bromlu suyu kullanarak etinde (asetilen) doymamış bir bağın varlığını kanıtlayalım. Bunu yapmak için reaktifi bir test tüpüne yerleştirin ve etileni içinden geçirin. Birkaç parça kalsiyum karbürden başka bir test tüpünde alacağız. Bu tüpü iki delikli lastik tıpa ile kapatıyoruz. Bunlardan birine önceden kavisli ucu olan bir cam tüp yerleştireceğiz - reaktif içeren bir test tüpüne batırılması gerekir. Başka bir deliğe bir damlatma hunisi yerleştirip önce musluğu kapatıyoruz. M  Bunun yerine metan üretiminde olduğu gibi musluğu bir kelepçeyle değiştirerek basit bir cam huni alabilirsiniz. Huniye su dökün ve musluğu dikkatlice açarak yavaşça, damla damla karbüre ekleyeceğiz. Etinin patlayıcı doğası göz önüne alındığında, deneyi açık bir pencerenin yakınında veya çeker ocakta gerçekleştireceğiz. Hiçbir durumda etrafta açık alev bulunmamalı veya ısıtma cihazları açık olmamalıdır.
Bunun yerine metan üretiminde olduğu gibi musluğu bir kelepçeyle değiştirerek basit bir cam huni alabilirsiniz. Huniye su dökün ve musluğu dikkatlice açarak yavaşça, damla damla karbüre ekleyeceğiz. Etinin patlayıcı doğası göz önüne alındığında, deneyi açık bir pencerenin yakınında veya çeker ocakta gerçekleştireceğiz. Hiçbir durumda etrafta açık alev bulunmamalı veya ısıtma cihazları açık olmamalıdır.
Etin saf haliyle hafif sarhoş edici bir kokuya sahip bir gazdır. Teknik karbürden elde edilen Etin, her zaman hoş olmayan kokulu, zehirli hidrojen fosfit (fosfin) ve arsenik hidrojen (arsin) yabancı maddeleri ile kirlenir. %3 ila %70 etin içeren etinin hava ile karışımları patlayıcıdır. Etin asetonda çok kolay çözünür. Böyle bir çözüm şeklinde çelik silindirlerde saklanabilir ve taşınabilir. Not. tercüme).
Etin, diğerlerinin yanı sıra plastik, sentetik kauçuk, ilaç ve solvent üretiminde önemli hale gelen çok çeşitli bileşiklere dönüştürülebilir. Örneğin, etine hidrojen klorür eklendiğinde, vinil klorür (vinil klorür) oluşur - polivinil klorür (PVC) ve buna dayalı plastiklerin üretimi için başlangıç malzemesi. Daha sonra tanışacağımız Ethanal, etinden elde ediliyor ve ondan birçok başka ürün yapılıyor.
Doğu Almanya'nın en büyük üreticisi ve aynı zamanda etin tüketicisi Schkopau'daki sentetik bütadien kauçuk fabrikasıdır. Mail Bu dev işletmenin 400 ürününün %90'ı kısmen veya tamamen etinden elde ediliyor. Ayrıca Pisteritz'deki nitrojen tesisi ve Hirschfeld'deki elektrokimya tesisi tarafından büyük miktarlarda kalsiyum karbür üretilmektedir. 1936 yılında, şu anda Doğu Almanya'nın bulunduğu bölgede 206.000 ton karbür üretildi. 1946'da üretim 30.000 tona düştü, ancak 1951'de 678.000 tona çıktı ve 1955'te 800.000 tonu aştı.
Bu rakamlar kalsiyum karbür ve ilgili proseslerin büyük önemine tanıklık etmektedir.
Gelecekte, karbür kullanımına dayalı teknolojinin yerini, Doğu Almanya'da Schwedt ve Leuine-2'de kurulan daha karlı petrokimya endüstrisi giderek daha fazla alacak. Etin elde etmek için karbür yönteminin ana dezavantajı, olağanüstü derecede yüksek güç tüketimidir. Aslında Schkopau tesisinde yalnızca bir modern karbür fırını 35 ila 50 megavat gücü "tüketiyor". Ancak bu tür fırınların pilleri var! Doğu Almanya'da üretilen elektriğin %10'undan fazlası kalsiyum karbür üretimine harcanıyor.
800.000 BAĞLANTIDAN BAZILARI
Genç bir Alman kimyager olan profesör Friedrich Wöhler, 1828'de ilk kez inorganik başlangıç malzemelerinden sentez yoluyla organik bir bileşik - üre - elde etti. Geçen yüzyılın ortalarında İsveçli kimyager Jacob Berzelius 100'den fazla farklı organik bileşiği sentezledi. (Burada organik sentezin diğer kurucularından bahsetmemek mümkün değildir. 1842'de Rus kimyager N.N. Zinin, daha önce sadece bitki materyallerinden elde edilen anilini ilk kez sentezledi. 1845'te Alman kimyager Kolbe, asetik asidi sentezledi. 1854 Fransız Bertlozhirs, A. M. Butlerov - 1861'de şekerli bir madde. Bu bilim adamlarının hayatı ve çalışmaları hakkında ilginç bilgiler, özellikle K. Manolov'un "Büyük Kimyacılar" kitabının 1 ve 2. ciltlerinde yer almaktadır. Bulgarca (M., ed. "Mir", 1976), - Not. tercüme)
O zamandan bu yana, tüm ülkelerdeki binlerce kimyager, ısrarlı ve sıkı çalışmayla birçok yeni organik madde yarattı veya doğal kaynaklardan izole etti. Özelliklerini araştırdılar ve çalışmalarının sonuçlarını bilimsel dergilerde yayınladılar.
XX yüzyılın başlarında. Çoğu sentez yoluyla elde edilen yaklaşık 50.000 farklı organik bileşik halihazırda araştırılmıştır. 1930'a gelindiğinde sayıları 300.000'e ulaşmıştı ve şu anda saf formda elde edilen ve araştırılmayan organik bileşiklerin sayısı görünüşe göre 800.000'i çok aşıyor. Bununla birlikte, olasılıklar henüz tükenmekten çok uzak. Dünyanın her yerinde her gün daha fazla yeni madde bulunup keşfediliyor.
Çoğu organik bileşik pratik uygulama bulamadı. Birçoğu kişisel deneyimlerden yalnızca çok dar bir kimyager çevresi tarafından biliniyor. Buna rağmen harcanan emek hiçbir şekilde boşa gitmedi, çünkü bazı maddelerin değerli boyalar, ilaçlar veya yeni tür malzemeler olduğu ortaya çıktı. Onlarca yıldır bilinen ve bilimsel literatürde uzun süredir açıklanan bir maddenin aniden büyük bir pratik önem kazanması sıklıkla görülür. Örneğin bazı kompleks bileşiklerin zararlı böceklere karşı etkinliği yakın zamanda keşfedilmiştir. Şimdiye kadar sadece eski, tozlu bilimsel dergilerde adı geçen diğer bileşiklerin yakında boya, ilaç veya başka alanlarda kullanım alanı bulması muhtemeldir. Ulusal ekonomide olağanüstü bir önem kazanmaları bile mümkündür.
Artık endüstride özellikle önemli olan birkaç maddeyi bağımsız olarak elde edip inceleyeceğiz.
ŞARAP ALKOL VE YAKINLARI
Önce sistem! Organik kimya dünyasına girdiğinizde, öncelikle organik bileşiklerin sınıflarına ve organik kimya dilinin temellerine aşina olmazsanız hemen kaybolabilirsiniz. Aslında çoğu organik madde benzer yapıya ve benzer özelliklere sahip gruplara ayrılabilir. Latin ve Yunan köklerini kullanan ve ayrıca büyük ölçüde onlar tarafından icat edilen abracadabra'yı kullanan kimyacılar, uzmana belirli maddelerin hangi sınıfa atanması gerektiğini hemen söyleyen iyi düşünülmüş bir isim sistemi yarattılar. Bir sorun: Birçok bileşik için uluslararası terminolojinin birleşik kurallarına göre isimlerin yanı sıra, bu bileşiklerin kökenine, en dikkat çekici özelliklerine veya diğer faktörlere bağlı olarak kendi isimleri de hala kullanılmaktadır. Bu nedenle bu kitapta yer alan birçok bileşik için birden fazla isim vermek gerekecektir.
Doymuş ve doymamış hidrokarbonlara zaten aşinayız.Doymuş hidrokarbonlara alkanlar, çift bağa sahip doymamış hidrokarbonlara alkenler ve üçlü bağa sahip olanlara alkinler denir. Bu hidrokarbonların artan karbon atomu sayısına göre sıralandığında homolog seriler oluşturduğunu biliyoruz.
Hidrokarbonların yanı sıra oksijeni de içeren organik bileşikler de büyük önem taşımaktadır. Oksijen içeren organik bileşiklerin ilk üç serisini düşünün:
alkanoller(alkoller)
alkanali(aldehitler)
alkanoik asitler(eski adı - karboksilik asitler)
Metan türevleri aşağıdaki bileşiklerdir:
CH3-OH H-CHO H-COOH
metanol metanal metanoik asit
(metil alkol) (formaldehit, (formik asit)
formik aldehit)
Etan türevleri, bu üç bileşik sınıfının aşağıdaki temsilcileridir:
CH3-CH2-OH CH3 - CHO CH3 - COOH
etanol etanal etanoik asit
(etil alkol) (asetaldehit, (asetik asit)
asetaldehit)
Benzer şekilde, sonraki tüm hidrokarbonlar için ilgili veya oksijenli bileşikler bilinmektedir. Genel olarak herhangi bir hidrokarbonun türevleri aşağıdaki formüllere karşılık gelir:
R-OHR-CHO R-COOH
alkanol alkanal alkanoik asit
(alkol) (aldehit) (karboksilik asit)
Daha yüksek hidrokarbonlarda her izomerin farklı oksijen bileşikleri oluşturduğunu hesaba katarsak, bu üç sınıfın olası bileşiklerinin sayısı önemli ölçüde artacaktır.Dolayısıyla, farklı alkoller bütan ve izobütan - bütil ve izobütil'e karşılık gelir:
CH3-CH2-CH2-CH3CH3-CH2-CH2-OH
bütan bütanol-1
(bütil alkol)
CH3-CH(CH3)-CH3CH3-CH(CH3)-CH2-OH
2-metilpropan 2-metilpropanol-1
(izobütan) (izobütil alkol)
Ek olarak, karakteristik oksijen içeren grupların, örneğin alkol grubu OH'nin ya uç zincirlerle ya da ara karbon atomlarından biriyle ilişkilendirilebilmesi nedeniyle ek izomerler ortaya çıkar. Örnekler propil ve izopropil alkollerdir:
CH3-CH2-CH3CH3-CH2-CH2-OH CH3-CH(OH)-CH3,
propan propanol-1 propanol-2
(propil alkol) (izopropil alkol)
Bileşik sınıflarının karakteristik gruplarına denir fonksiyonel gruplar. Bu tür gruplar arasında örneğin alkanollerin hidroksil grubu OH ve karboksilik asitlerin karboksil grubu COOH yer alır. Daha sonra oksijen dışında elementler içeren fonksiyonel grupların bazı örnekleriyle tanışacağız. Fonksiyonel grupları değiştirmek ve bunları organik madde moleküllerine dahil etmek, kural olarak, organik sentezin ana görevidir.
Elbette bir molekülde ve aynı anda birden fazla aynı veya farklı grup bulunabilir. Bu madde serisinin birkaç temsilcisini - çeşitli işlevlere sahip bileşikleri - öğreneceğiz.
Ancak, yeterli teori! Son olarak deneylere geçelim - yukarıdaki oksijen içeren metan ve etan türevlerini elde edeceğiz, dönüşümlerini gerçekleştireceğiz ve özelliklerini inceleyeceğiz. Adlarını uzun zamandır bildiğimiz bu bileşikler kimya teknolojisi açısından büyük önem taşımaktadır. Endüstriyel üretim yöntemini doğrudan yeniden üretemeyecek olsak da, endüstriyel organik sentezin temellerini tanımamıza yardımcı olmalarına izin verin. Ayrıca bileşik sınıflarının en önemli özellikleri hakkında bize fikir verecektir.
Metanol Araştırması
Ahşabın kuru damıtılmasında zaten birkaç damla ham metanol (metil alkol) elde ettik. Şu anda metanolün büyük çoğunluğu su gazından sentez yoluyla elde edilmektedir:
CO + 2H2 = CH3OH
Su gazının bileşenleri metanol oluşturmak üzere birleşir. Ayrıca küçük miktarlarda yüksek alkoller de oluşur. Bu işlem 400°C sıcaklık ve 200 atm basınç gerektirir ve oksit katalizörlerin varlığında hızlandırılır.
Metanol, boyaların üretiminde bir çözücü ve bir ara madde olarak hizmet eder. Ancak ana tüketicisi, büyük miktarlarda metanal (formaldehit) gerektiren plastik endüstrisidir. Metanal, metanolün atmosferik oksijenle oksidasyonu sonucu elde edilir. Endüstride metanol buharı ve 400°C'deki hava karışımı, bakır veya gümüş katalizör üzerinden geçirilir.
Bu işlemi simüle etmek için, 0,5-1 mm çapında bir parça bakır teli spiral şeklinde bükelim ve onu Bunsen brülörünün alevinin ışıklı olmayan bölgesine getirmek için maşa kullanalım. Tel ısıtılır ve bir bakır oksit (II) tabakası ile kaplanır. Daha önce aldığımız metanolü (10 damla) oldukça geniş bir test tüpüne koyalım ve içine kırmızı-sıcak bir bakır spiral koyalım. Isıtma sonucunda metanol buharlaşır ve bir katalizörün (bakır) etkisi altında oksijenle birleşerek metanal oluşturur (bunu karakteristik keskin kokusundan tanırız). Bu durumda bakır telin yüzeyi eski haline getirilir. Reaksiyon ısının açığa çıkmasıyla gerçekleşir. Büyük miktarlarda metanol buharı ve hava ile bakır, reaksiyon tamamlanana kadar ısıtılır. Metanolün çok zehirli olduğunu unutmayın! Bu nedenle büyük miktarlarda bir deney yapmayacağız.
Küçük bir metanol yudumu bile tamamen görme kaybına ve bazen ölüme neden olabilir. Bu nedenle metanol her zaman, hiçbir durumda yanlışlıkla içilmeyecek şekilde saklanmalıdır. Bununla birlikte, yanma için kullanılan alkole, denatüre hale getirmek için metanol, diğer bileşiklerle birlikte kasıtlı olarak küçük miktarlarda eklenir. Bu nedenle denatüre alkol de zehirlidir!
Metanal ile deneyler
Aşağıdaki deneyleri ticari formalinle gerçekleştireceğiz. Formalin, sudaki %35-40'lık bir metanal (formaldehit) çözeltisidir. Genellikle hala az miktarda reaksiyona girmemiş toksik metanol içerir. Metanalın kendisi proteinlerin pıhtılaşmasına neden olur ve bu nedenle aynı zamanda bir zehirdir.
Birkaç basit deney yapalım. Bir test tüpünde veya küçük bir şişede birkaç mililitre formalini buharlaştıralım. Numunesini daha sonra başka bir test tüpünde ısıtacağımız beyaz, zor çözünen bir kütle elde edilecektir. Aynı zamanda buharlaşacak ve kokudan metanalin yeniden oluştuğu hissedilecektir. Saf haliyle metanal, normal basınçta ve -19 ° C'de sıvıya dönüşen bir gazdır. Zaten soğukta ve daha da büyük ölçüde hafif ısıtmayla veya asitlerin varlığında metanal polimerleşmeye başlar. Aynı zamanda birçok molekülü birbiriyle birleşerek uzun paraform zincirleri oluşturur:
CH2-O-CH2-O-CH2-O-CH2-O ...
Güçlü ısıtma, paraformun metanale ters dönüşümüne yol açar.
Polimerizasyon birçok alkanalın karakteristiğidir ve içlerinde doymamış bir bağın varlığını gösterir. Polimerizasyon reaksiyonları birçok plastiğin üretiminin temelini oluşturur. Metanal, giderek daha uzun zincirli moleküllerin oluşmasıyla çözelti içinde de yavaş yavaş polimerize olur. Bu tür polimerize edilmiş formalin, paraformun ısıtılması ve elde edilen metanal buharın su ile emilmesi yoluyla yeniden üretilebilir.
Metanal ve diğer alkanaller (aldehitler), Schiff reaktifi olarak adlandırılan, tanınmalarına hizmet edebilecek karakteristik bir renk reaksiyonu verir. Bir neşterin ucuna biraz fuksin boyası alıp birkaç mililitre ılık damıtılmış su içinde çözerek bir reaktif hazırlayın. Bu çözeltiye, rengi değişene kadar porsiyonlar halinde sulu bir sülfürik asit çözeltisi ekleyeceğiz. Bu şekilde elde edilen reaktifin birkaç mililitresini bir test tüpüne dökün, birkaç damla metanal solüsyonu ekleyin ve karıştırın. Yakında mor bir renk görünecektir. Giderek seyreltilen metanal çözeltileri ile bir dizi deney gerçekleştirdikten sonra, bu niteliksel reaksiyonun hassasiyetini doğrulayabiliriz.
Aşağıdaki stok çözeltilerin eşit miktarlarda karıştırılmasıyla hazırlanabilen bir test tüpüne birkaç mililitre Fehling reaktifi dökün:
Fehling stok çözeltisi #1: 100 ml damıtılmış su içinde 7 g bakır(II) sülfat
Fehling stok çözeltisi No. 2: 100 ml damıtılmış su içerisinde 37 g Rochelle tuzu ve 10 g sodyum hidroksit
Fehling reaktifinin kendisi oldukça kararsızdır ve stok çözeltiler saklanabilir. Bitmiş formda bu çözümler bazen eczanelerden satın alınabilir.
Şimdi bitmiş Fehling reaktifine yaklaşık 1 ml metanal solüsyonu ekleyin ve kaynatın. Bu durumda, test tüpünün duvarlarında güzel bir ayna kaplaması (bakır ayna) oluşturan elementel bakır açığa çıkar. Test tüpünü yalnızca krom karışımıyla önceden yağdan arındırmak gerekir. Diğer alkanaller tuğla kırmızısı bir bakır(I) oksit çökeltisi oluşturur.
Fehling reaktifi yerine gümüş tuzunun amonyak çözeltisi de kullanılabilir. Seyreltik (yaklaşık% 2) gümüş nitrat çözeltisine, başlangıçta çöken çökelti tekrar eriyene kadar yavaş yavaş seyreltik sulu amonyak çözeltisi ekleyeceğiz. Krom karışımıyla iyice yıkanmış ve birkaç kez damıtılmış su ile durulanmış bir test tüpüne, hazırlanan gümüş tuzu çözeltisinden 2 ml ve 5-8 ml metanal çözeltisi dökün ve bu karışımı tercihen bir su banyosunda dikkatlice ısıtın. Test tüpünün duvarlarında belirgin bir ayna oluşur ve çöken en küçük gümüş parçacıkları nedeniyle çözelti yoğun siyah bir renk alır.
Alkanaller (aldehitler) çok kolay oksitlenir, bunun sonucunda kural olarak alkanoik (karboksilik) asitler oluşur. Bu nedenle oksitleyici maddelerle ilgili olarak indirgeyici maddeler gibi davranırlar. Örneğin alkanaller iki değerlikli bakır tuzunu bakır(I) okside ve hatta elementel bakıra indirger. Gümüş tuzunun amonyak çözeltisini metalik gümüşün salınımıyla azaltırlar. Bu reaksiyonlar alkanaller ve üzüm şekeri gibi daha sonra tartışacağımız diğer indirgeyici maddeler için ortaktır.
Diğer oksitleyici ajanların etkisi altında alkanaller ayrıca alkanoik asitler ve hatta bazen karbondioksit ve su oluşturacak şekilde oksitlenir. Bir test tüpünde, birkaç mililitre metanal çözeltiye dikkatlice% 10'luk bir hidrojen peroksit (peroksit) çözeltisi ekleyin. Daha sonra karışımı ısıtıyoruz ve nemlendirilmiş mavi turnusol kağıdını çiftler halinde bir test tüpünün üzerinde tutuyoruz. Kızarıklığı test tüpünde metan (formik) asit oluştuğunu gösterir.
Metanik Asitin Keşfi
Metanoik (formik) asit en basit organik asittir. Teknolojide sodyum hidroksite basınç altında karbon monoksit eklenmesiyle elde edilir. Denkleme göre
NaOH + CO = HCOONa
bu durumda formik asidin sodyum tuzu oluşur - sodyum metanat veya sodyum format. Diğer bileşiklerin hazırlanmasında ara madde olarak görev yapar ve tekstil ve deri endüstrilerinde kullanılır. Metanoik asit güçlü bir dezenfektan ve koruyucu etkiye sahip olduğundan gıda ve silajın bozulmadan korunmasında kullanılır. Silolamada kullanılan bazı preparatlar esas olarak metanoik asit çözeltileridir.
Mağazadan satın alınan metanoik asit ile aşağıdaki deneyleri yapacağız. (Dikkat! Konsantre metanoik asit zehirlidir ve cildi aşındırır!)
Bir test tüpüne 5 ml seyreltik sülfürik asit dökün ve sıvının kuvvetli bir şekilde renklenmesini sağlayacak kadar bir potasyum permanganat çözeltisi ekleyin. Bundan sonra, yaklaşık %80'lik metanoik asitten 5 ml daha ekleyin. Isıtıldığında permanganatın manganez (II) sülfata indirgenmesi nedeniyle karışım renksiz hale gelir. Bu durumda metan asidi karbondioksit ve suya oksitlenir.
Sonraki test tüpü deneylerinde magnezyum, çinko, demir ve nikelin %60 metan asitte çözülüp çözülmediğini kontrol edeceğiz. Aktif metaller metan ve diğer organik asitlerle reaksiyona girerek tuzlar oluşturur ve hidrojen açığa çıkarır. Bu nedenle organik asitler tam olarak inorganik asitler gibi davranır, ancak kural olarak daha zayıftırlar.
Konsantre sülfürik asit ve bazı katalizörler metan asidi karbon monoksit CO ve suya ayrıştırır. İçine bir cam tüpün yerleştirildiği kauçuk bir tıpa ile kapatılmış bir test tüpünde 1 ml susuz metan asidi fazla miktarda konsantre sülfürik asit ile ısıtalım. Bu tüpten, ateşlendiğinde soluk mavi bir alevle yanan bir gaz çıkar. Bu zaten aşina olduğumuz zehirli karbon monoksittir (karbon monoksit). Tehlike nedeniyle deneyin çeker ocakta veya açık havada yapılması gerekir.
Sonuç olarak metanoik asit ve tuzlarının doğada sıklıkla bulunduğunu da belirtmek gerekir. İkinci adından da anlaşılacağı üzere (formik) bu asit, karıncaların zehirli salgılarının bir parçasıdır. Ayrıca arıların salgılarında, ısırgan otunda vb. bulunur.
Etanol ile deneyler
Böylece metanol, metanal ve metanoik asitle tanıştık. İki karbon atomu içeren bunlara benzer bileşikler teknolojide büyük önem taşımaktadır.
Genellikle basitçe alkol olarak adlandırılan etanol (etil alkol), alkollü fermantasyon adı verilen işlem sırasında oluşur. Malt varlığında nişastanın sakrifikasyonunun yanı sıra birçok şeker türü, mikroskobik olarak küçük maya mantarları tarafından alkol ve karbondioksite parçalanır. Meyve suyunun fermente edildiğini gören herkes, çıkış borusundan yoğun bir karbondioksit salınımı görmüştür. Ve ortaya çıkan şarabın alkol içerdiği gerçeği, bu şarabı içen kişinin davranışlarından da kolaylıkla anlaşılmaktadır.
Alkol fermantasyonu kendiliğinden meydana gelebildiğinden, seyreltilmiş alkol, insanlar tarafından eski çağlardan beri heyecan verici bir içecek olarak bilinmektedir. Sarhoşluğun feci sonuçlarından bahsetmeye gerek yok. Özellikle gençlerin alkollü içecek kullanımını tamamen bırakması gerekmektedir.
Şeker çözeltilerinin ve meyve sularının fermantasyonu sırasındaki alkol içeriği büyük ölçüde değişir. Ancak maya yüksek alkol konsantrasyonunda yaşayamayacağı için fermantasyonla %15'ten fazla alkol elde edilemez. Votka ve daha konsantre alkol, seyreltik çözeltilerden damıtma yoluyla elde edilir. Bu tür bir damıtma işlemine yalnızca devlet içki fabrikalarında yasal olarak izin verilir. Özel şahısların kimyasal deneyler için dahi olsa en küçük miktarda alkol alması kanunen kesinlikle yasaktır.
Gıda alkolü ve kozmetik amaçlı alkol sadece tahıldan üretilir (Patates nişastası da bu amaçla kullanılır.) Not. tercüme). Nişasta önce şekere dönüştürülür, daha sonra fermente edilerek alkole dönüştürülür. Sülfit likörünün fermantasyonu sonucu, yani kağıt hamuru ve kağıt üretimi atıklarından büyük miktarlarda endüstriyel alkol elde edilir. Organik sentezlerde vazgeçilmez bir çözücü ve başlangıç malzemesi olan endüstriyel alkolün giderek artan bir kısmı, günümüzde kalsiyum karbürden etilen ve etanal yoluyla sentetik olarak üretiliyor (Etanol elde etmenin en gelişmiş yolu, etenden (etilen) su ilave edilerek sentezlenmesidir. bir katalizörün varlığı. Not. tercüme).
Saf alkol, rektifiye alkol adı altında satışa sunuluyor. %4-6 oranında su içerir. Düzeltme pahalı olduğundan, bunu yalnızca birkaç deneyde kullanıyoruz. Bunun belirtilmediği durumlarda yakıt olarak kullanıldığını çok iyi bildiğimiz, çok daha ucuz olan denatüre alkolle yetineceğiz. Bu da %95 alkoldür ancak içime uygun olmaması için içine zehirli ve hoş olmayan tat veya koku veren maddeler (metanol, piridin, ftalik asit ester) eklenir.
Önümüzde hâlâ alkolle ilgili çok çeşitli deneylerimiz olduğundan şimdilik kendimizi yalnızca ikisiyle sınırlayacağız. İlk olarak, rektifiye edilmiş üründe suyun varlığını kolaylıkla kanıtlayabiliriz. Renksiz, susuz bir tuz oluşana kadar birkaç kristal bakır sülfatı bir potada ısıtıyoruz. Daha sonra elde edilen tuzun bir tutamını alkol numunesine ekleyin ve çalkalayın. Suyun varlığı çözeltinin mavi renginden anlaşılır. Mutlak alkol olarak da adlandırılan susuz alkol, ancak özel kurutucularla işlenerek elde edilebilir.
Denatüre alkol, ispirto lambaları ve turist sobaları için iyi bir yakıt görevi görür. Son zamanlarda roket yakıtı olarak bile kullanılmaya başlandı. Doğru, kamp alanlarında yavaş yavaş yerini küçük çelik silindirlerde teslim edilen propan alıyor.
Ayrıca "kuru alkol" olarak adlandırılan ürünü üretmeye yönelik birçok girişimde bulunulmaktadır. Çeşitli çeşitleri kural olarak hiç alkol içermez. Ayrıca yaklaşık 5 g sabun parçasını 20 ml denatüre alkol içinde karıştırarak çözerek alkolü yarı katı duruma dönüştürebiliriz. Parçalara ayrılabilen jelatinimsi bir kütle ortaya çıkıyor. Sıvı alkol gibi soluk mavi bir alevle yanar.
Etan elde etme
Etanolün oksidasyonu, etanal (asetik aldehit) ve ardından etanoik asit (asetik asit) üretir. Güçlü oksitleyici maddeler etanali hemen asetik asite dönüştürür. Bakterilerin etkisi altında havadaki oksijenin oksidasyonu da aynı sonuca yol açar. Alkolü biraz sulandırıp açık bir kapta bir süre beklettikten sonra turnusolün verdiği reaksiyonu kontrol edersek bunu kolayca doğrulayabiliriz. Sofra sirkesi elde etmek için, esas olarak alkolün veya düşük dereceli şarapların (şarap sirkesi) asetik fermantasyonu hala kullanılmaktadır. Bunu yapmak için, yoğun hava beslemeli bir alkol çözeltisi, kayın ağacından elde edilen talaşın içinden yavaşça geçirilir. %5 veya %10 sofra sirkesi veya %40 asetik asit içeren sözde sirke esansı satışa çıkıyor (SSCB'de dağıtım ağına sağlanan gıda sirkesi özünün konsantrasyonu %80, sofra sirkesinin konsantrasyonu ise %9'dur) %.- Not. tercüme). Çoğu deney için bize uygun olacaktır. Sadece bazı durumlarda zehirlerden biri olan susuz (buzlu) asetik asite ihtiyaç duyacaksınız. Bir eczaneden veya kimyasal malzeme mağazasından satın alabilirsiniz. Zaten 16,6 ° C'de buza benzer kristalimsi bir kütle halinde katılaşır. Sentetik olarak asetik asit etinden etanal yoluyla elde edilir.
Tekrar tekrar bahsedilen etanol veya asetaldehit, kalsiyum karbür kullanımına dayanan kimyasal teknolojideki en önemli ara üründür. Sentetik kauçuğun başlangıç malzemesi olan asetik asit, alkol veya bütadiene dönüştürülebilir. Etanal ticari olarak etine su eklenerek üretilir. Doğu Almanya'daki Schkopau'daki sentetik bütadien kauçuk tesisinde bu işlem güçlü sürekli reaktörlerde gerçekleştiriliyor. Sürecin özü, etinin, katalizörlerin - cıva tuzları ve diğer maddelerin - çözüldüğü ısıtılmış seyreltik sülfürik asit içine sokulması gerçeğinde yatmaktadır (Bu reaksiyon, 1881'de Rus bilim adamı M. G. Kucherov tarafından keşfedilmiştir - Not. tercüme). Cıva tuzları oldukça zehirli olduğundan etinden kendimiz etan sentezlemeyeceğiz. Daha basit bir yöntem seçelim - etanolün dikkatli oksidasyonu.
Bir test tüpüne 2 ml alkol (denatüre alkol) dökün ve 5 ml %20 sülfürik asit ve 3 g ince öğütülmüş potasyum dikromat ekleyin. Daha sonra test tüpünü, içine kavisli bir cam tüpün yerleştirildiği lastik bir tıpa ile hızlı bir şekilde kapatın. Karışımı küçük bir alevle kaynatıncaya kadar ısıtıyoruz ve bu sırada açığa çıkan buharları buzlu sudan geçiriyoruz. Ortaya çıkan etanal suda çözünür ve kullanılarak tespit edilebilir.  alkanalların belirlenmesi için yukarıda açıklanan reaksiyonların kullanılması. Ayrıca çözelti asidiktir çünkü oksidasyon kolaylıkla asetik asit oluşturacak şekilde ilerler.
alkanalların belirlenmesi için yukarıda açıklanan reaksiyonların kullanılması. Ayrıca çözelti asidiktir çünkü oksidasyon kolaylıkla asetik asit oluşturacak şekilde ilerler.
Büyük miktarlarda ve daha saf etanol elde etmek için, şeklin rehberliğinde daha karmaşık bir kurulum gerçekleştireceğiz. Ancak bu deney yalnızca bir daire içinde veya okuyucunun çok fazla deneyimi varsa yapılabilir. Etanal zehirli ve çok uçucudur!
Tesisatın sol tarafı karbondioksit (karbondioksit) akımını geçirecek şekilde tasarlanmıştır. İkincisi, serbest kalan etanali, asetik asite daha fazla oksitlenmeden önce reaksiyon küresinden çıkarmak için gereklidir. Mermer parçalarını bir şişeye koyalım ve üzerlerine küçük porsiyonlar halinde seyreltik hidroklorik asit ekleyelim. Bunu yapmak için, uzun çıkış borulu (en az 25 cm) bir düşürme hunisine ihtiyacınız vardır. Böyle bir tüpü, lastik bir hortum kullanarak geleneksel bir düşürme hunisine sıkıca bağlayabilirsiniz. Karbondioksitin tesisatın bir sonraki kısmının aşırı direncini yenebilmesi ve ters yönde çıkmaması için bu tüpün her zaman asitle doldurulması gerekir.Bir adet kısa cam tüp.Aynı tüpü, tüpü kapatan tıpaya yerleştirin. huniyi düşürün ve her iki boruyu da lastik hortumla bağlayın.Kipp aparatını kullanmak daha da uygundur. Not. tercüme).
Gaz verme cihazındaki basıncın nasıl eşitleneceğini öğrenmek için 45. sayfadaki çizime bakın.
Reaktör görevi gören başka bir kaba (250 ml'lik yuvarlak dipli bir şişe) ilk önce 20 ml denatüre alkol dökün. Daha sonra 40 g ince öğütülmüş potasyum veya sodyum bikromat'ı (Zehir!) 100 ml seyreltik sülfürik asitte çözüyoruz (80 ml suya 20 ml konsantre sülfürik asit ekleyin.) Sülfürik asidin daha yüksek yoğunluğu nedeniyle zorunludur. suya eklemek için, tersi değil. Sülfürik asit her zaman kademeli olarak ve yalnızca gözlük kullanılarak eklenir. Sülfürik asit içerisine asla su dökmeyin!
Hazırlanan çözeltinin üçte birini hemen reaktöre, geri kalanını da reaktöre bağlı bir damlatma hunisine koyuyoruz. Karbondioksit salınımı için onu cihaza bağlayan tüpün çıkışını reaktörün içine yerleştirelim. Bu tüp sıvıya batırılmalıdır.
Son olarak soğutma sistemi özel ilgiyi hak ediyor. Reaktörden belli bir açıyla yukarı çıkan tüpte alkol ve asetik asit buharlarının yoğunlaşması gerekir. Bu tüpü soğutmanın en iyi yolu, içinden su akan harici bir kurşun serpantin kullanmaktır. Aşırı durumlarda soğutmadan da yapabilirsiniz, ancak daha sonra daha kirli bir ürün elde ederiz. Zaten 20,2 °C'de kaynayan etanolü yoğunlaştırmak için doğrudan yoğunlaştırıcı kullanıyoruz. Elbette verimli bir buzdolabı - bobin, top veya dahili soğutmalı - almak arzu edilir. Aşırı durumlarda, çok kısa olmayan bir Liebig buzdolabı da uygundur. Her durumda soğutma suyunun çok soğuk olması gerekir. Musluk suyu buna yalnızca kışın uygundur. Yılın diğer zamanlarında yeterli yüksekliğe kurulan büyük bir tanktan buzlu su geçirilebilir. Alıcıları (birbirine bağlı iki test tüpü) eşit (ağırlıkça) miktarda kırılmış buz veya kar ve sofra tuzundan oluşan bir soğutma karışımına batırarak soğutuyoruz. Tüm bu önlemlere rağmen etanal buharı kısmen dışarı çıkmaktadır. Etanalin hoş olmayan keskin bir kokusu olduğundan ve zehirli olduğundan, deney çeker ocakta veya açık havada yapılmalıdır.
Ancak şimdi, kurulum şarj edilip monte edildiğinde deneye başlayalım. Öncelikle mermere az miktarda hidroklorik asit ekleyerek cihazın gaz çıkışı açısından çalışmasını kontrol edeceğiz. Bu durumda tesisat hemen karbondioksitle doldurulur. Kesinlikle reaktörden geçerse ve herhangi bir sızıntı tespit edilmezse, fiili etanal üretimine geçeceğiz, gaz çıkışını durduracağız, tüm soğutma sistemini açacağız ve reaktörün içeriğini kaynatıncaya kadar ısıtacağız. Artık alkol oksitlendiğinde ısı açığa çıktığı için brülör çıkarılabilir. Bundan sonra, yavaş yavaş hidroklorik asit ekleyeceğiz, böylece reaksiyon karışımından her zaman ılımlı bir karbondioksit akımı geçecektir. Aynı zamanda, kalan dikromat çözeltisi, damlatma hunisinden reaktöre yavaşça akmalıdır.
Reaksiyonun sonunda, iki alıcının her biri birkaç mililitre neredeyse saf etanol içerir. Test tüplerinin ağzını pamukla kapatıp bir sonraki deneyler için soğukta saklıyoruz. Etanalin uzun süreli depolanması pratik değildir ve tehlikelidir, çünkü çok kolay buharlaşır ve toprak durduruculu bir şişede olması, tıpayı kuvvetle kırabilir. Ethanal yalnızca kapalı, kalın duvarlı cam ampullerde satışa sunuluyor.
Etan ile deneyler
Yukarıda açıklanan niteliksel reaksiyonlara ek olarak, küçük miktarlarda etanol ile bir dizi başka deney de yapabiliriz.
Bir test tüpünde, 1-2 ml etanole, bir cam çubukla dikkatlice (gözlüklerle ve kendinizden uzakta) 1 damla konsantre sülfürik asit ekleyin. Şiddetli bir tepki başlıyor. Düşer çökmez reaksiyon karışımını suyla seyreltin ve test tüpünü çalkalayın. Etanolün aksine suyla karışmayan ve yalnızca 124 °C'de kaynayan bir sıvı açığa çıkar. Üç etanal molekülünün bir halka oluşturacak şekilde birleştirilmesiyle elde edilir:
e  Bu etanal polimerine paraldehit denir. Seyreltik asitlerle damıtıldığında tekrar etanale dönüşür. Paraldehit tıpta uyku hapı olarak kullanılır.
Bu etanal polimerine paraldehit denir. Seyreltik asitlerle damıtıldığında tekrar etanale dönüşür. Paraldehit tıpta uyku hapı olarak kullanılır.
Bir sonraki deneyde az miktarda etanalı konsantre sodyum hidroksit çözeltisiyle dikkatlice ısıtıyoruz. Sarı bir "aldehit reçinesi" açığa çıkar. Ayrıca etanal moleküllerin birbirine bağlanması nedeniyle de ortaya çıkar. Bununla birlikte, paraldehitin aksine, bu reçinenin molekülleri çok sayıda etanal molekülden yapılmıştır.
Başka bir katı polimerizasyon ürünü olan metaldehit, etanalin soğukta gaz halindeki hidrojen klorür ile işlenmesiyle oluşturulur. Katı yakıt ("kuru alkol") olarak bir miktar kullanım alanı bulurdu.
Yaklaşık 0,5 ml etanol, 2 ml su ile seyreltilir. 1 ml seyreltilmiş sodyum hidroksit veya soda çözeltisi ekleyin ve birkaç dakika ısıtın. Krotonaldehitin olağanüstü keskin kokusunu duyacağız. (Denemeyi çeker ocakta veya açık havada gerçekleştirin!).
Etanalden iki molekülünün birbirine eklenmesi sonucu ilk olarak bütadien üretiminde de ara ürün olan aldol oluşur. Hem alkanal hem de alkanol fonksiyonel gruplarını içerir.
Suyun ayrılmasıyla aldol, krotonaldehit'e dönüştürülür:

EV VE CİHAZLARDAKİ ÇÖZÜCÜLER
Günümüzde organik çözücüler her evde bulunabilmektedir. Giysilerdeki yağ veya katran lekelerini çıkarmak için leke çıkarıcıyı kim kullanmadı? Tüm vernikler, kauçuk gibi birçok yapıştırıcı da çeşitli organik çözücüler içerir. Biraz tecrübeyle, bu karışımlarda hangi maddenin çözücü görevi gördüğünü kokudan anlayabilirsiniz.
Hemen hemen her endüstride organik solventlere ihtiyaç vardır. Katı ve sıvı yağlar bitkilerden solventlerle ekstrakte edilir. Plastik, tekstil ve boya endüstrileri büyük miktarlarda solvent tüketmektedir. İlaç ve kozmetik üretiminde, ekonominin diğer birçok sektöründe de durum aynı.
Benzin ve alkol gibi ana çözücülerden bazılarıyla muhtemelen pek çok kişi karşılaşmıştır. Bir çözücüyü değerlendirirken birçok faktör devreye girer. Her şeyden önce elbette içinde hangi maddelerin iyi çözündüğü önemlidir. Bu nedenle, birçok reçine, ilaç ve kozmetik alkolde mükemmel şekilde çözünürken, yağlar ve parafin içinde çok az çözünür. Ayrıca solventleri karşılaştırırken bunların yanıcılığı, kaynama noktası, toksisitesi ve en önemlisi maliyeti önemli bir rol oynar.
Aşağıdaki deneyleri özellikle sıklıkla çözücü olarak kullanılan çeşitli bileşiklerle gerçekleştireceğiz.
Karbon tetraklorür - yanıcı olmayan solvent
Metandaki dört hidrojen atomunun tamamı klor ile değiştirilirse karbon tetraklorür (karbon tetraklorür) elde edilir. Karbon tetraklorür 76°C'de kaynayan ve yoğunluğu 1.593 g/cm3 olan bir sıvıdır. Bu nedenle sudan çok daha ağırdır ve suya pek karışmaz. Tetraklorometan reçineleri, yağları vb. mükemmel şekilde çözer ve diğer çözücülere göre büyük bir avantaja sahiptir: yanmaz. Aykırı! Ağır buharları alevleri bastırır, bu nedenle yangın söndürücülerde kullanılır.
Bir bardağa biraz benzin, alkol veya aseton dökün ve bu yanıcı sıvıyı açık havada dikkatlice ateşe verin. Şimdi birkaç mililitre karbon tetraklorür eklersek yangın sönecektir. Tetraklorometanla söndürmenin çok zehirli bir gaz olan fosgen COCl2 üretebileceğine dikkat edilmelidir. Bu nedenle kapalı alanlarda bu yangın söndürme maddesi ancak uygun önlemler alınarak kullanılabilir. Son zamanlarda karbon tetraklorür yüklü yangın söndürücüler kullanılmaz hale geldi. Bunun yerine, yangın söndürücüler artık hidrokarbonların karışık brom-klor veya flor-klor türevlerini kullanıyor.
Bir sonraki deneyde 2 ml karbon tetraklorürü 1,5 g çinko tozuyla karıştırıyoruz. İkincisi, çinko buharının yoğunlaştırılmasıyla elde edilen çok ince bir tozdur. Orta viskoziteli bir macun elde etmek için karışıma daha fazla yanmış magnezya veya çinko oksit ekleyin. Bir parça demir üzerine veya demir bir potaya yerleştirip açık havada çıplak ateşte 200 ° C'ye ısıtıyoruz. Bu durumda şiddetli bir reaksiyon başlar ve karışımın sıcaklığının 1000 °C'nin üzerine çıkmasına neden olur. Aynı zamanda yoğun bir duman yayılıyor. Karbon tetraklorür ve çinko reaksiyona girerek çinko klorür oluşturur:
2Zn + CCl4 = 2ZnCl2 + C
Çinko klorür yüksek sıcaklıkta buharlaşır ve bir sis oluşturarak havadaki suyu çeker.
Diğer metaller, özellikle demir de karbon tetraklorür ile yavaş reaksiyona girer. Bu nedenle korozyona katkıda bulunur ve metal vernikleri ve benzeri amaçlar için solvent olarak uygun değildir.
Karbon tetraklorür oldukça zehirlidir. Buharlarının küçük dozlarda solunması narkotik etkiye sahiptir ve büyük dozlarda veya sözde kronik zehirlenme ile ciddi karaciğer hasarına yol açar. Bu nedenle karbon tetraklorür ile çalışırken dikkatli olunmalıdır! Güvenilir havalandırma, havada karbon tetraklorür buharlarının birikmesini önleyecektir.
Propanon yağı çözer
Çözücü grubunun bir sonraki önemli temsilcisi propanondur (aseton).
Ahşabın kuru damıtılması sırasında asetik asidin kalsiyum tuzunu - "gri ahşap asetik tozu" elde ettik. Bu deneyi yapmamış olan herkes, seyreltik bir asetik asit (sofra sirkesi) çözeltisini kalsiyum karbonat veya kalsiyum hidroksit ile nötrleştirerek belirtilen tuzu kolaylıkla hazırlayabilir.
Aseton elde etmek için, refrakter camdan yapılmış bir test tüpüne birkaç gram ahşap asetik tozu koyun. Test tüpünü, kavisli bir cam tüpün yerleştirildiği deliğe lastik bir tıpa ile kapatıyoruz. Bu tüpü kurşun bobinle soğutun. Alıcı, buzlu suya batırılmış bir test tüpü olabilir. Ürünün yanıcı özelliğinden dolayı alev ile alıcı arasındaki mesafenin mümkün olduğu kadar büyük olması için çıkış borusu çok kısa olmamalıdır. Ayrıca deneyin yalnızca çeker ocakta veya açık havada yapılabileceğini dikkate alıyoruz.
Toz içeren test tüpünü Bunsen bekiyle kuvvetlice ısıtıyoruz. Buharlar açığa çıkar ve alıcıda, ilk tuzun saflık derecesine bağlı olarak sarıdan kahverengimsi bir renge sahip olan hareketli bir sıvı yoğunlaşır. Esas olarak yağ çözücü olarak kullanılan asetondan oluşur:

Bu solventin mükemmel özellikleri, az miktarda gres, balmumu, vernik ve diğer organik maddelerin çözülmesiyle kolayca doğrulanabilir. Birçok plastik aynı zamanda asetonda da çözünür veya en azından içinde şişer. Bir parça selüloit, polistiren veya başka bir plastik üzerinde deneyin. Söylemeye gerek yok - mükemmel bir çözücü, ayrıca karbon tetraklorürün aksine korozyona neden olmaz. Ancak çok yanıcıdır. Bundan emin olmak için, bir bardağa biraz dökün ve ateşin kaynağına dikkatlice yaklaşarak ateşe verin.
Saf halinde aseton (propanon), halihazırda 56,2 ° C'de kaynayan ve hoş olmayan tuhaf bir kokuya sahip, renksiz bir sıvıdır. Geçmişte esas olarak gri odun asetik tozunun kuru damıtılmasıyla elde ediliyordu, ancak günümüzde asetik asitin buharının bir katalizör üzerinden geçirilmesi, izopropil alkolün oksidasyonu ve nişastanın bir katalizör altında fermantasyonu dahil olmak üzere çeşitli yöntemlerle üretilmektedir. Uygun bakterilerin etkisi. Son yıllarda aseton, fenol ile eş zamanlı olarak, petrokimyasal üretim gazlarından kümen oluşumu aşaması yoluyla dolambaçlı bir şekilde elde ediliyor.
Kimyasal yapısına göre aseton, alkanaller (aldehitler) ile ilgili alkanonların (ketonlar) en basit temsilcisidir. Metanal veya etanal gibi alkanaller molekülün sonunda bir C=O grubu içerirken, alkanonlarda bu grup zincirin en uç karbon atomunda değil "iç" kısmında bulunur. Alkanonlar, alkanallara göre daha az doymamışlık gösterirler ve bu nedenle alkanalların niteliksel reaksiyonları tarafından tespit edilmezler. (Kontrol etmek!)
Ve son olarak eter
Sonuç olarak, tıpta anestezi amaçlı kullanımının yanı sıra yağlar ve diğer birçok madde için mükemmel bir çözücü olan eteri ele alalım.
Aslına bakılırsa, farklı eterler alkanaller veya alkanonlar gibi benzer özelliklere sahip bir bileşik sınıfı oluştururlar. Sıradan eter kesinlikle dietil eter olarak adlandırılmalıdır. Suyun genellikle konsantre sülfürik asitle bölünmesiyle iki molekül etanolden oluşur:
Az miktarda eter alıyoruz. Bunu yapmak için bir test tüpüne yaklaşık 2 ml denatüre alkol ve 1,5 ml konsantre sülfürik asit dökün. Test tüpüne iki delikli bir tıpa seçiyoruz. Bunlardan birine küçük bir düşürme hunisi veya sadece uzun bir boruya sahip küçük bir huni yerleştiriyoruz, çıkışı ilk önce bir parça lastik hortum ve bir kelepçe ile kapatıyoruz. Tıpadaki ikinci deliği kullanarak, etanal elde etme durumunda olduğu gibi, test tüpüne buhar soğutması için bir cihaz takıyoruz. Alıcının kesinlikle buzlu suyla soğutulması gerekiyor çünkü eter zaten 34,6 ° C'de kaynıyor! Alışılmadık derecede yüksek yanıcılık özelliği nedeniyle, yangın kaynağı ile alıcı arasında yeterli mesafe olacak şekilde buzdolabının mümkün olduğu kadar uzun (en az 80 cm) olması gerekir. Aynı sebepten dolayı deneyi yanıcı nesnelerden uzakta, açık havada veya çeker ocakta gerçekleştireceğiz. Huniye 5 ml daha denatüre alkol dökün ve test tüpünü bir Bunsen brülörlü bir asbest ızgarası üzerinde yaklaşık 140 ° C'ye kadar dikkatlice ısıtın (Sıcaklık 145 0 C'yi geçmemelidir, çünkü daha yüksek bir sıcaklıkta (yaklaşık 170 0 C) Eten oluşur.Eter az miktarda olsa bile her zaman yangın riski göz önünde bulundurulmalıdır.Bu nedenle brülörü kapalı bir elektrikli soba ile değiştirmenizi ve ısı kaynağı ile alıcı arasına koruyucu bir ekran takmanızı öneririz. .Düşürme hunisi kullanırken, musluğu dikkatlice yağlayın ve kontrol edin. Alıcı olarak, yan çıkışı buzdolabına sıkıca tutturulmuş bir test tüpü kullanmak en iyisidir; üzerine çıkanlar arasındaki mesafeyi artırmak için üzerine lastik bir hortum koyabilirsiniz. eter buharı ve ısı kaynağı.Alıcıyı buz ve tuz karışımıyla soğutmak daha iyidir - Not. tercüme). Alıcıda çok uçucu bir damıtık yoğunlaşır ve yetersiz soğutma durumunda eterin karakteristik kokusunu hissederiz. Kelepçeyi dikkatlice açarak yavaş yavaş küçük porsiyonlar halinde alkol ekleyeceğiz. Reaksiyonun sonunda, sülfürik asit, ortaya çıkan su ile giderek daha fazla seyreltilir, bunun sonucunda eter oluşumu durur ve alkol damıtılır.
Deneyin dikkatli bir şekilde yürütülmesiyle, esas olarak eterden oluşan yaklaşık 4 ml çok hareketli, şeffaf bir sıvı elde edeceğiz. Parmağınıza birkaç damla damlatırsanız şiddetli bir soğukluk hissedeceksiniz. Gerçek şu ki, eter hızla buharlaşıyor ve buharlaşma ısısı çevresinden uzaklaştırılıyor.
Kimya işletmelerinde ve hastanelerde eterle çalışırken çok güçlü patlamalar meydana geldi. Atmosferdeki oksijenle uzun süreli temas ve güneş ışığının etkisi altında eterde kolayca patlayan peroksitler oluşur. Bu nedenle hiçbir durumda daha fazla eter depolamayacağız. Bu kitapta önerilen deneylerin hiçbirinde buna ihtiyacımız olmayacak. Kolodiyon için çözücü olarak yalnızca iki kısım alkol içeren bir karışımda etere ihtiyacımız olacak. Bu nedenle eterin geri kalanını hemen iki kat alkolle seyreltip, güvenli bir şekilde kapatılmış koyu kahverengi cam şişede yalnızca bu güvenli karışım halinde saklıyoruz.
İlk kez 1846 yılında Jackson ve Morton tarafından anestezi amacıyla kullanılan eter buharının uzun süre solunması bilinç kaybına yol açmaktadır (Bu amaçla, eter ilk kez 1842 yılında Long (ABD) tarafından bir cerrahi operasyon sırasında kullanılmıştır ancak bu deney yayınlanmamıştır. - Not. tercüme). Tamamen saflaştırılmış eter hala bu amaç için kullanılmaktadır. Bununla birlikte, bu kitabın okuyucularının güvenilir oldukları ve anestezi ile ilgili olarak kendilerine ait tehlikeli, sorumsuz ve kategorik olarak kabul edilemez deneyler yapmayacakları umulabilir.
Çözücülerle ilgili bu bölümü bitirirken, kitabın ilerleyen bölümlerinde vernikleri ve plastiği mükemmel şekilde çözen benzen ve esterler gibi diğer önemli çözücüler hakkında bilgi sahibi olacağımızı vurgulamak gerekir.
Benzen türevleri
Şu ana kadar ele aldığımız organik bileşiklerin karbon iskeleti düz veya dallanmış zincirlerden oluşmuştur. Alman kimyager August Kekule, diğer birçok organik bileşiğin moleküllerinin bir halka gibi inşa edildiğini ilk kez keşfetti. En önemli halka (siklik karbon bileşiği) - benzen - elde edildiği kömür katranında %1-2 oranında bulunur.
Benzen, 80,2°C'de kaynayan ve 5,5°C'de katılaşan, renksiz bir sıvıdır. Reaktiflerini ısıtılmayan bir odada saklayan biri için benzenin dondurulması, su donmaya başladığında kırılmamaları için sulu çözelti şişeleri için daha sıcak bir yer bulma zamanının geldiğinin bir işaretidir.
Benzen son derece yanıcıdır! Bir saat camına birkaç damla damlatalım ve dikkatlice yanan bir kibrit getirelim. Alev sıvıyla temas etmeden önce benzen tutuşacaktır. Dumanlı bir alevle yanıyor, bu da yüksek karbon içeriğine işaret ediyor. Benzenin brüt formülü C6H6'dır. Dolayısıyla karbon ve hidrojen oranı etin oranıyla aynıdır. Aslında benzen, üç etin molekülünün kırmızı-sıcak bir demir veya kuvars tüpten geçirilmesiyle oluşur. Ancak tüpe hava girdiğinde oluşacak patlama tehlikesi nedeniyle bu reaksiyonu hiçbir durumda kendi başımıza gerçekleştirmeyeceğiz.
Benzen ve etin bileşimlerindeki benzerliğe rağmen kimyasal özellikleri tamamen farklıdır. Bromlu su veya Bayer reaktifini kullanarak benzenin doymamış bileşiklere özgü reaksiyonlara girmediğini kolayca kanıtlayabiliriz. Bunun özel yapısından kaynaklandığı açıktır. Kekule, altı üyeli bir halkada üç çift bağ içeren benzen için bir formül önerdi. Ancak yeni fikirler doğrultusunda benzenin kararlı yapısı, ortada verilen formülde gösterildiği gibi "fazla" değerlik elektronlarının halkanın tamamına ait olup tek bir "elektron bulutu" oluşturmasıyla daha iyi açıklanmaktadır. ":

Şu anda birkaç yüz bini bilinen benzen türevleri, halkaya fonksiyonel grupların eklenmesinin yanı sıra benzen halkasına ek halkalar veya karbon yan zincirleri eklenerek oluşturulur. Aşağıdaki deneylerde benzenin teknolojideki en basit ve aynı zamanda en önemli türevlerinden bazılarını elde edip inceleyeceğiz.
Benzenden nitrobenzen
Bunun çok zor olduğu açık zincirli hidrokarbonlardan farklı olarak aromatik hidrokarbonlar NO 2 nitro grubu kolaylıkla tanıtılabilir.
Nitrobenzen elde etmek için öncelikle 15 ml benzene, 20 ml konsantreye ihtiyacımız var.  sülfürik asit ve 15 ml konsantre nitrik asit ve deneyin sonunda - su ve seyreltik sodyum hidroksit. Benzen oldukça zehirlidir; hiçbir durumda buharını solumamalısınız.
sülfürik asit ve 15 ml konsantre nitrik asit ve deneyin sonunda - su ve seyreltik sodyum hidroksit. Benzen oldukça zehirlidir; hiçbir durumda buharını solumamalısınız.
Öncelikle gerekli tüm ekipmanları hazırlayacağız. Yaklaşık 50 cm uzunluğunda çok ince olmayan bir cam tüpün yerleştirildiği deliğe lastik tıpalı 125 ml'lik bir Erlenmeyer şişesi seçeceğiz.Ayrıca bir ayırma hunisine (150 ml kapasiteli), bir su banyosuna da ihtiyacımız olacak. ve 100 ° C'ye kadar ölçeğe sahip bir termometre. Biri buzlu suyla, diğeri 60 ° C'ye ısıtılmış suyla olmak üzere iki tava daha hazırlayalım.
Gözlere sıçrama riski nedeniyle, bu deney (konsantre asitlerle çalışırken her zaman olduğu gibi) yalnızca koruyucu gözlüklerle yapılabilir!
Erlenmeyer şişesine önce konsantre sülfürik asit koyuyoruz ve ardından çok dikkatli bir şekilde, şişeyi hafifçe sallayarak küçük porsiyonlar halinde nitrik asit ekliyoruz. Isıtılmış nitratlama karışımını, şişeyi soğuk suya batırarak soğutun. Daha sonra şişeye bir termometre yerleştiriyoruz ve şişedeki sıvıyı bir cam çubukla sürekli karıştırarak yavaş yavaş benzen eklemeye başlıyoruz. Sıcaklık 50-60°C'yi geçmemelidir. Daha da yükselirse, benzenin bir sonraki kısmını eklemeden önce şişeyi buzlu suda tutmak gerekir. Tüm benzen eklendiğinde, dikey olarak yerleştirilmiş bir tüp içeren şişeyi, sıcaklığını 50 ila 60 ° C arasında tutacağımız ılık su banyosunda bir süre daha tutacağız ve gerekirse daha fazla sıcak su ekleyeceğiz.
Daha sonra şişenin içeriğini bir ayırma hunisine aktarın. İki katman bulacağız: üst katman nitrobenzen içerir ve alt katman aşırı nitratlama karışımı içerir. Bu asit karışımını tuzlayın, ayırma hunisine yaklaşık 30 ml su ekleyin, kuvvetlice çalkalayın ve artık yüksek yoğunluğu nedeniyle zaten alt tabakayı oluşturan nitrobenzeni ayırın. Daha fazla temizlik için, aynı şekilde yüksek oranda seyreltilmiş kostik soda çözeltisiyle ve son olarak tekrar suyla yıkanmalıdır.
Nitrobenzen, kaynama noktası 210°C ve yoğunluğu 20°C'de 1.203 g/cm3 olan soluk sarı bir sıvıdır. Deney sırasında sıcaklığın aşırı artmasına izin verirsek nitrobenzen, dinitrobenzen karışımından dolayı daha güçlü renklenecektir. Nitrobenzen çok zehirlidir (Nitrobenzen cilde temas ederse, etkilenen bölge alkolle, ardından ılık su ve sabunla yıkanmalıdır. – Not. tercüme). Ayrıca acı bademin karakteristik güçlü kokusuyla zararlı buharlarını solumaktan da kaçınılmalıdır. Parfümeride böyle bir aromaya ihtiyaç duyulmasına rağmen nitrobenzenin bunun için kullanılması toksisitesi nedeniyle kesinlikle yasaktır. Genellikle aynı kokuya sahip güvenli benzaldehit aynı amaçla kullanılır.
Anilin - boyaların atası
H  İtrobenzen bizim için kimya endüstrisi için olduğu gibi sadece bir ara üründür. Sentetik boyaların atası olan anilin'i geri yükleyerek de ilerleyeceğiz ve bundan kurtulacağız (Bu reaksiyona Zinin reaksiyonu denir. Rus kimyager N.N. Zinin, ilk olarak 1842'de amonyum sülfürün etkisi altında nitrobenzenin anilin'e indirgenmesini gerçekleştirdi. - Not. tercüme).
İtrobenzen bizim için kimya endüstrisi için olduğu gibi sadece bir ara üründür. Sentetik boyaların atası olan anilin'i geri yükleyerek de ilerleyeceğiz ve bundan kurtulacağız (Bu reaksiyona Zinin reaksiyonu denir. Rus kimyager N.N. Zinin, ilk olarak 1842'de amonyum sülfürün etkisi altında nitrobenzenin anilin'e indirgenmesini gerçekleştirdi. - Not. tercüme).
NH2 amino grubunu elde etmek için nitro grubundaki oksijeni hidrojenle değiştirmeliyiz. Endüstride, nitrobenzen şu anda genellikle gaz fazında, buharının hidrojen ile bir karışım halinde bir bakır katalizör üzerinden geçirilmesiyle indirgenmektedir. Küçük miktarlarla çalışırken, indirgemenin izolasyon sırasında hidrojen ile sıvı fazda gerçekleştirildiği eski yöntemi tercih edeceğiz - Latince'de bu in statu nascendi'dir. Bunu yapmak için, hidroklorik asidin demir talaşları veya daha iyisi granül çinko veya kalay üzerindeki etkisiyle hidrojen elde ederiz.
Deneyi aşağıdaki şekilde gerçekleştirelim. Bir Erlenmeyer şişesine - nitrobenzenin hazırlanmasında olduğu gibi - 10 g nitrobenzen ve 15 g demir talaşı veya granül çinko koyun. İlk olarak, 5 ml konsantre hidroklorik asit ekleyin ve içine bir cam tüpün dikey olarak yerleştirildiği bir tıpa ile şişeyi hemen kapatın. Hafifçe sallamayla şiddetli bir reaksiyon başlayacaktır. Bu durumda, şişe ısıtılır ve reaksiyonun hala tamamen durmaması için orta derecede soğuk suyla soğutulması gerekir. Zaman zaman mantarı bir tüple çıkarıp 5-8 ml hidroklorik asit daha ekleyeceğiz. Sadece 50 ml hidroklorik asit eklediğimizde, reaksiyon azalana kadar bekleyeceğiz ve çeker ocakta veya açık havada aynı cam tüple şişeyi bir su banyosunda 30 dakikadan bir saate kadar ısıtacağız.
Son olarak reaksiyon karışımını suyla seyreltiyoruz ve asidi nötralize etmek için alkali reaksiyona bir soda külü veya içme sodası (sodyum bikarbonat) çözeltisi ekliyoruz. Bunu yapmak için, karışımı şişeden bir behere aktarın ve önce suyu, ardından belirtilen çözeltiyi ekleyin. Kendine özgü bir kokuya sahip kahverengi bir sıvı göze çarpacaktır. Bu anilindir ve nazikçe süzülerek ayrıştırılabilir. Buhar damıtma yoluyla izole etmek daha zahmetli olsa da daha iyidir.
Dikkat! Anilin çok güçlü bir zehirdir ve yalnızca kapalı tutulması ve "zehir" olarak etiketlenmesi gerekir. Anilin ile çalışırken buharını solumamaya dikkat etmeniz gerekir. Anilin'i tıpkı dietil eter gibi, yalnızca seyreltilmiş alkol çözeltisi biçiminde depolamak en iyisidir.
Anilin, ilk sentetik organik boyaların üretiminde başlangıç malzemesi olarak görev yaptı. Uzun zaman önce Runge, bugün hala anilin tespitinde kullanılan ilk anilin boyasını keşfetti.
Birkaç damla anilini 10 ml suyla karıştırın ve filtrelenmiş sulu ağartıcı çözeltisi ekleyin. Yoğun menekşe rengi, karmaşık yapısı 20. yüzyılın kimyagerleri için bile zor bir bilmece olan bir boyanın oluşumundan kaynaklanmaktadır. Anilini sonraki deneylere saklayalım ve sonuç olarak günümüzde çoğu boyanın anilinden değil diğer bileşiklerden elde edildiğini not edelim.
Aromatik serinin diğer temsilcileri
Benzen'in diğer türevlerinden burada sadece fenol, toluen ve naftalinden bahsediyoruz. Fenol de vardı  İlk olarak Runge tarafından kömür katranında keşfedilmiştir. Hidroksil grubuna sahip aromatik bir bileşiktir ve bu nedenle alkanollere benzer. Ancak alkanollerden farklı olarak fenol hafif asidik bir reaksiyona sahiptir ve alkalilerle kolayca reaksiyona girerek fenolatlar oluşturur. Bu nedenle alkalilerde çözülebilir. İlgili kresolleri zaten odunun kuru damıtılmasından ve kahverengi kömürün yarı koklaştırılmasından elde ettik. Bu, odun katranı veya kahverengi kömür katranı ve katran suyu ekstraktına bir demir (III) klorür çözeltisi eklenerek kanıtlanabilir. Fenol ve ilgili maddeler maviden mavi-mora kadar bir renk verir. Doğru, reçine ve katran özleri için bu renk kendi kahverengi rengiyle maskelenebilir.
İlk olarak Runge tarafından kömür katranında keşfedilmiştir. Hidroksil grubuna sahip aromatik bir bileşiktir ve bu nedenle alkanollere benzer. Ancak alkanollerden farklı olarak fenol hafif asidik bir reaksiyona sahiptir ve alkalilerle kolayca reaksiyona girerek fenolatlar oluşturur. Bu nedenle alkalilerde çözülebilir. İlgili kresolleri zaten odunun kuru damıtılmasından ve kahverengi kömürün yarı koklaştırılmasından elde ettik. Bu, odun katranı veya kahverengi kömür katranı ve katran suyu ekstraktına bir demir (III) klorür çözeltisi eklenerek kanıtlanabilir. Fenol ve ilgili maddeler maviden mavi-mora kadar bir renk verir. Doğru, reçine ve katran özleri için bu renk kendi kahverengi rengiyle maskelenebilir.
Saf fenol, 40,8°C'de eriyen ve 182,2°C'de kaynayan bir katıdır. 16 ° C'de 12 kısım suda çözünür ve elde edilen çözelti turnusol kağıdını kırmızıya dönüştürür. (Kontrol edin!) Buna karşılık fenol de kendi içinde bir miktar suyu çözer ve içinde sadece %5 su çözünmüş olsa bile sıvı hale gelir! Katı fenole su eklersek, önce fenol içinde sıvı bir su çözeltisi, daha sonra su ilavesiyle su içinde bir fenol çözeltisi elde ederiz.
Plastik üretimindeki artışa bağlı olarak fenol, kimya endüstrisindeki en önemli ara ürünlerden biri haline geldi. Dünya üretimi artık yılda neredeyse 200.000 tona ulaşmış görünüyor. Doğu Almanya'da kahverengi kömürün yarı koklaştırılmasından önemli miktarda fenol elde ediliyor. Ayrıca sentez yoluyla giderek daha fazla fenol üretilir.
Benzen halkasına iki veya üç OH grubu eklendiğinde polihidrik fenoller oluşur. Bunlar güçlü indirgeyici maddelerdir ve bu nedenle hidrokinon gibi fotoğrafçılıkta geliştirici olarak kullanılırlar. Triatomik fenol - pirogallol - atmosferik oksijeni bile kolayca emer.
Toluen, bir hidrojen atomunun bir metil grubu ile değiştirildiği bir benzen türevidir. Bu sıvı benzene benzer özelliklere sahiptir; solvent olarak kullanılmasının yanı sıra üretiminde de kullanılmaktadır.  patlayıcılar. Üç nitro grubunun eklenmesiyle toluen, en güçlü patlayıcılardan biri olan trinitrotoluene dönüştürülür. Karbonizasyon sırasında büyük miktarlarda oluşan kresoller de OH grubu içeren toluen türevleridir. Dolayısıyla fenole karşılık gelirler.
patlayıcılar. Üç nitro grubunun eklenmesiyle toluen, en güçlü patlayıcılardan biri olan trinitrotoluene dönüştürülür. Karbonizasyon sırasında büyük miktarlarda oluşan kresoller de OH grubu içeren toluen türevleridir. Dolayısıyla fenole karşılık gelirler.
Şu tarihte:  Naftalini hatırlayalım - bu, birkaç halkalı hidrokarbonların en basit temsilcisidir. İçinde her iki benzen halkasının da iki ortak karbon atomu vardır. Bu tür maddelere denir yoğunlaştırılmış aromatik bileşikler.
Naftalini hatırlayalım - bu, birkaç halkalı hidrokarbonların en basit temsilcisidir. İçinde her iki benzen halkasının da iki ortak karbon atomu vardır. Bu tür maddelere denir yoğunlaştırılmış aromatik bileşikler.
Kömür katranı neredeyse %64 oranında naftalin içerir. 80°C'de eriyen ve 218°C'de kaynayan parlak kristal plakalar oluşturur. Buna rağmen naftalin oda sıcaklığında bile hızla buharlaşır. Naftalin kristallerini birkaç gün açık bırakırsanız gözle görülür şekilde azalacak ve odada keskin bir naftalin kokusu oluşacaktır. Naftalin, güve karşıtı ürünlerin çoğunun bir parçasıydı. Artık bu amaçla yerini giderek daha az rahatsız edici kokuya sahip diğer maddeler alıyor.
Endüstride ftalik asit, değerli boyaların elde edilmesi için başlangıç materyali olan naftalinden büyük miktarlarda üretilir. Daha sonra kendi başımıza boya alacağız.
İÇİNDE  Başka bir örnek alalım heterosiklik bileşik. Halkada yalnızca karbon atomlarını değil aynı zamanda diğer elementlerin atomlarını (bir veya daha fazla oksijen, nitrojen veya kükürt atomu) içeren maddelere heterosiklik denir. Bu alışılmadık derecede geniş bileşik yelpazesi, indigo ve morfin gibi önemli doğal maddelerin yanı sıra belirli amino asit moleküllerinin parçalarını da içerir.
Başka bir örnek alalım heterosiklik bileşik. Halkada yalnızca karbon atomlarını değil aynı zamanda diğer elementlerin atomlarını (bir veya daha fazla oksijen, nitrojen veya kükürt atomu) içeren maddelere heterosiklik denir. Bu alışılmadık derecede geniş bileşik yelpazesi, indigo ve morfin gibi önemli doğal maddelerin yanı sıra belirli amino asit moleküllerinin parçalarını da içerir.
Furfural'ı düşünün. Molekülünün dört karbon atomu ve bir oksijen atomundan oluşan beş üyeli bir halka içerdiğini görüyoruz. Yan zincire bakılırsa furfuralın heterosiklik bir alkanal olduğu söylenebilir.
Kepekten furfural alın
50 gr kepeği konik veya yuvarlak dipli bir şişeye koyup 150 ml %10-15 sülfürik asit çözeltisiyle karıştırıyoruz. Şişeden yaklaşık 100 ml sıvıyı damıtın. Yaklaşık 1 g çözünmüş furfural içerir. Bunu damıtık maddeden eter veya karbon tetraklorür ile ekstrakte edelim ve organik solventi çeker ocakta buharlaştıralım. Aşağıda sadece iki basit niteliksel reaksiyonu gerçekleştireceğiz.
İlk deneyde, elde edilen çözelti örneğine birkaç damla hidroklorik asit ve biraz anilin ekliyoruz. Zaten soğukta parlak kırmızı bir renk beliriyor.
Bir sonraki deneyde, test çözeltisine tekrar hidroklorik asit ve birkaç tane floroglisinol (bu bir trihidrik fenoldür) ekliyoruz. Kaynatıldığında kiraz kırmızısı bir renk görünecektir.
Seyreltik asitlerle kaynatıldığında bazı şeker türleri (pentozlar) furfural oluşturur. Pentozlar kepek, saman vb.de bulunur ve yukarıdaki yöntemlerle tespit edilebilir.
Bu birkaç (800.000!) örnekten birkaçı ile organik bileşikler dünyasına olan kısa yolculuğumuzu şimdilik tamamlayacağız. Sonraki bölümlerde organik kimyanın daha önemli bazı uygulamalarına döneceğiz.
5. Her zevke uygun malzemeler
PLASTİK DÜN, BUGÜN VE YARIN
- Üçü basit maddeler ve dördüncüsü bir elementin oksiti olan dört maddenin her biri diğer üçüyle etkileşime girebilir. Bu tür maddeler için olası formüller önerin ve karşılık gelen kimyasal reaksiyonlar için denklemler verin.
- Kalsiyum karbür ve su, aşağıdaki gibi kimyasal bileşiklerin üretimi için hammadde haline gelebilir: a) etan, b) asetik asit, c) etilen ve polietilen, d) vinil klorür ve polivinil klorür, e) benzen. Kalsiyum karbür, su ve diğer inorganik maddeleri elinizin altında bulundurarak bu bileşikleri elde etmek için reaksiyon denklemlerini yazın.
- Ardışık oksidasyon, değişim ve ikame reaksiyonları sonucunda hangi maddeden diğer organik maddeler kullanılmadan 3-nitrobenzoik asit elde edilebilir? Reaksiyon denklemlerini yazın ve oluşma koşullarını belirtin.
- Eşit konsantrasyondaki eşit hacimdeki bromlu suyun renginin giderilmesi, iki izomerin farklı miktarlarını gerektirir. Bu tür izomerlerin iki çiftine örnekler verin, karşılık gelen reaksiyonların denklemlerini yazın.
- 10 ml hacimli gaz halindeki hidrokarbon, 70 ml oksijen ile karıştırıldı. Ortaya çıkan karışım ateşe verildi. Reaksiyonun sonunda ve su buharının yoğunlaşmasından sonra gaz karışımının hacmi 65 ml idi. Ortaya çıkan gaz karışımı, fazla alınan bir sodyum hidroksit çözeltisinden geçirildiğinde hacmi 45 ml'ye düştü. Gazların hacimlerinin normal koşullar altında ölçüldüğünü varsayarak bir hidrokarbonun moleküler formülünü belirleyin.
- D.I.'ye mektup Mendeleev.
"Majesteleri! İzin verin, size yeni bir element keşfettiğimi belirten mesajın bir tekrarını vereyim. İlk başta, bu elementin, harika bir şekilde nüfuz eden periyodik sisteminizde antimon ve bizmut arasındaki boşluğu doldurduğu ve bu elementin sizin ekaantimonunuzla örtüştüğü kanaatindeydim, ancak her şey burada eka ile uğraştığımızı gösteriyor ....... Yakında size bu ilginç madde hakkında daha fazla bilgi vermeyi umuyorum; Bugün kendimi, parlak araştırmanızın çok muhtemel zaferi hakkında sizi bilgilendirmekle ve size saygı ve derin saygımı ifade etmekle sınırlıyorum.
Adanmış ………… ………….
Freiberg, Saksonya
26 Şubat 1886."D.I.'ye mektubu kim yazdı? Mendeleyev mi?
D.I.'nin mektubunda bahsedilenleri oluşturan birkaç mineralden biri. Mendeleev elementi ayrıca kükürt ve gümüş içerir. Mineraldeki kükürt ve gümüşün kütle oranları sırasıyla %17,06 ve %76,50'dir. Mineral formülünü belirleyin ve adını verin. Potasyum nitrat varlığında bir mineralin soda ile füzyon reaksiyonunun denklemini verin. Mektupta tartışılan basit bir maddeyi ortaya çıkan alaşımdan nasıl izole edebilirsiniz? Nerede kullanılır?
Bu basit maddenin saflaştırılması yöntemleri nelerdir?
Kalsine kalsiyum klorür, az miktarda su içeren organik sıvılar için en yaygın dehidrasyon maddesidir.
Alkoller ve aminler kalsiyum klorürle kurutulamaz.
Çalışmadan önce kalsiyum klorür CaCl2, bir demir tavada kalsine edilerek kurutulmalıdır. Tuz, 1-2 cm'yi geçmeyecek bir tabaka halinde dökülerek güçlü bir ocak aleviyle ısıtılır. İlk önce tuz, kristalizasyon suyunun salınmasıyla erir ve ardından ikincisi yavaş yavaş buharlaşır. Bir tuz tabakasını kıran su buharı onun dağılmasına neden olur; bu nedenle kalın bir tuz tabakası dökülmesi tavsiye edilmez. Suyun tamamı buharlaştığında kalsinasyona bir süre daha devam edilir, daha sonra sinterlenmiş tuz daha küçük parçalara bölünür ve önceden hazırlanmış tamamen kuru bir kavanoza hala sıcak olarak yerleştirilir. Her zaman bir miktar su buharı içeren kavanozun içine hava girmemesi için hava geçirmez şekilde kapatılması gerekir.
Kavanoz mantar tıpa ile kapatılırsa yukarıdan parafin veya balmumu ile dikkatlice doldurulmalıdır.
Laboratuvarda her zaman bir miktar kalsine CaCl2 bulunmalıdır.
Herhangi bir organik sıvının dehidrasyonu için, içindeki su içeriğine bağlı olarak bir veya daha fazla miktarda CaCl2 alınır. Susuz madde kaybı kaçınılmaz olduğundan çok fazla tuz alınmamalıdır. Kurutulacak sıvının bulunduğu bir kaba doğru miktarda tuz dökülür, kap bir mantarla sıkıca kapatılır ve birkaç kez çalkalanır. Daha sonra karışımın en az 12 saat beklemesine izin verilir, daha sonra sıvı bir damıtma şişesine dökülür ve damıtılır (yukarıya bakın). Kalsiyum klorür her kullanımdan sonra yeniden ateşlenirse tekrar tekrar kullanılabilir. Bu nedenle CaCl2 ile sık sık uğraşılan laboratuvarlarda atık tuzun döküleceği kavanozlar bulunmalı; biriktikçe tekrar kalsine edilir. Bu tuzla kurutulan sıvının kalıntıları da yandığından, harcanan CaCl2'nin kalsinasyonu saf olandan biraz farklı yapılmalıdır.
İlk başta tuz, sıvının buharları çıkana kadar hafifçe ısıtılır ve ısıtma yavaş yavaş artırılır, aksi takdirde, özellikle tuzun eter, aseton veya diğer yanıcı madde kalıntıları içermesi durumunda yangın meydana gelebilir. Ateşleme çeker ocakta yapılmalıdır.
Diğer tuzlardan kalsine sodyum sülfat, organik sıvıları kurutmak için kullanılır. CaCl2 ile aynı şekilde kalsine edilir. Sodyum sülfat Na2SO4, CaCI2 kadar güçlü bir kurutma maddesi değildir.
Alkolleri kurutmak için bakır sülfat CuSO4 veya kalsiyum oksit CaO kullanılır. Mavi kristaller formundaki bakır sülfat CuSO4 · 5H2O, kristalleşme suyu içerir; tuz kalsine edilirse sarımsı renkte susuz bir tuz elde edilecektir. Nemlendirildiğinde, bir tuz molekülü başlangıçta yalnızca iki su molekülünü bağlar ve maviye döner. Alkoldeki su içeriğini bilerek, tamamen kurutmak için gereken CuSO4 miktarını hesaplamak mümkündür.
Alkole CuSO4 eklendikten sonra şişe birkaç kez çalkalanır ve su banyosunda geri akış altında tuz açık mavi renk alana kadar ısıtılır. Daha sonra tuzun süzülerek ayrılmasıyla alkol damıtılır.
Ancak mutlak denilen tamamen susuz alkol elde etmek çok zordur. CuSO4 alkolü kurutulduktan sonra saf CaO ile iki veya üç kez daha damıtılmalı ve alıcı buzdolabına sıkıca bağlanmalı ve kuru kalsiyum klorürlü bir kalsiyum klorür tüpüyle donatılmalıdır.
Ancak bundan sonra bile alkolde% 0,5'e kadar su kalır ve bunun çıkarılması en zor olanıdır. Bu kalıntıyı gidermek için bazen metalik sodyum ve kalsiyum kullanılır.
Alkol için en iyi dehidrasyon maddesi, az miktarda iyot varlığında magnezyum ve etil alkolün (alkol %1'den fazla su içermemelidir) reaksiyona sokulmasıyla kolayca elde edilebilen magnezyum etoksittir. Bu yöntemle alkolün dehidrasyonu aşağıdaki gibi gerçekleştirilir.
Geri akış yoğunlaştırıcılı 1,5 litrelik bir şişeye 5 g magnezyum talaşı dökülür, 65-70 ml alkol dökülür, 0,5 g iyot (katalizör) eklenir ve ikincisi eriyene kadar ısıtılır, ardından hidrojen açığa çıkar:
Mg + 2C2H5OH -> Mg (OC2H5) 2 + H2
Reaksiyon bittiğinde, çözeltiye 800-900 ml sıradan mutlak alkol, yani %0,5-0,7 su içeren bir alkol eklenir, yarım saat geri akıtılır ve ardından mutlak alkol damıtılarak çıkarılır.
Metil ve n-propil gibi diğer alkoller de aynı şekilde dehidre edilebilir.
Alkol, bir geri akış şişesi kullanılarak kalsiyum metali ile kurutulabilir. 1 litre alkole 20 g kuru kalsiyum parçacıkları eklenir ve bir su banyosunda kaynatılıncaya kadar ısıtılır, bu kaynatma birkaç saat sürdürülür, ardından alkol yukarıda açıklanan tüm önlemlerle damıtılır.
Su, benzen ve etil alkol azeotropik bir karışım oluşturur. Etil alkol, su ve benzen içeriği 18,5: 7,4: 74,1 olan karışım 65 0C'de kaynar, bu da bu karışımın alkoldeki su izlerini gidermek için kullanılmasını mümkün kılar.
Bunu yapmak için, en az %99 C2HsOH içeren etil alkole kuru benzen eklenir. Pratik olarak alkolün içerdiği 1 saat su için 11-12 saat kuru benzen alınmalıdır. Daha sonra karışım ayrımsal damıtma işlemine tabi tutulur. Birinci fraksiyon 64,85°C'de damıtılır ve alkol, su ve benzenden oluşur. İkinci fraksiyon 68,25°C'de kaynar ve fazla miktarda benzen ve alkolden oluşur. Etil alkolün damıtma kabında kalan kısmı mutlak etil alkoldür.
Susuz alkol, havadaki nemin etkisinden çok dikkatli bir şekilde korunmalıdır. Bu nedenle iyi kurutulmuş bir tabağa hızla dökülerek dikkatlice kapatılır. Bu yöntem, metil alkol dışındaki tüm alkolleri dehidre edebilir.
Alkol dehidrasyonunun eksiksizliği aşağıdaki kalite numunelerine dayanarak belirlenebilir:
a) susuz alkol, kostik bariti çözerek sarı renkli bir çözelti oluşturur;
b) parafin çözeltisi içinde bulanıklık oluşturmaz;
c) mutlak alkolde susuz bakır sülfat rengini değiştirmez.
Katı organik bileşiklerin (fruktoz ve özellikle suyu doğrudan ısıtma yoluyla uzaklaştırmak için gerekli sıcaklıkta yumuşayabilen, eriyebilen veya ayrışabilen maddeler) dehidrasyonu için kurutma maddeleri kullanılır. Bunu yapmak için katı, mutlak etanol içerisine dökülür ve ardından benzen eklenir. Isıtma su deposunda gerçekleştirilir. Sıvının tamamı damıtıldığında, kalan benzen ve alkol, kuru hava üflenerek şişeden çıkarılır.
Dietil eter az miktarda metalik sodyum ile dehidre edilebilir.
Metalik sodyum, kavanozlarda kerosen, vazelin yağı veya toluen tabakası altında depolanır. Metalik sodyumun bu şekilde depolanmasına duyulan ihtiyaç aşağıdakilerden kaynaklanır: 1) havada kuvvetli bir şekilde oksitlenir, 2) üzerine bir damla su düşerse patlama meydana gelebileceğinden sudan izole edilmelidir. Metalik sodyum dikkatle kullanılmalıdır. İş yerinin yakınında su olmadığından emin olun. Bir lavabonun veya su musluklarının yakınında çalışmak kesinlikle kabul edilemez.
Sodyumun depolandığı gazyağı, vazelin yağı ve toluen nötr olmalı ve elbette su içermemelidir.
Bu parça hızlı bir şekilde filtre kağıdı ile sıkıştırılır ve temiz, kuru bir bıçakla istenilen büyüklükte bir parça kesilir. Geri kalanı hemen kavanoza geri konur.
Kesilen sodyum parçası, üzerinde gazyağı veya vazelin yağı kalmayacak şekilde filtre kağıdı ile tekrar preslenir. Bundan sonra, metalin yüzeyinden sodyum oksidi çıkarmak için temiz, kuru bir bıçakla ince bir tabaka (“kabuk”) kesilir, kırpıntılar metalik sodyumlu bir kavanoza konur. Saflaştırılmış sodyum parçası bir bıçakla yaklaşık 2 mm3 boyutunda birkaç küçük parçaya kesilir ve ardından hızla eter veya başka bir sıvıya konularak kurutulur. Şişe mutlaka bir kalsiyum klorür tüpü ile bir tıpa ile kapatılır.
Sodyum, 12-24 saat boyunca kurutulacak sıvı içinde bekletildikten sonra, sıvı, metalik sodyum üzerinde damıtılarak çıkarılır. Damıtma tamamlandığında geriye kalanlar< талла переносят в банку с керосином или вазелиновым маслом. Лучше иметь отдельную банку, куда следует класть как обрезки («корочки»), так и металл, уже упо-треблявшийся для работы.
Metalik sodyumun (ve potasyumun) da plastik ambalajda saklanması tavsiye edilir. Sodyum, 0,5 mm kalınlığa sahip bir polietilen film torbasına yerleştirilir (bu kalınlık, birkaç kat sıradan polietilen filmin bir araya getirilmesiyle elde edilebilir), torbanın açık ucu kapatılır. Belli bir miktar sodyum alınması gerekiyorsa torba açılır, içindeki madde çekilir, temiz bir bıçakla bir parça kesilip geri kalanı yine kenarları önce gelecek şekilde torbaya itilir. içine hava girmeyecek şekilde bükülür ve sonra kapatılır. Sodyum artıkları aynı veya başka bir torbaya yerleştirilebilir ve kapatılarak kapatılabilir.
Hurdalar ve kullanılmış metalik sodyum parçaları, eritilmeleri halinde yeniden kullanılabilir. Metalik sodyumun erime noktası 98°C'dir. Sodyumun açık havada eritilmesi imkansızdır, bu nedenle metalik sodyumdan etkilenmeyen ve 150 ° C'den düşük olmayan bir sıcaklıkta kaynayan bir sıvı içinde yeniden eritilir Gazyağı böyle bir madde görevi görebilir, ancak daha da iyi olabilir yani daha güvenli vazelin yağı. Bu sıvılardan birine kesilmiş parçalar ve sodyum parçaları konularak yaklaşık 12O0C'ye ısıtılır.Metalik sodyum eritilir ve ısıtmanın gerçekleştiği porselen kabın tabanında * temiz yüzeyli bir metal parçası oluşur. / Eritme sırasında tek tek metal toplar elde edilirse, bunlar ince bir cam çubuk kullanılarak birleştirilir. Tüm metal eridiğinde, sıvının soğumasına izin verilir, ardından dikkatlice boşaltılır (ancak hepsi değil) ve sodyum kuru cımbızla yakalanıp gazyağı içine yerleştirilir.
Organik sıvılar ayrıca kalsiyum karbür CaCr ile kurutulabilir. Kalsiyum karbür, asetilen ve kalsiyum hidroksit oluşturmak üzere suyla ayrışır:
CaC2 + 2H2O = C2H2 + Ca(OH)2
Kurutma için kalsiyum karbürün kullanılması yalnızca kurutulan sıvının CaC2, C2H2 veya Ca(OH)2 ile reaksiyona girmediği durumlarda mümkündür. Kalsiyum karbür ile kurutma sırasında gaz (asetilen) açığa çıktığı için kurutmanın yapıldığı şişenin kalsiyum klorür tüplü bir tıpa ile kapatılması gerekir.
Kurutma, kurutulacak sıvının içine saf toz halindeki CaC2'nin doğrudan dökülmesiyle (su içeriğine bağlı olarak alınan sıvının ağırlığının %10-15'ine kadar) gerçekleştirilir veya sıvı buhar kurutulur. *
Kurutma için, kalsiyum karbürlü sıvı buharlar, bir şişe, bir ters bilyeli soğutucu ve bir banyodan oluşan bir cihaz monte edilir. Kurutulacak maddeyi bir şişeye dökün ve banyoya sabitleyin. Bilyeli buzdolabında ikinci ve üçüncü veya üçüncü ve dördüncü topların arasına eritilmiş metal bir ağ yerleştirilir; CaC2 parçaları, tüpünden serbestçe geçecek büyüklükte dikkatlice buzdolabına atılır. İki veya üç topu bu şekilde doldurduktan sonra, yoğunlaştırıcıyı şişenin boynuna sabitler ve ısıtırlar. Su içeren bir maddenin buharları CaC2 tabakasından geçer ve soğuma ve yoğunlaşma üzerine susuz kalan madde şişeye akar. Dehidrasyon 2-3 saat boyunca gerçekleştirilir ve bunun sonu, karbür tozunun veya topaklarının bulanıklaşmaya başlamasıyla değerlendirilebilir.
Cihaz başka bir şekilde monte edilebilir. Susuzlaştırılacak sıvı bir Claisen şişesine yerleştirilir. Bir yoğunlaştırıcıya bağlı olan şişenin boynu kalsiyum karbür ile doldurulur. Sıvı damıtılır ve karbür tabakasından geçen buharları kurutulur. Dehidre edilen sıvı, damıtılan sıvının tekrar ortamdan su buharı çekmemesine dikkat edilerek bir alıcıda toplanır.
CaC2 kullanılarak bir sıvının sadece dehidrasyonu sağlanmaz, aynı zamanda içindeki su içeriği de ölçülebilir; bunun için ortaya çıkan asetilen yakalanır, asetonlanır ve bakır asetilen formunda belirlenir. Bakır asetilen miktarına göre sıvıdaki su içeriği değerlendirilir. Bu kurutma yöntemi en iyilerinden biridir. Dezavantajı, asetilenin sadece ısıtılarak giderilebilen susuz sıvıya girmesidir.
Dondurarak dehidrasyondan da bahsetmek gerekir; yani örneğin; benzen dehidre edilebilir. İkincisi 4 ° C'de katı duruma geçer. Sulu benzenin 1 veya hatta 0 ° C'ye soğutulması, kristal benzen elde edilir ve açığa çıkan su boşaltılır.
Alkolün dehidrasyonu için alçı yöntemi* olarak adlandırılan yöntemden bahsetmeye değer. Ek olarak, magnezyum perklorat (fosforik anhidriti bile aşan güçlü bir su giderici madde) kullanılması tavsiye edilir. İkinci madde, ağırlıklı olarak kimyasal olarak dirençli maddelerin kurutulması için kullanılabilir.
Yüksek viskoziteye sahip sıvılara kurutma maddesi eklenirse kurutma uzun süre devam eder ve ayrıca katının yüzeyinde önemli miktarda sıvı kalır. Bu durumlarda, kurutulacak sıvıya uygun bir kuru solventin (örn. eter) eklenmesi ve ardından yukarıdaki gibi kurutulması tavsiye edilir. Daha sonraki damıtma sırasında solvent kolaylıkla uzaklaştırılabilir.
Pek çok durumda, özellikle organik maddelerin analizinde, karbon ve hidrojen tayininde emici su olarak susuz kalsiyum sülfat (CaSO4) kullanılır. Susuz kalsiyum sülfat, iki su veya hemihidrat kalsiyum sülfatın 225±5°C sıcaklıkta ısıtılmasıyla elde edilir. CaSO4'ün kurutulduğu sıcaklık, su buharının hızlı emilmesine uygun bir preparat elde edilmesinde büyük önem taşımaktadır. Hiçbir durumda sıcaklık aşılmamalıdır. Kurutmadan önce CaSO4 2H2O veya CaSO4 0.5H2O ezilir ve 1-2 mm hücreli bir elekten elenir. Elenen taneler (ancak bir elekten geçen ince taneler değil!), daha önce Pr05 üzerinde kurutulan havanın çekilmesiyle 225 ± 5 ° C'de 2-3 saat ısıtılan, çoğunlukla U şeklinde olan kalsiyum klorür tüplerine yerleştirilir. onlara. Hava çekme hızı yaklaşık 50 ml/dakikadır. CaSO4 su ile etkileşime girdiğinde CaSO4 hemihidrat 0.5H2O oluşur. Susuz kalsiyum sülfat, suyun ağırlıkça %6,6'sını emebilir. Birçok kez yenilenebilir, nötrdür, kimyasal olarak inerttir ve suya doyduğunda bulanıklaşmaz.
* Luhder E., Z. Spirilusinduslrie S. 7, 67 (1934).
Her durum için doğru kurutma maddesini seçmek çok önemlidir, çünkü yanlış dehidrasyon maddesi seçimi tüm işi mahvedebilir. Bu nedenle farklı maddeler için hangi kurutma maddelerinin kullanılabileceğini bilmek önemlidir.
Kurutma için yaygın olarak kullanılan inorganik maddeler aşağıdaki gruplara ayrılabilir:
1. Kolayca oksitlenen metaller: Na, Ca.
2. Suyu kolayca bağlayan oksitler: CaO, P2O5.
3. Higroskopik hidroksitler: NaOH veya KOH.
4. Susuz tuzlar: a) alkalin (K2CO3), b) nötr (CaCl2, Na2SO4, CuSO4, CH3COONa).
Masada. Şekil 15, çeşitli organik sıvıların dehidrasyonunda kurutma maddesinin seçimine ilişkin yönergeleri vermektedir.
Yeni dehidrasyon yöntemleri, su adsorpsiyonu prensibinin kullanımını içerir *. Organik çözücülerden su, ikincisi aktif Al2O3 ile doldurulmuş 15-40 mm çapında bir cam kolondan geçirilerek çıkarılır. Bu yöntemle dehidrasyonun tamlığına göre çözücüler şu şekilde sıralanır: benzen > kloroform > dietil eter > asetik etil eter > aseton. Bu absorber ile etil alkol %99,5'e kadar dehidre edilebilmektedir.
A1203 suyla birlikte birçok başka kirleticiyi de emer. Harcanan A1203 yenilenmez ve yenisiyle değiştirilmez.
Organik sıvıları ve gazları kurutmanın çok etkili bir yolu zeolitlerle kurutmadır, bu durumda kalan nem yüzde on binde birine eşittir.
NaA zeolit, transformatör yağının, çeşitli yağ fraksiyonlarının, soğutucuların, alkollerin ve birçok petrokimyasal sentez ürününün derin kurutulması için uygundur.
Zeolit CaA, polar maddelerin (H2O, H2S1CO2, vb.) seçici ekstraksiyonu için kullanılabilir.
* Angew. Chem., 67, Ki 23, 741 (1955); RZhKhim, 1955, Ki 14, 85, ref. 42799; Laboratuar. Sci.4, sayı 4, 111 (1956); RZhHnm. 1957, Ki 8, 95, ref. 26289; Kimya Rund., 11, K". 7, 164 (1958); RZhKhim, 1959, Ka 1, 163, ref. 1120.
Organik sıvıları kurutmak için kullanılan maddeler
Kurutma maddeleri |
Kurutulabilir |
Kurutulamaz |
|
Hidrokarbonlar; eterler |
Fenoller, bazlar ve benzeri maddeler |
||
Esterler (son alkol izlerini gidermek için); kloro- |
Yağ asitleri, piridin bazları, ketonlar, |
||
Hidroksitler |
|||
Oksitlenmesi zor olan bazlar |
|||
Susuz |
Hidrazonlar; kolayca oksitlenen bazlar; esterler; nitriller vb. |
||
asitler; esterler; fenoller |
|||
Hidrokarbonlar ve nx halojen üreten; aldehitler ve ketonlar; ni-trosoediieniya; eterler |
Alkoller, fenoller; bazı aminler ve amidler; bazı yağ asitleri ve esterleri |
Seçenek 5
Alkoller ve fenoller.
1. C5H12O (I) ve (II) bileşimindeki bir alkol için PCl5'in etkisi altında karşılık gelen monoklor türevleri elde edilir, ikincisinin dehidrasyonu üzerine aynı alken 2-metil-2-buten elde edilir. Alkollerin (I) ve (II) yapısal formüllerini yazınız.
2. Monohidrik alkoller hangi nedenle ve hangi koşullar altında birbirleriyle reaksiyona girebilir? Hangi maddeler oluşur?
3. Alkollerin ilk temsilcilerinin neden sıvı maddeler olduğunu açıklayınız.
4. Reaksiyon denklemlerini şemaya göre oluşturun. Bilinmeyen maddelerin şifresini çözün - yapısal formüllerini ve adlarını verin.

5. 50 ml metanolün (p=0,80 g/ml) yanması için hava hacmi gereklidir:
a) 150l b) 200l c) 250l d) 180l
6. Bir fenol ve asetik asit karışımının tamamen nötrleştirilmesi için, 1,2 g / ml yoğunluğa sahip, ağırlıkça% 20'lik 46,8 ml KOH çözeltisi gereklidir; aynı karışım bromlu su ile etkileşime girdiğinde 33,1 g çökelti oluşur. oluşturulmuş. Başlangıç karışımındaki asetik ve fenolün kütle fraksiyonlarını belirleyin.
Kontrol çalışması 90 dk.
Seçenek - 10
1) C3H8O formülüne karşılık gelen izomerik alkollerin ve eterlerin yapısal formüllerini yazın. Onlara isim verin.
2) Etanol ve gliserini tanımak için şunu kullanın:
a) Hidrojen klorür
c) Asetik asit
d) Bakır (II) hidroksit
Reaksiyonun denklemini yazın.
3) Kalsiyum karbürden fenol elde etmek için yapılması gereken kimyasal reaksiyonların denklemini yazın ve bunların uygulanma koşullarını belirtin.
4) Aşağıdaki dönüşümleri gerçekleştirebileceğiniz reaksiyon denklemlerini yazın:
Reaksiyon koşullarını belirtin.
5) 50 g %2,6 fenol çözeltisine reaksiyonun sonuna kadar bromlu su ilave edildi. Tam nötralizasyon için reaksiyon karışımına hangi kütlede %2 sodyum hidroksit çözeltisinin eklenmesi gerektiğini belirleyin. Reaksiyon denklemini yazın.
6) 4,7 g fenolün 4,97 ml (p = 1,38 g / ml) hacimli bir sodyum hidroksit çözeltisi ile reaksiyona sokulmasıyla hangi kütlede sodyum fenolat elde edilebilir? Çözeltideki sodyum hidroksitin kütle oranı %35'tir.
90 dakika boyunca kontrol çalışması
Seçenek numarası 4
1. 1-propanolün 2-propanole dönüştürülebildiği reaksiyon denklemlerini yazın.
2. maddenin formülü ile hazırlanma yöntemini eşleştirin:
3. Asit özellikleri en çok şu durumlarda belirgindir:
1) fenol 2) metanol 3) etanol 4) gliserin
|
|
5. 13,8 g etanolün 28 g ağırlığındaki bakır (II) oksit ile oksidasyonu sırasında pratik bir verimle 9,24 g aldehit elde edildi:
A) %70 B) %75 C) %60 D) %85
6. Etanolün dehidre edilmesi için kalsiyum karbür kullanıldı, %96 etanol içeren 150 ml hacimli ve p = 0,8 g/ml yoğunluğa sahip kalsiyum alkole eklenmesi gereken kalsiyum karbürün kütlesi (gram cinsinden) nedir? susuz alkol?
Kontrol çalışması 90 dk.
Seçenek 12
1. Alkol moleküllerinde fonksiyonel bir grubun varlığı aşağıdakileri etkilemez:
A) suda çözünürlük B) kaynama noktası
B) hidrokarbon radikalinin yapısı D) karakteristik kimyasal özellikler
2. Yapısal formülü CH2=CH-CH2OH olan bir bileşiğin kimyasal özellikleri nelerdir? Uygun reaksiyon denklemlerini yaparak cevabınızı doğrulayın. Bunların uygulanmasına ilişkin koşulları belirtin.
3. İki test tüpünde etil alkol ve etilen glikol bulunmaktadır. Bu maddeler nasıl ayırt edilebilir?
4. Reaksiyon denklemlerini dönüşüm şemalarına göre oluşturun:
Kalsiyum karbür → asetilen → benzen → klorobenzen → fenol → trinitrofenol
Reaksiyon koşullarını belirtin.
5. Kütle fraksiyonu %92 olan 200 g sulu çözeltiden elde edilebilecek etilen glikolün kütlesini hesaplayın.
6. 9 g doymuş monohidrik alkol bakır (II) oksit ile oksitlendiğinde 9,6 g bakır elde edildi. Alkolün moleküler formülünü belirleyin. Verimi %90 ise oluşan aldehitin kütlesini hesaplayın
Winkler tarafından üretilen etanolün bir takım dezavantajları vardır: çoklu
damıtma sonucu ürün amonyakla kirlenir
kalsiyum metalinde safsızlık olarak bulunan kalsiyum nitrürün hidrolizi.
e) Kalsiyum karbür etkili bir kurutucudur ancak çevreyi kirletir
asetilen ve diğer ürünlerle alkol. Şu anda, etanolün mutlak çökeltilmesi için ne metalik kalsiyum ne de onun karbürleri kullanılmamaktadır.
f) Susuz bakır sülfat yoğunluğu açısından avantajlıdır.
mavi renk orijinal alkolün kalitesine ve sonuna göre değerlendirilebilir
mutlak süreç. Ancak aynı zamanda şu anda
pratik olarak kullanılmamaktadır.
g) Alkol - benzen karışımının azeotropik damıtılması.
Teknik ölçekte mutlak alkol elde etme yöntemi de laboratuvar koşulları için geliştirildi. Ancak pratikte bu
Yöntem yaygın olarak benimsenmedi.
h) Klorür spike'ı 95° dehidrasyon için kullanıldı
Gaz fazında etanol. Bu yöntemle %99,8 etanol elde edildi.
Ortaya çıkan çözeltiden kalsiyum klorür kolayca yeniden üretilir.
i) Etanolün kurutulması için susuz kalsiyum sülfat da önerilmiştir. Ancak nispeten zayıf bir kurutucudur ve
alkolün tamamen dehidrasyonu için. Ayrıca harika içerik
su, şişeden çıkarılması zor olan bir dihidrat oluşturur.
Etil alkol genellikle çeşitli maddelerin katalitik hidrojenasyonunda çözücü olarak kullanılır. Bu durumda genellikle az miktarda suyun varlığı önemli değildir ancak katalizörü zehirleyen maddelerin uzaklaştırılması önemlidir. Saf %95 etil alkol bu maddelerden çok az miktarda içerir ve genellikle ince kesitli bir cihazda damıtılması yeterlidir. Aynı zamanda ince kesitler iyice temizlenir ve yağlanmaz ve distilatın ilk kısmı atılır. Daha da verimli olanı, alkolün az miktarda Raney nikeli üzerinden damıtılmasıdır.
11.3. "-Propil alkol
“-Propil alkol (bp. 973) su ile azeotropik bir karışım oluşturur, 88°'de kaynar ve %71 propil alkol içerir. Su ile her oranda karışabilir. Drenajı için kalsiyum oksit kullanılır ve son dehidrasyon için kalsiyum hidrit kullanılır. Düşük su içeriğiyle dehidrasyon, sodyum metalinin propil alkol içinde çözülmesiyle hazırlanan sodyum proplat kullanılarak gerçekleştirilebilir.
11.4. İzopropil alkol
Çok balyası var. 82,4°, su ile azeotropik bir karışım oluşturur, bp. 80°, %87,4 izopropil alkol içerir. Su ile her bakımdan karışabilir. Yüksek su içeriğine sahip olan izopropil alkol önce sodyum karbonat veya potas ile kurutulur ve son olarak kalsiyum klorür ile mutlaklaştırılır. Az miktarda su içeren kalsiyum oksit, su içeriğini %0,1'e düşüren iyi bir kurutucudur; Nihai dehidrasyon için susuz bakır sülfat üzerinde damıtma tavsiye edilir. Ayrıca izopropil alkolü kurutmak için etil alkol için yukarıda saydığımız tüm yöntemleri kullanabilirsiniz.
11.5. Bütil alkoller
“-Bütil alkol (kn. 118°) su ile bp ile azeotropik bir karışım oluşturur. 93°, %58 "-bütil alkol içerir.
İzobütil alkol (kn. 108 °), bp'li su ile azeotropik bir karışım verir. 90°, %67 izobütil alkol içerir.
emop-butil alkol (kn. 99.5°) su ile azeotropik bir karışım oluşturur, bp 87,5°, %73 emop-bütil alkol içerir.
/rzpem-Bütil alkol (kn. 82,5°), su ile azeotropik bir karışım oluşturur, 80°'de kaynar ve %88 mpem-bütil alkol içerir.
Listelenen alkollerin ilk üçü suyla sınırlı olarak karışabilir ve çoğu durumda bunların kurutulması için fraksiyonel damıtma yeterlidir. Kimyasal kurutuculardan kalsiyum oksit, baryum oksit, magnezyum oksit veya sodyumun bu alkol içinde çözülmesiyle elde edilen karşılık gelen sodyum alkolat kullanılabilir.
mpem-bütil alkol ise suyla her oranda karışabilir. Bu, oksitleyici maddelere, halojenlere vb. karşı yüksek dirence sahip önemli bir solvent gücü ile karakterize edilen çok değerli bir solventtir. Yüksek su içeriğine sahip tert-butil alkol, öncelikle kalsiyum klorür ile kurutulur. Az miktarda su, kalsiyum oksit veya metalik sodyum ile uzaklaştırılır. Tert-butil alkolün yüksek katılaşma sıcaklığı (25,7 °), fraksiyonel kristalizasyon yoluyla saflaştırılmasını mümkün kılar.
11.6. Daha yüksek alifatik alkoller
Bu tip alkoller için aşağıda sadece fiziksel sabitler verilmiştir. Saflaştırmanın ana yöntemi, örneğin geleneksel kurutucuların (kalsiyum oksit, baryum oksit vb.) eklenmesiyle damıtmadır.
İzoamil alkol (bp 132e) su ile azeotropik bir karışım oluşturur, 95°C'de kaynar ve %41 alkol içerir.
Optik olarak aktif amil alkol, bp 128°.
n-Heksil alkol (kn. 157.5°), su ile azeotropik bir karışım oluşturur, 98°'de kaynar ve %20 alkol içerir.
2-Etilbütanol-1 (b.p. 146°) görüntüsü