Энергетические переходы в атоме
На правах рукописи
Физика
Конспект лекций
(Часть 7. Атомная физика. Лазеры)
Для студентов направления 230400
«Информационные системы и технологии»
Электронный образовательный ресурс
Составитель: к.ф.-м.н., доцент В.В. Коноваленко
Протокол № 1 от 04. 09. 2013 г.
Атомная физика
Водородоподобный атом.
Напомним, что система, состоящая из неподвижного ядра и движущегося вокруг него электрона, называется водородоподобным атомом или водородоподобным ионом.
Поле, в котором движется электрон, является центрально симметричным. Поэтому при решении уравнения Шрёдингенра в данном случае используют сферическую систему координат: Уравнение Шрёдингенра для электрона в центральном поле ядра с зарядом имеет вид:
 (35.1)
(35.1)
Подставив в это уравнение оператор Лапласа в сферических координатах, получим:
Решения (35.2), удовлетворяющие стандартным условиям, получаются при любых положительных Е и при дискретных отрицательных значениях:
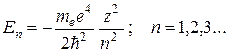 (35.3)
(35.3)
Положительные значения энергии соответствуют электрону, пролетающему вблизи ядра и удаляющемуся на бесконечность. Такой электрон не связан с ядром, не образует атом (или ион) и интереса не представляет.
Электрону, связанному с ядром, соответствуют отрицательные значения энергии (35.3). Необходимо подчеркнуть, что эти значения соответствуют значениям, полученным в теории Бора, но в квантовой механике они являются следствием уравнения Шрёдингера, и дополнительных предположений в виде постулатов не требуется.
Собственные функции уравнения Шрёдингера содержат три целочисленных параметра: n, l, m :
![]()
n – называется главным квантовым числом и совпадает с номером уровня энергии в (35.3).
l и m – азимутальное и магнитное квантовые числа , определяющие модуль и проекцию момента импульса на некоторое направление.
Решения, удовлетворяющие стандартным условиям, получаются лишь для значений l , не превышающих . Следовательно, при заданном n , азимутальное квантовое число l может иметь значения
![]() (35.4)
(35.4)
При заданном l магнитное квантовое число m может принимать различных значений:
(35.5)
Энергия электрона электрона в атоме водорода зависит только от n главного квантового числа (см. (35.3)), поэтому каждому уровню энергии соответствует несколько собственных функций, отличающихся значениями l и m . Таким образом, атом водорода может иметь одну и ту же энергию, находясь в состояниях, описываемых различными волновыми функциями. Энергетические состояния в таком случае называются вырожденными , а число различных состояний, соответствующих данной энергии – кратностью вырождения соответствующего энергетического уровня.
Кратность вырождения энергетических уровней водорода легко рассчитать. Каждому из n значений числа l соответствует 2l + 1 значение m. Таким образом, кратность вырождения можно рассчитать по формуле:
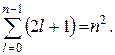
Напомним, что азимутальное квантовое число определяет значение момента импульса, и состояния электрона в атоме водорода с различными значениями азимутального квантового числа l отличаются величиной момента импульса. Электрон, находящийся в состоянии с
l = 0 – называют s -электроном (s состояние);
l = 1 – называют p -электроном (p состояние)
l = 2– называют d -электроном (d состояние)
l = 3 – называют f -электроном (f состояние) и т.д.
При обозначении состояния в котором находится электрон, принято значение главного квантового числа n указывать перед условным обозначением квантового числа l . Поэтому электрон с n = 3 при l = 1 обозначают символами 3p .
Поскольку l < n возможны следующие состояния:
2s 2p
3s 3p 3d
4s 4p 4d 4f и т.д.
Как и в теории Бора, в квантовой механике предполагается, что испускание и поглощение света происходит при переходе электрона с одного уровня на другой. Однако фотон обладает собственным моментом импульса равным приблизительно Поэтому при испускании или поглощении фотона момент импульса атома должен обязательно измениться на Об этом говорят, что при переходах электрона между энергетическими уровнями в атоме должно выполняться правило отбора для азимутального квантового числа:
Очевидно, что это правило есть просто следствие закона сохранения момента импульса.
Схема энергетических уровней атома водорода.
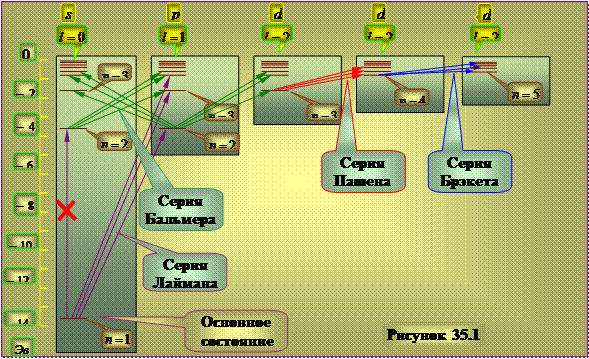 |
Действие правила отбора (35.6) приводит к тому, что не все переходы между энергетическими уровнями действительно могут реализоваться. Например переход из состояния 2s в 1s не может произойти, поскольку противоречит правилу отбора. В связи с этим схему энергетических уровней электрона в атоме водорода можно представлять так, как это показано на рисунке 35.1
Состояние 1s является основным состоянием атома водорода , в котором атом водорода обладает минимальной энергией. Фотон при поглощении его атомом исчезает полностью, передавая атому свою энергию, поскольку является неделимым. Поглощающий атом обычно находится в основном состоянии, поэтому спектр поглощения водородного атома должен состоять из линий, соответствующим переходам 1s-np , что полностью соответствует результатам экспериментов.
Электрон в атоме водорода
Собственные функции уравнения Шрёдингера для атома водорода распадаются на два множителя, один из которых зависит только от r , а другой от углов J и j.
Множитель вещественный, - мнимый. Функция является собственной функцией оператора квадрата момента импульса. Для s -состояний электрона (т.е. с моментом импульса равным нулю) эта функция является константой, и -функции вида зависят только от r .
Элемент объема dV сферической системе координат можно представить в виде
![]()
где d W = есть элемент телесного угла.
Вероятность dP нахождения электрона в элементе dV
Взяв интеграл от (35.7) по телесному углу 4p , найдем вероятность нахождения электрона в тонком шаровом слое радиуса r и толщины dr: .
![]() (35.9)
(35.9)
Поскольку Y предполагаются нормированными, интеграл в (35.9) равен единице, и
![]() (35.10)
(35.10)
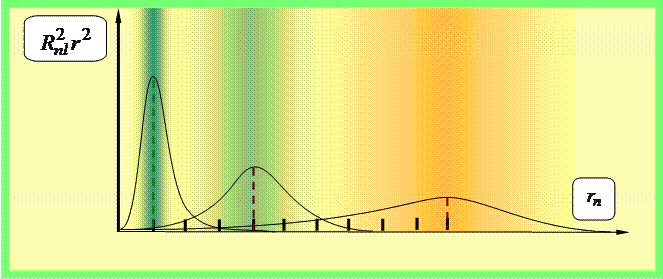
Из (35.9) вытекает, что есть плотность вероятности нахождения электрона на расстоянии r от ядра ,
Длинными вертикальными черточками показаны радиусы соответствующих боровских орбит.
Рисунок 35.1
Спектры щелочных металлов
Эти спектры похожи на спектр испускания атома водорода, но только качественно. Наблюдается несколько серий линий и наиболее интенсивные из них получили названия на основе наблюдаемых экспериментально особенностей:
резкая (sharp) – линии этой серии выглядели очень четкими и узкими.
главная (principal) – линии этой серии наблюдались и в спектрах поглощения и спектрах испускания, что указывало, что они соответствуют переходу атомав в основное состояние;
размытая (diffuse) – линии этой серии выглядели размытыми, нечеткими;
основная (fundamental) – линии этой серии напоминали серии линий атома водорода.
Установлено, что рассмотренные серии линий связаны с переходами внешнего (валентного) или оптического электрона .
Система энергетических уровней, соответствующих испусканию указанных линий для атома натрия имеет вид, приблизительно показанный на рисунке 35.3.
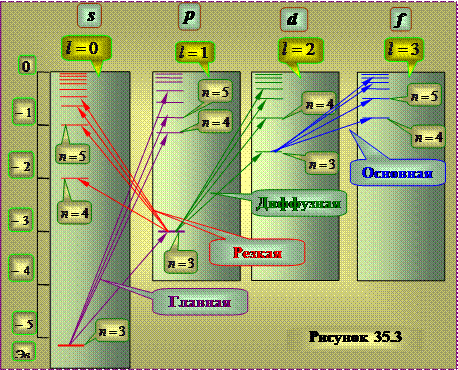 В отличие от атома водорода, энергия состояния оказывается зависящей не только от значения квантового числа n, но и от номера ряда термов.
Ряды термов, как и в атоме водорода соответствуют различным значениям азимутального квантового числа l
.
В отличие от атома водорода, энергия состояния оказывается зависящей не только от значения квантового числа n, но и от номера ряда термов.
Ряды термов, как и в атоме водорода соответствуют различным значениям азимутального квантового числа l
.
Эти выводы соответствуют результатам квантовомеханических расчетов – решению уравнения Шредингера для электрона, движущегося в центрально-симметричномнекулоновском поле. Поле ядра в атомах щелочных металлов частично экранируется электронами внутренних электронных оболочек атомов. При этом поле сохраняет сферическую симметрию, но от от расстояния до ядра изменяется по закону, отличному от закона Кулона. В таком поле энергия электрона оказывается зависящей от квантового числа: Об этом принято говорить, что снимается вырождение по азимутальному квантовому числа . Однако, в основном энергия зависит все же от главного квантового числа n .
Установлено, что момент импульса атомного остатка щелочных атомов после удаления оптического электрона равен нулю . Следовательно, азимутальное квантовое число L результирующего момента импульса атома совпадает с азимутальным квантовым числом валентного электрона . При возбуждении атома (т.е. при переводе некоторым воздействием из состояния с минимальной энергией в состояние с большей энергией) и при испускании им света изменяется состояние только валентного электрона , поэтому схема уровней атома тождественна схеме уравнения валентного электрона.
Термы, отвечающие столбцам уровней, на схеме энергетических уровней можно обозначить символами nS , nP , nD и nF . Тогда частоты спектральных линий, равные разности термов конечного и начального состояний можно представить в следующем виде: возбужденные состояния нельзя считать строго стационарными. В силу того, что время и энергия являются канонически сопряженными величинами, соотношение неопределенностей определяет конечную ширину Г энергетических уровней:
Только основное состояние не допускает спонтанных переходов и его энергия имеет строго определенное значение.
В соответствии с конечным Г, интервал частот излучаемых фотонов
Для видимого света с соответствующее ![]() Это так называемая естественная ширина спектральной линии
.
Это так называемая естественная ширина спектральной линии
.
Тепловое движение атомов приводит к доплеровскому расширению спектральных линий. При этом для излучения с длиной волны при температуре Т
= 1000 К получается значение ![]() , которое во много раз превосходит естественную ширину спектральных линий.
, которое во много раз превосходит естественную ширину спектральных линий.
Энергия атома водорода, как следует из (6), определяется только главным квантовым числом n . Самый нижний уровень энергии Е 1 , соответствующий n =1,отвечает минимально возможной энергии атома и называется основным. Все остальные уровни энергии Е n (Е n > Е 1 , n = 2,3,..) называются возбужденными. Схема энергетических уровней атома водорода с графиком зависимости потенциальной энергии U(r) от расстояния до ядра приведена на рис. 2. При отрицательных значениях энергии (Е<0) движение электрона является связанным. По мере роста главного квантового числа n уровни располагаются теснее и при n → ∞ E ∞ =0.
При положительных значениях энергии движение электрона является свободным, область непрерывного спектра Е > 0 (на рис. 2 заштрихована) соответствует ионизованному атому. Энергия ионизации атома водорода

Схема энергетических уровней атома водорода (рис. 2а) и переходов
между ними (рис. 2б). [Е] - эВ.
Заданному значению энергии, кроме Е 1 , соответствует несколько различных состояний атома, отличающимися значениями квантовых чисел l и m . Условно значения с l = 0, 1, 2,… обозначаются латинскими буквами s, p, d, f,… Значение главного квантового числа указывается цифрой перед обозначением орбитального квантового числа. Например, электроны в состоянии n = 1 и l = 0 обозначаются 1s, в состоянии n = 2 и l = 0, 1- соответственно 2s и 2р; с n =3 - 3s, 3р, 3d и т. д.
С учетом различных значений квантовых чисел n и l общепринятой является схема изображения энергетических уровней, приведенная на рис. 3.

Схема энергетических уровней атома водорода и переходов между ними с учетом орбитального квантового числа l .
Излучение и поглощение света атомом происходит при переходе электрона с одного энергетического уровня на любой другой, причем, энергия излучаемого (поглощаемого) кванта равна:
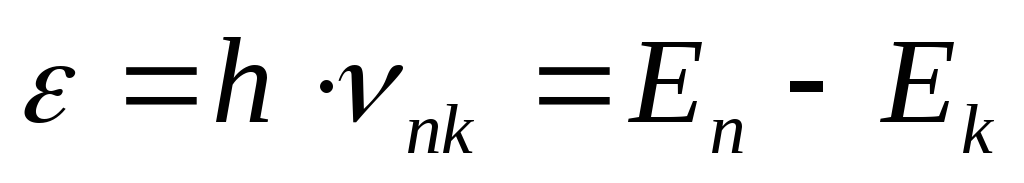 (18)
где n
,
k
– соответственно
номера энергетических уровней (состояний),
ν – частота электромагнитного излучения
перехода n
→
k
.
В процессе излучения (поглощения) света
могут осуществляться только такие
переходы, в результате которых изменения
орбитального и магнитного квантовых
чисел определяются условиями:
(18)
где n
,
k
– соответственно
номера энергетических уровней (состояний),
ν – частота электромагнитного излучения
перехода n
→
k
.
В процессе излучения (поглощения) света
могут осуществляться только такие
переходы, в результате которых изменения
орбитального и магнитного квантовых
чисел определяются условиями:
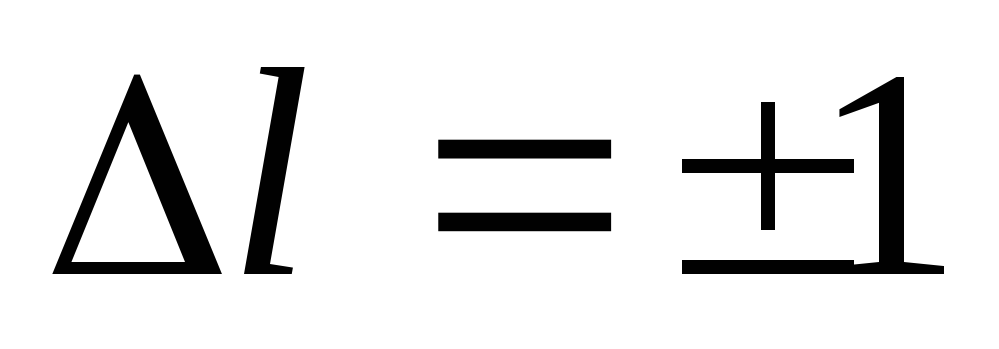 (19)
(19)
 (20)
(20)
Формулы (19) и (20) называются правилами отбора, которые ограничивают число возможных переходов электрона в атоме.
С учетом (6) частота излучения при переходе атома водорода (Z = 1) из стационарного состояния n в стационарное состояние k с меньшей энергией равна:
 (21)
(21)
Где k , n –целые числа; k < n .
Так как
 ,
то формула (21) по определению длин волн
соответствующих переходов приобретает
вид:
,
то формула (21) по определению длин волн
соответствующих переходов приобретает
вид:
 (22)
(22)
Где R –постоянная Ридберга, равная
 (23)
(23)
Из выражений (21) и (22) вытекает, что при заданных k и меняющихся значениях n (n >k ) спектральные линии образуют группы или серии. В спектре излучения атома водорода, как следует из (22), выделены следующие серии, длины волн которых находятся по формулам:
Серия Лаймана (ультрафиолетовая область спектра):
 ,
где n
=2,3,4,…
(24)
,
где n
=2,3,4,…
(24)
 (24
a)
(24
a)
Серия Бальмера (видимая область спектра):
 ,
где n
=
3,4,5,…
(25)
,
где n
=
3,4,5,…
(25)
Серия Пашена (инфракрасная область спектра):
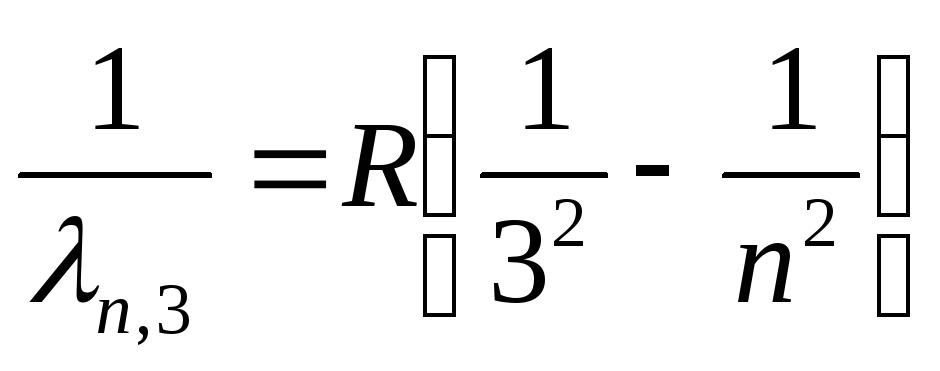 ,
где n
=
4,5,6,…
(26)
,
где n
=
4,5,6,…
(26)
Серия Брекета (далекая инфракрасная область спектра):
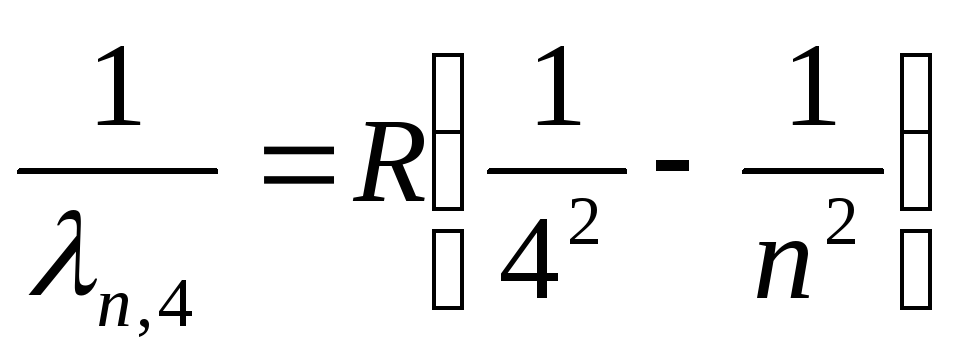 ,
где n
=5,6,7,…
(27)
,
где n
=5,6,7,…
(27)
Формулы (24а)- (27а) в соответствии с правилами отбора (19) определяют состояния электрона, при переходе между которыми излучаются спектральные линии приведенных серий в атоме водорода. Для серий Лаймана и Бальмера они указаны на рис. 3 полностью.
Следует отметить, что формулы (21)-(22), полученные теоретически в квантовой механике для расчета длин волн (частот) спектральных линий атома водорода, совпадают с обобщенной формулой Бальмера (1), ранее полученной эмпирически путем обобщения экспериментальных данных.
Атом водорода
Hydrogen Atom
Атом водорода
– связанная система, состоящая из положительно заряженного ядра – протона
и отрицательного заряженного электрона.
Размеры атома определяются размерами его электронной оболочки
≈ 10 -8 см.
Энергии связанных состояний электрона получаются при решении
уравнения Шредингера с потенциалом V(r) = -e 2 /r
и определяются соотношением
где n – главное квантовое число, определяющее энергии различных состояний
электрона в атоме водорода (n = 1, 2, 3…), R - постоянная Ридберга
(R = 1.0974·10 5 см -1).
Каждому уровню с главным квантовым числом n соответствует n состояний,
различающихся квантовыми числами l = 0, 1, 2, …, (n-1). Такое вырождение
уровней по энергии характерно только для кулоновского поля. Кроме того,
каждое из этих вырожденных по l состояний (2l+1)-кратно вырождено по магнитному
числу
m = ±l, ±(l-1),...±1, 0. Таким образом, полная кратность вырождения
стационарного квантового состояния с главным квантовым числом n дается соотношением
.
Такое рассмотрение справедливо при условии, что спин электрона
равен нулю. Так как электрон имеет спин s = 1/2, полный момент количества
движения
электрона
будет определяться векторной суммой его орбитального
и спинового
моментов
=
+
.
Так как спин электрона s = 1/2, его полный момент количества
движения J может быть только полуцелым.
При заданном значении орбитального
момента l в атоме водорода возможно два состояния, различающихся значениями
полного момента
=
+
= l
+ 1/2 и
j = l - s = l - 1/2. Эти два значения различаются взаимными ориентациями
орбитального и спинового векторов. Энергии электрона в состояниях l + 1/2
и l - 1/2 в кулоновском поле протона несколько отличаются, и вырождение
по энергии состояний снимается. Это дополнительное взаимодействие носит
название спин-орбитального. С учетом снятия вырождения спектр низколежащих
состояний атома водорода обогащается, происходит тонкое расщепление уровней
энергий. Вместо двух низших уровней водорода без учета спин-орбитального
расщепления (основного 1s и первого возбужденного 2s2p (рис. 1, а)) с учетом
спин-орбитального расщепления их становится четыре (рис. 1, б). Квантовые
характеристики этих уровней даны в таблице. Уровень с большим значением
j = l + 1/2 расположен выше по энергии, чем уровень с j = l - 1/2. Состояния
с различными значениями l, но одним и тем же значением nj оказываются по-прежнему
вырожденными. Например, 2s 1/2 и 2p 1/2 .
Квантовые характеристики электрона в самых нижних
состояниях атома водорода
| n | l | s | j = l ± s | обозначение уровней |
| 1 | 0 | 1/2 | 1/2 | 1s 1/2 |
| 2 | 0 1 |
1/2 1/2 |
1/2 1/2, 3/2 |
2s 1/2 2p 1/2 , 2p 3/2 |
| 3 | 0 1 2 |
1/2 1/2 1/2 |
1/2 1/2, 3/2 3/2, 5/2 |
3s 1/2 3p 1/2 , 3p 3/2 3d 1/2 , 3d 3/2 |
Из точного решения релятивистского уравнения Дирака для электрона со спином s = 1/2 следует зависимость энергии уровней атома водорода от квантовых чисел n и j
 ,
,
где α = 1/137 - постоянная тонкой структуры. Поправка в E nj не зависит от квантового числа l. Поэтому энергии состояний с одинаковыми j и разными l должны быть равны. Величина тонкого расщепления уровней δE j+1,j при данном n определяется соотношением
Величина расщепления уровня с n = 2 составляет ≈ 4.5·10 -5
эВ.
Ядро атома водорода – протон - также имеет собственный момент
– спин s = 1/2. Это тоже слегка изменяет взаимодействие электрона с протоном,
так как возникает дополнительное взаимодействие магнитного момента протона,
вызванного наличием у него спина, с магнитным полем электрона. Величина
этого взаимодействия зависит от взаимной ориентации спинового момента протона
и полного момента электрона. Таким образом, возникает еще один тип расщепления
уровней атома, называемого сверхтонким, так как его величина существенно
меньше тонкого расщепления. Сверхтонкое расщепление будет наблюдаться уже
для основного состояния
(n = 1, l = 0). Переход между двумя подуровнями
сверхтонкого расщепления основного состояния водорода приводит к излучению
с длиной волны λ = 21 см (частота излучения 1420 МГц). С помощью этого излучения
обычно регистрируется межзвездный водород во Вселенной.
Состояния от n = 2 до n = ∞ называются возбужденными состояниями.
Энергия возбуждения E возб (энергия, которую необходимо сообщить
системе, чтобы она перешла из начального состояния n i в конечное
состояние n f) определяется из соотношения

Все состояния от n = 1 до n = ∞ являются связанными состояниями, так
как имеют отрицательные энергии. При приближении n к бесконечности энергии
состояний сближаются, и разница в энергиях соседних состояний становится
настолько мала, что расщепленные уровни сливаются, и дискретный спектр уровней
трансформируется в непрерывный (сплошной). Когда энергия электрона становится
положительной (E > 0), система превращается в несвязанную и электрон становится
свободным. Спектр энергий свободного электрона непрерывный.
Переходы из состояний n = 2, 3, … ∞ в состояние n = 1 образуют
серию Лаймана. Переходы из состояния n = 3, 4, … ∞ в состояние n = 2 – серию
Бальмера. Переходы между состояниями с отрицательной энергией (E < 0) приводят
к образованию дискретного спектра переходов, в то время как переходы между
состояниями с E > 0 и состояниями с E < 0 дают непрерывный спектр переходов.
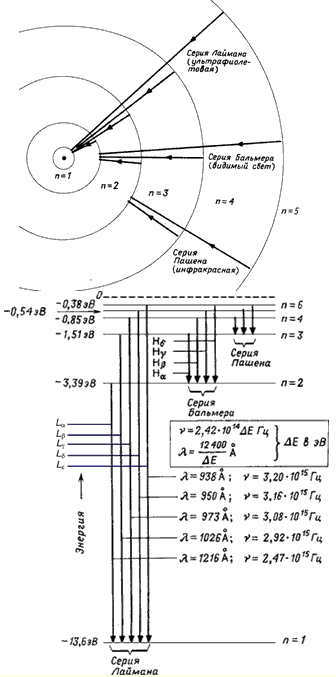
Рис. 2. Схема уровней атома водорода.
Согласно точному решению уравнения Дирака, уровни
энергии с одинаковым значением квантового числа n = 1, 2, 3,... и одинаковым
значением полного момента
j = 1/2, 3/2,... должны совпадать по энергии независимо
от значения квантового числа l. В 1947 г.
У.
Лэмб и Р. Ризерфорд обнаружили сдвиг уровней 2s 1/2
и 2p 1/2 в атоме водорода. Этот сдвиг уровней называется
лэмбовским сдвигом
. Основная причина
лэмбовского сдвига обусловлена радиационными поправками:
- Испусканием связанным электроном виртуальных фотонов.
- Поляризацией вакуума - рождением в вакууме электрон-позитронных пар.
Эти две поправки полностью объясняют наблюдаемую величину
лэмбовского сдвига уровней 2s 1/2 и 2p 1/2 (ΔE
= 4.5·10 -6 эВ).
Вероятность dw нахождения электрона в объеме dV в определенном
месте пространства определяется выражением
dw = |ψ(x, y, z)|2 dV = |R nl (r)Y lm (θ,φ)| 2 r 2 sinθdθdφdr
=
= |R nl (r)| 2 r 2 |Y lm (θ,φ)| 2 sinθdθdφdr,
распадается на радиальную вероятность ||R nl (r)| 2 r 2 | 2 r 2 dr и угловую - |Y lm (θ,φ)| 2 dΩ. Распределения этих вероятностей даны на рис. 3–5.
Предположим, что схема нижних энергетических уровней атомов некоего элемента имеет вид, показанный на рисунке, и атомы находятся в состоянии с энергией Электрон, столкнувшись с одним из таких покоящихся атомов, в результате столкновения получил некоторую дополнительную энергию. Импульс электрона после столкновения с атомом оказался равным Определите кинетическую энергию электрона до столкновения. Возможностью испускания света атомом при столкновении с электроном пренебречь. Эффектом отдачи пренебречь.
Решение.
p электрона связан с его кинетической энергией соотношением или где m — масса электрона.
Следовательно,
Гость
18.05.2012 17:00
Объясните пожалуйста, почему электрон перешёл в состояние Е(0) и почему эту энергию (3,5 эВ) мы прибавляем к энергии электрона?
Гость
Добрый день!
По постулатам Бора, атом может находиться только в строго определенных состояниях. При столкновении атома и электрона выполняется закон сохранения энергии. По условию, энергия электрона увеличилась, а значит, энергия атома должна была уменьшиться. Так как атом находится на первом энергетическом уровне, единственный способ для него уменьшить свою энергию - перейти на нулевой уровень. При этом его энергия уменьшается на Поскольку вероятностью излучения можно пренебречь, согласно условию, а величиной кинетической энергии отдачи ядра пренебречь в силу ее малости, заключаем, что вся эта энергия передается электрону.
Виталий
22.03.2016 07:54
Здравствуйте!
В задаче 3045 по физике есть несколько вопросов:
1) Правильно ли я понимаю, что в системе опосредованно говорится о 2-ух электронах? Один - в поле центральных сил ядра. Второй - свободный электрон пролетающий мимо атома и условно с ядром не взаимодействующий никогда, а с «атомным» электроном – только в момент передачи импульса?
2) Если на первый вопрос ответ "да", то схема "энергетических уровней атома" - это допустимые уровни энергий связанного, «атомного», электрона?
3) Правильно ли, что подлетающий электрон находится на уровне E(бесконечность) или выше?
4) Пролетающий электрон провзаимодействовав с эл. в атоме не был захвачен? Он улетает с ещё большей энергией?
5) К какому типу энергии можно отнести энергию пролетающего электрона (кинетическая и т.д.) в момент его подлёта к атому?
После ответов на эти вопросы я смогу определиться есть в задаче ошибка или нет. Извините что пишу здесь, в КНР есть проблемы с доступом в VK.
Антон
1) Нет, в задаче говорится об атоме и свободном электроне.
2) В данной задаче не нужно рассматривать вклады электронов атома и его ядра в энергетические уровни атома. Атом рассматривается как единый объект с заданным спектром энергий.
3) Свободный электрон не является частью атома, не корректно его энергию помещать на схему энергетических уровней атома (его энергию можно изобразить рядом). Если говорить о возможном спектре кинетических энергий свободного электрона, то он континуальный (не дискретный): В данной задаче кинетическая энергия свободного электрона до столкновения была 1,45 эВ, и 4,95 эВ после.
4) Электрон взаимодействовал с атомом в целом и получил от него порцию энергии.
5) Кинетическая.
Предположим, что схема нижних энергетических уровней атомов некоего элемента имеет вид, показанный на рисунке, и атомы находятся в состоянии с энергией Электрон, столкнувшись с одним из таких атомов, в результате столкновения получил некоторую дополнительную энергию. Кинетическая энергия электрона до столкновения равнялась Определите импульс электрона после столкновения с атомом. Возможностью испускания света атомом при столкновении с электроном пренебречь, до столкновения атом считать неподвижными.
Решение.
Если при столкновении с атомом электрон приобрел энергию, то атом перешел в состояние Следовательно, после столкновения кинетическая энергия электрона стала равной где — энергия электрона до столкновения; отсюда: Импульс p электрона связан с его кинетической энергией соотношением где m — масса электрона.
Следовательно,
Ответ:
На рисунке изображены энергетические уровни атома и указаны длины волн фотонов, излучаемых и поглощаемых при переходах с одного уровня на другой. Какова длина волны фотонов, излучаемых при переходе с уровня на уровень если ?
Решение.
Частота фотона, испускаемого или поглощаемого атомом при переходе с одного уровня энергии на другой, пропорциональна разности энергий этих уровней. Поэтому имеем:
Отсюда (так как ):
На рисунке представлены энергетические уровни электронной оболочки атома и указаны частоты фотонов, излучаемых и поглощаемых при переходах с одного уровня на другой. Какова длина волны фотонов, поглощаемых при переходе с уровня на уровень если
Решение.
Частота фотона, испускаемого или поглощаемого атомом при переходе с одного уровня энергии на другой, пропорциональна разности энергий этих уровней:
Поэтому запишем: Отсюда:
Ответ:
На рисунке изображены несколько энергетических уровней атома и указаны длины волн фотонов, излучаемых и поглощаемых при переходах с одного уровня на другой.
Экспериментально установлено, что минимальная длина волны для фотонов, излучаемых при переходах между этими уровнями, равна Какова величина если ?
Решение.
Минимальная длина волны соответствует максимальной частоте и энергии фотона. То есть и
Частота фотона, испускаемого или поглощаемого атомом при переходе с одного уровня энергии на другой, пропорциональна разности энергий этих двух уровней. Поэтому
Уровни энергии электрона в атоме водорода задаются формулой где . При переходе атома из состояния в состояние атом испускает фотон. Попав на поверхность фотокатода, фотон выбивает фотоэлектрон. Длина волны света, соответствующая красной границе фотоэффекта для материала поверхности фотокатода, Чему равна максимально возможная кинетическая энергия фотоэлектрона?
Решение.
Согласно постулатам Бора, свет излучается при переходе атома на более низкие уровни энергии, при этом фотоны несут энергию, равную разности энергий начального и конечного состояний. Таким образом, испущенный фотон имел энергию
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Сибирь. Вариант 1.
ЭВ, где . При переходе атома из состояния в состояние атом испускает фотон. Попав на поверхность фотокатода,этот фотон выбивает фотоэлектрон. Частота света, соответствующая красной границе фотоэффекта для материала поверхности фотокатода, Гц. Чему равен максимально возможный импульс фотоэлектрона?
Решение.
Согласно уравнению фотоэффекта, максимальная кинетическая энергия вылетающих фотоэлектронов связана с энергией фотона и работой выхода соотношением
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Сибирь. Вариант 2.
Уровни энергии электрона в атоме водорода задаются формулой эВ, где . При переходе атома из состояния в состояние атом испускает фотон. Попав на поверхность фотокатода,этот фотон выбивает фотоэлектрон. Длина волны света, соответствующая красной границе фотоэффекта для материала поверхности фотокатода, Чему равен максимально возможный модуль импульса фотоэлектрона?
Решение.
Согласно постулатам Бора, свет излучается при переходе атома на более низкие уровни энергии, при этом фотоны несут энергию, равную разности энергий начального и конечного состояний. Таким образом, испущенный фотон имел нес энергию
Согласно уравнению фотоэффекта, максимальная кинетическая энергия вылетающих фотоэлектронов связана с энергией фотона и работой выхода соотношением
Работа выхода связана с длиной волны красной границы соотношением:
Таким образом, максимально возможный импульс фотоэлектрон равен
Источник: ЕГЭ по физике 06.06.2013. Основная волна. Сибирь. Вариант 3.
Уровни энергии электрона в атоме водорода задаются формулой
эВ, где . При переходе атома из состояния в состояние атом испускает фотон. Попав на поверхность фотокатода,этот фотон выбивает фотоэлектрон. Частота света, соответствующая красной границе фотоэффекта для материала поверхности фотокатода, Гц. Чему равна максимальная возможная кинетическая энергия фотоэлектрона?
Решение.
Согласно постулатам Бора, свет излучается при переходе атома на более низкие уровни энергии, при этом фотоны несут энергию, равную разности энергий начального и конечного состояний. Таким образом, испущенный фотон имел нес энергию
Согласно уравнению фотоэффекта, максимальная кинетическая энергия вылетающих фотоэлектронов связана с энергией фотона и работой выхода соотношением
Работа выхода связана с частотой красной границы соотношением:
Таким образом, максимально возможная кинетическая энергия фотоэлектрон равна






