Тепловая энтропия. Энтропия. Второе начало термодинамики. Тепловые и холодильные машины. Цикл Карно и его коэффициент полезного действия
Основными процессами в термодинамике являются:
· изохорный , протекающий при постоянном объеме;
· изобарный , протекающий при постоянном давлении;
· изотермический , происходящий при постоянной температуре;
· адиабатный , при котором теплообмен с окружающей средой отсутствует.
Изохорный процесс
Если обратный механический процесс, такой как движение маятника или столкновение бильярдных шаров, снимается на видео, а затем возвращается назад, изображение будет выглядеть вполне правдоподобным. В то же время необратимые процессы, сопровождающие подъем энтропии, говорят, что сжигание бенгальского огня, ржавление гвоздя, при таком просмотре представляется маловероятным. Таким образом, энтропия позволяет отличать прошлое от будущего.
Устройство, которое показывает величину энтропии, не существует. В то же время можно вычислить энтропию или ее изменение. Здесь у нас есть эта реакция, где, если у нас есть один мольный метан и он реагирует с двумя молями кислорода, мы произведем один моль двуокиси углерода и два моля воды. В этом видео мы хотим ответить на вопрос, является ли эта реакция спонтанной. И в последнем клипе мы узнали, что для того, чтобы ответить на этот вопрос, мы должны обратиться к свободной энергии Гиббса или, более конкретно, к изменению свободной энергии Гиббса.
При изохорном процессе выполняется условие V = const.
Из уравнения состояния идеального газа (p V = RT) следует:
p / T = R / V = const,
т. е. давление газа прямо пропорционально его абсолютной температуре:
p 2 / p 1 = T 2 / T 1 .
Изменение энтропии в изохорном процессе определяется по формуле:
И изменение свободной энергии равно изменению энтальпии реакции за вычетом температуры, при которой оно происходит, а все умножается на изменение энтропии. И если оно меньше нуля, то возникает спонтанная реакция. Мы сделали это несколько клипов назад. Вы можете посмотреть только температуру, вызванную каждым из этих продуктов. Вода умножит его на 2, если у него 2 месяца. Таким образом, у нас есть тепло, образованное из этих продуктов, мы удаляем то же самое из других реагентов. И это говорит о том, что мы имеем экзотермическую реакцию.
То, что эта сторона уравнения содержит меньше энергии - мы можем как-то подумать об этом - с этой стороны. Так мало энергии нужно освободить. Позвольте мне написать, а также энергию, которая будет выпущена. Вот почему это экзотермическая реакция. Но наш вопрос: спонтанна? Чтобы выяснить, спонтанно ли это, нам нужно найти наши дельты. И чтобы помочь нам найти дельты, со временем мы рассмотрели стандартную молярную энтропию для каждой из этих молекул. Стандартом здесь является добавление нулевого символа - стандартная молярная энтропия - и «стандарт» означает 298 градусов Кельвина.
s 2 – s 1 = Δs = c v ln (p 2 / p 1 ) = c v ln (T 2 / T 1 )
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const.
Из уравнения состояния идеального газа следует:
V / T = R / p = const.
Изменение энтропии будет равно:
s 2 – s 1 = Δs = c p ln (T 2 / T 1 ).
На самом деле, мне не нужно говорить о градусах Кельвина. Это 298 Кельвина, здесь не нужно употреблять слово «градусы», когда мы говорим о Кельвине. Таким образом, это составляет 298 кельвинов, что составляет 25 градусов по Цельсию, поэтому это комнатная температура. Поэтому считается стандартной температурой. Поэтому, если у нас есть 1 моль метана, у нас есть 186 джоулей энтропии Кельвина. Таким образом, полное изменение энтропии этой реакции представляет собой разницу полной стандартной энтропии продуктов и полной стандартной энтропии реагентов.
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
p V = RT = const
Изменение энтропии равно:
s 2 – s 1 = Δs = R ln(p 1 /p 2 ) = R ln(V 2 / V 1 ).
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происходит без теплообмена с окружающей средой (Q = 0).
То же самое мы сделали с энтальпией. И поскольку мы уже видели это, это число близко к этому числу, но это намного больше. Чистая вода намного ниже - это энтропия чистой воды. Он имеет гораздо меньшую энтропию, чем кислородный газ. Поскольку жидкость сформировалась, состояний очень мало. Вся жидкость попадает на дно контейнера, как будто она принимает форму и расширяется. Другими словами, один газ будет иметь гораздо более высокую энтропию, чем жидкость. Просто взглянув на это, мы уже можем видеть, что наши продукты будут иметь более низкую энтропию, чем реагенты.
Уравнение кривой адиабатного процесса (адиабаты) в p- V диаграмме имеет вид:
p V k = const.
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
Изменение энтропии равно:
ΔS = S 2 – S 1 = 0, т.е. S 2 = S 1 .
И это, вероятно, будет отрицательным числом. Теперь эти единицы могут не иметь смысла для вас, и вы действительно знаете, что это условные единицы. Но мы можем сказать, эй, это становится все сложнее. И есть какой-то смысл, потому что присутствует тонна газа. У нас есть 3 отдельные молекулы, 1 здесь и 2 молекулы кислорода. И снова мы переходим к 3 молекулам, но теперь вода ясна. И это имеет смысл, на мой взгляд, в потере энтропии. Есть несколько условий, в которых жидкость, прежде всего, может быть.
Но давайте выясним, является ли эта реакция спонтанной. Мы не должны быть настолько точными. Мы предполагаем, что мы находимся при комнатной температуре, или 298 градусов Кельвина. Что составляет 25 градусов по Цельсию, умноженное на изменение энтропии. Это будет минус. Теперь мы можем сказать, ну, минус 242, мы можем захотеть поместить его туда. Но мы должны быть очень, очень, очень осторожны. И если мы хотим написать все в килоджоулях после того, как мы уже записали это, давайте запишем его в килоджоулях.
Фазовые переходы
При обратимом фазовом переходе температура остается постоянной, а теплота фазового перехода при постоянном давлении равна H фп, поэтому изменение энтропии равно:
 .
.
При плавлении и кипении теплота поглощается, поэтому энтропия в этих процессах возрастает: S тв < S ж < S г. При этом энтропия окружающей среды уменьшается на величину S ф.п. , поэтому изменение энтропии Вселенной равно 0, как и полагается для обратимого процесса в изолированной системе.
Таким образом, наша свободная энергия Гиббса здесь будет минус 890 килоджоулей минус 290, из которых минус здесь и еще минус плюс плюс. И это имеет смысл - энтропия сделает гиббсскую энергию более положительной. Который, как мы знаем, когда мы хотим получить это здесь ниже 0, он будет сражаться с спонтанностью. Но давайте посмотрим, можно ли превзойти фактическую энтальпию, ее экзотермический характер. Это кажется возможным, потому что мы умножаем долю с этим, и мы получим меньше. Это наше изменение энтропии, умноженное на 298, температура минус.
И это понятие становится - ставит минус там - и становится плюсом 72, Это энтропия при стандартной температуре. Мы уже можем видеть, что энтальпия является гораздо более отрицательным числом, чем положительный температурный член, умноженный на изменение энтропии. Итак, на этот раз победитель. И хотя мы теряем энтропию в этой реакции, она выделяет так много энергии, которая будет спонтанной. Который определенно меньше 0, так что будет спонтанная реакция. Как мы видим, эти задачи свободной энергии Гиббса не так сложны.
Второе начало термодинамики и «тепловая смерть Вселенной»
Клаузиус, рассматривая второе начало термодинамики, пришёл к выводу, что энтропия Вселенной как замкнутой системы стремится к максимуму, и в конце концов во Вселенной закончатся все макроскопические процессы. Это состояние Вселенной получило название «тепловой смерти» – общемирового хаоса, в котором невозможен более никакой процесс. С другой стороны, Больцман высказал мнение, что нынешнее состояние Вселенной – это гигантская флуктуация, из чего следует, что большую часть времени Вселенная все равно пребывает в состоянии термодинамического равновесия («тепловой смерти»).
Вам просто нужно найти эти размеры. Мы просто смотрим на температуры образования всех продуктов, мы вынимаем реагенты, и, конечно, мы ждем шансов. И затем, чтобы найти изменения в энтропии, мы делаем то же самое. Мы должны посмотреть на стандартную молярную энтропию по массе продуктов по коэффициентам, удалить реагенты, а затем просто заменить ее здесь, после чего мы по существу получили свободную энергию Гиббса. И в этом случае она была отрицательной. Теперь мы можем представить себе ситуацию, когда мы находимся на гораздо более высокой температуре.
По мнению Ландау, ключ к разрешению этого противоречия лежит в области общей теории относительности: поскольку Вселенная является системой, находящейся в переменном гравитационном поле, закон возрастания энтропии к ней неприменим.
Поскольку второе начало термодинамики (в формулировке Клаузиуса) основано на предположении о том, что Вселенная является замкнутой системой, возможны и другие виды критики этого закона. В соответствии с современными физическими представлениями мы можем говорить лишь о наблюдаемой части Вселенной. На данном этапе человечество не имеет возможности доказать ни то, что Вселенная есть замкнутая система, ни обратное.
Тогда неожиданно все становится интересным. Таким образом, этот положительный член будет превышать этот и, возможно, не спонтанную реакцию на очень, очень, очень, очень высокую температуру. И иначе подумайте об этом. Реакция, которая производит температуру, которая отделяется - выделяемая теплота, не настолько велика, когда в середине уже имеется большое количество тепла или кинетической энергии. Если бы температура была достаточно высокой, эта реакция не была бы спонтанной, так как вероятность энтропии превзошла бы.
Вы можете посмотреть все в Интернете и узнать, что-то самопроизвольно. При одновременном изменении двух или трех указанных величин происходит газовый процесс. Идеальный газ - это модель физического газа, в которой сделаны следующие приближения. Реальные газы не отличаются по свойствам от идеального газа при комнатной температуре и нормальном атмосферном давлении. Различия важны при очень низких температурах и давлениях, в сотни раз превышающих атмосферные.
Измерение энтропии
В реальных экспериментах очень трудно измерить энтропию системы. Техники измерения базируются на термодинамическом определении энтропии и требуют экстремально аккуратной калориметрии.
Для упрощения мы будем исследовать механическую систему, термодинамические состояния которой будут определены через её объем V и давление P . Для измерения энтропии определенного состояния мы должны сперва измерить теплоёмкость при постоянных объёме и давлении (обозначенную C V и C P соответственно), для успешного набора состояний между первоначальным состоянием и требуемым.
В указанных условиях можно выполнить три изоизомера, изотермические и изобарические. Законы изоляции применимы к реальным газам, которые отвечают требованиям идеальной модели газа. Закон был впервые представлен британцем Робертом Бойлом и французом Эдмом Маррио. В изотермическом процессе произведение давления и объема определенного количества газа является постоянной величиной. График процесса на р-диаграмме представляет собой кривую, называемую изотермой.
Закон был вынесен французом Жаком Чарльзом. В процессе изоляции отношение давления к температуре остается постоянным. График процесса на р-диаграмме представляет собой прямую линию, называемую изохорой. Анимация показывает цикл, включающий два процесса при постоянном давлении и два процесса непрерывного объема. Горизонтальные стороны прямоугольника - прямые линии - изображения и вертикальные стороны - прямые линии - изохори. Поведение газов в изократическом процессе легко объясняет запрет не оставлять флаконы и газовые баллоны под прямыми солнечными лучами.
Тепловые ёмкости связаны с энтропией S и с температурой T согласно формуле:

где нижний индекс X относится к постоянным объёму и давлению. Мы можем проинтегрировать для получения изменения энтропии:
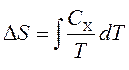
Закон был выдан француз Джозеф Гаусс-Лусак. В измененном процессе отношение объема к температуре остается постоянным. График процесса на р-диаграмме представляет собой прямую линию, которая называется изображением. Законы Бойля-Марриотта, Чарльза и Гей-Лусака - только идеальный газ. Модель идеального газа не учитывает объем и взаимодействие молекул.
При очень низких температурах фактические газы сжижаются и законы идеального газа для них перестают применяться. В качестве меры необратимой диссипации энергии Клаузиус ввел термин энтропия. Энтропия - это функция состояния системы, то есть в каждом состоянии можно сравнить полностью определенное значение энтропии.
Таким образом, мы можем получить значение энтропии любого состояния (P ,V ) по отношению к первоначальному состоянию (P 0 ,V 0). Точная формула зависит от нашего выбора промежуточных состояний. Для примера, если первоначальное состояние имеет такое же давление, как и конечное состояние, то
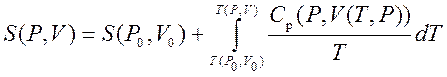 .
.
Например, для обратимых процессов его изменение выражается следующим образом. Изменение энтропии в разных процессах в системах. Энтропия - это мера вероятности или беспорядка в физической системе. Он выражает количество возможных конфигураций или договоренностей составных элементов системы, в которых ее общий вид, формы и физических характеристик, не изменяется.
Физический смысл увеличения энтропии заключается в том, что система с изолированной частицей должна перейти в состояние наименьшего порядка движения частиц. Это простейшее состояние системы или термодинамическое равновесие, в котором движение частиц хаотично. Необратимое направление процессов преобразования энергии в изолированных системах рано или поздно приводит к трансформации всех видов энергии в тепло. Он будет разбросан и равномерно распределен между всеми элементами системы. Максимальная энтропия означает полное термодинамическое равновесие, никакие смещения атомов и молекул не прекращаются, прерывание обмена энергией между обеими частями системы и окружающей средой - существует статистический или термодинамический хаос.
В добавление, если путь между первым и последним состояниями лежит сквозь любой фазовый переход первого рода, скрытая теплота, ассоциированная с переходом, должна также учитываться.
Энтропия первоначального состояния должна быть определена независимо. В идеальном варианте выбирается первоначальное состояние как состояние при экстремально высокой температуре, при которой система существует в виде газа. Энтропия в этом состоянии подобна энтропии классического идеального газа плюс взнос от молекулярных вращений и колебаний, которые могут быть определены спектроскопически.
Если Вселенная закрыта, она ждет жаркой смерти. Древние греки утверждают, что он возник из хаоса, и в предположении классической термодинамики он вернется туда. Если бы вселенная развивалась только до хаоса, как она могла возникнуть и достичь текущего структурированного состояния?
Классическая термодинамика, сформировавшаяся в эпоху, когда никто не задавался вопросом о неподвижном характере Вселенной. В то время единственная тень на законах термодинамики была выброшена из дарвиновской теории эволюции. По ее словам, процесс развития растительного и животного мира характеризуется постоянным усложнением, с ростом организации и порядка. Живая природа сопротивляется термодинамическому равновесию и хаосу. Очевидно, что законы развития неживой и живой природы противоречат друг другу.
Теория лабораторной работы
Теоретические сведения
В данной работе необходимо измерить температуру фазового перехода – температуру плавления олова, что позволит определить приращение энтропии.
Так как для обратимых процессов приращение энтропии dS = dQ /T , а изменение энтропии при переходе системы из состояния a в состояние b
 ,
,
то изменение энтропии при нагревании и плавлении олова определяется как сумма изменения энтропии при нагревании до температуры плавления и при плавлении олова:
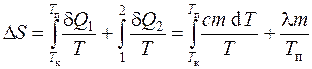 или
или
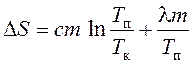 , (10)
, (10)
где dQ – бесконечно малое количество теплоты, передаваемой системе при температуре Т ;
dQ 1 и dQ 2 – бесконечно малые количества теплоты, полученные оловом при нагревании и при плавлении;
Т к – начальная (комнатная) температура;
Т п – температура плавления;
l = 59 10 -3 Дж/кг – удельная теплота плавления;
с = 0,23 10 -3 Дж/(кг К) – удельная теплоемкость,
m = 0,20 кг – масса олова.
Некоторые формулировки второго закона термодинамики
1. Каждая система, предоставленная сама себе, изменяется в среднем в направлении состояния с максимальной вероятностью (Г. Льюис).
2. Состояние с максимальной энтропией является наиболее устойчивым состоянием для изолированной системы (Э. Ферми).
3. При протекании любого реального процесса невозможно обеспечить средства возвращения каждой из участвующих в нем систем в ее исходное состояние (Г. Льюис).
4. Каждый физический или химический процесс в природе протекает таким образом, чтобы увеличивалась сумма энтропии всех тел, которые принимают участие в этом процессе (М. Планк).
5. Невозможна самопроизвольная передача теплоты от более холодного к более горячему телу.
6. Получение информации представляет собой уменьшение энтропии (Г. Льюис).
7. Энтропия-это стрелка времени* (А. Эддингтон).
Изменения энтропии в химических реакциях
Энтропия одного моля вещества в его стандартном состоянии при соответствующей температуре называется стандартной молярной энтропией. Стандартная молярная энтропия обозначается символом S" и имеет размерность ДжК-1 моль-1. В табл. 5.12 указаны стандартные молярные энтропии ряда элементов и соединений при температуре 25°С. Отметим, что стандартная молярная энтропия газов, как правило, имеет намного большие значения по сравнению с энтропией твердых тел. Энтропия любого фиксированного количества вещества увеличивается в такой последовательности:
Твердое вещество= Жидкость= Газ
Стандартные молярные энтропии иногда называют абсолютными энтропиями. Они не являются изменениями энтропии, сопровождающими образование соединения из входящих в него свободных элементов. Следует также отметить, что стандартные молярные энтропии свободных элементов (в виде простых веществ) не равны нулю.
Третий закон термодинамике утверждает, что энтропия идеального ионного кристалла при температуре абсолютного нуля (О К) равна нулю.
Таблица 5.12. Стандартные молярные энтропии S°(298 К) (Дж/(К моль))
Изменение стандартной молярной энтропии в химической реакции определяется уравнением
Следует обратить внимание на то, что изменение энтропии в рассмотренном примере оказывается отрицательным. Этого можно было ожидать, если учесть, что, согласно уравнению рассматриваемой реакции, суммарное количество газообразных реагентов равно 1,5 моль, а суммарное количество газообразных продуктов-только 1 моль. Таким образом, в результате реакции происходит уменьшение общего количества газов. Вместе с тем нам известно, что реакции горения принадлежат к числу экзотермических реакций. Следовательно, результатом их протекания является рассеяние энергии, а это заставляет ожидать возрастания энтропии, а не ее уменьшения. Далее, следует учесть, что горение газообразного водорода при 25°С, вызванное первоначальным инициированием, протекает затем самопроизвольно и с большой интенсивностью. Но разве не должно в таком случае изменение энтропии в данной реакции быть положительным, как того требует второй закон термодинамики? Оказывается - нет или по крайней мере не обязательно должно. Второй закон термодинамики требует, чтобы в результате самопроизвольного процесса возрастала суммарная энтропия системы и ее окружения. Вычисленное выше изменение энтропии характеризует только рассматриваемую химическую систему, состоящую из реагентов и продуктов, которые принимают участие в горении газообразного водорода при 25°С. А как же вычислить изменение энтропии для окружения этой системы?






