Энергия гиббса простых веществ. Энергия гиббса
Голландский физико-химик Вант-Гофф предложил новую теорлю химического сродства, которая, не объясняя природы химического сродства, ограничивается указанием способа его измерения, т. е. дает количественную оценку химическому сродству.
Вант-Гофф использует в качестве меры химического сродства максимальную работу Ауах или для реакций, протекающих при или соответственно.
Максимальная работа равна энергии, которую нужно приложить к системе, чтобы остановить реакцию, т. е. преодолеть, силы химического сродства. Поскольку реакция протекает в направлении совершения положительной максимальной работы, знак или определяет направление самопроизвольного течения химического взаимодействия.
Максимальная работа при постоянном объеме равна
Разность называют энергией Гельмгольца системы и обозначают буквой Таким образом,
Максимальная работа при постоянном давлении равна
Разность называют энергией Гиббса системы и обозначают буквой Таким образом,
![]()
Энергия Гиббса химической реакции.
Энергия Гиббса термодинамическая функция состояния системы Изменение энергии Гиббса в системе при протекании химической реакции называют энергией Гиббса химической реакции. Согласно уравнениям (IV.20) и (IV.21),
![]()
Исходя из (IV.21), энергия Гиббса химической реакции характеризует направление и предел самопроизвольного протекания реакции в условиях постоянства температуры и давления.
Энергия Гельмгольца химической реакции.
Энергия Гельмгольца также является термодинамической функцией состояния системы Изменение энергии Гельмгольца в системе при протекании реакции называют энергией Гельмгольца химической реакции. Согласно (IV. 18) и (IV.19),
где и - изменение соответствующих термодинамических функций в ходе реакции, протекающей при и температуре Т.
Величина [см. уравнение (IV. 19)] характеризует направление и предел самопроизвольного течения реакций в изохорно-изотермических условиях.
На рис. IV.3 приведены соотношения между основными термодинамическими функциями состояния системы.
Энергия Гиббса образования химических соединений.
Энергия Гиббса химической реакции являясь изменением термодинамической функции состояния системы может быть вычислена по разности
![]()
(индексы «2» и «1» относятся к конечному и начальному состояниям системы соответственно). При расчете энергии Гиббса химической реакции по уравнению (IV.24) следует иметь в виду, что - сумма энергий Гиббса образования всех продуктов реакции, - сумма энергий Гиббса образования всех исходных веществ. Стандартную энергию Гиббса химической реакции вычисляют по разности сумм стандартных энергий Гиббса образования продуктов реакции и исходных веществ.
Стандартной энергией Гиббса образования химического соединения называют энергию Гиббса реакции образования одного моля этого соединения, находящегося в стандартном состоянии, из соответствующих
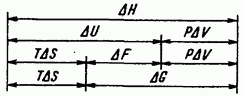
Рис. IV.3. Соотношение важнейших термодинамических функций
простых веществ, также находящихся в стандартных состояниях и термодинамически устойчивых при данной температуре фазах и модификациях (табл. IV.3).
Стандартные энергии Гиббса образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при стандартных условиях и 298,16 К.
Направление и пределы самопроизвольного течения химических реакций.
В соответствии с (IV. 19) и (IV.21) положительной максимальной работе А или отвечают отрицательные значения энергии Гельмгольца и энергии Гиббса химических реакций. Иными словами, при постоянных температуре и давлении реакция протекает самопроизвольно в том направлении, которому отвечает убыль энергии Гиббса системы Поэтому условием самопроизвольного течения химической реакции при заданных и Т является неравенство
Пределом самопроизвольного течения реакции при т. е. условием равновесия, служит достижение минимального для данных и Т значения функции
При постоянных температуре и объеме реакция протекает самопроизвольно в том направлений, которому отвечает убыль энергии Гельмгольца системы Поэтому условием самопроизвольного
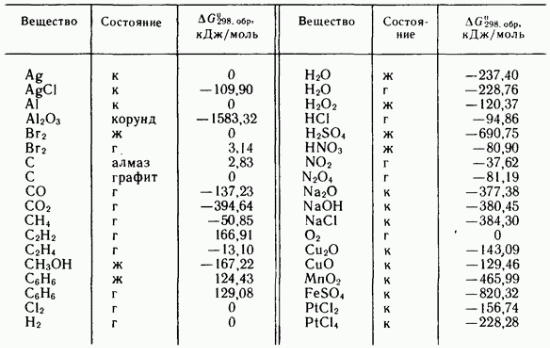
Таблица IV.3, Стандартные энергии Гиббса образования некоторых простых веществ и соединений при 298,16 К
произвольного течения химической реакции при заданных V и Т является неравенство
Пределом самопроизвольного течения реакции при т. е. условием равновесия, служит достижение минимального для данных V и Т значения функции
Если при изменению химического состава системы отвечает возрастаение энергии Гиббса то это значит, что самопроизвольная реакция не идет. Неравенство
означает, что реакция может идти самопроизвольно только в обратном направлении, которому отвечает убыль энергии Гиббса системы. Рассчитать стандартную энергию Гиббса химической реакции при 298,16 К и тем самым выяснить знак изменения функции несложно.
Так, например, используя данные, приведенные в табл. IV.3, можно рассчитать стандартную энергию Гиббса реакции при 298,16 К (для 1 моль
Полученное значение энергии Гиббса реакции удовлетворяет неравенству (IV.25). Это значит, что при 101 кПа и 298 К процесс взаимодействия оксида натрия с водой может протекать самопроизвольно в направлении получения (к).
Однако стандартная энергия Гиббса химической реакции не может быть критерием направления или предела самопроизвольного протекания химического взаимодействия в условиях, отличных от стандартных. Нельзя также подменять величину величиной Все это несколько затрудняет использование энергии Гиббса для оценки процессов, протекающих в реальных условиях.
Из уравнения (IV.22) следует, что при энергия Гиббса химической реакции тем меньше, чем меньше и чем больше Наибольшее химическое сродство веществ друг к другу проявляется в реакциях, протекающих с выделением теплоты и сопровождающихся ростом энтропии системы Из уравнения (IV.22) следует также, что самопроизвольно не могут осуществляться эндотермические процессы протекающие с уменьшением энтропии так как при этом величина всегда положительна. Эндотермические взаимодействия могут самопроизвольно идти только при условии Таким взаимодействиям способствует повышение температуры, так как при этом увеличивается значение энтропийного фактора процесса
Здесь вы найдете примеры задач на вычисление таких термодинамических параметров как энтальпия, энтропия, . Определение возможности самопроизвольного протекания процесса, а также составление термохимических уравнений.
Задачи к разделу Основы термодинамики с решениями
Задача 1. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции. Определите в каком направлении при 298 °К (прямом или обратном) будет протекать реакция. Рассчитайте температуру, при которой равновероятны оба направления реакции.
Fe 2 O 3 (к) + 3H 2 = 2Fe (к) + 3H 2 O (г)
Δ H р-ции = ΣH 0 кон – ΣH 0 исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
Δ H р-ции = 2·Δ H 0 Fe +3·Δ H 0 H2 O — Δ H 0 Fe2 O3 — 3·Δ H 0 H2 = 2·0 + 3·(- 241,82) – (-822,16) — 3·0 = 96,7 кДж/моль
Δ S р-ции =Σ S 0 кон – Σ S 0 исх Дж/(моль·K)
Используя справочные данные стандартных энтропий веществ, находим:
Δ S р-ции = 2·Δ S 0 Fe + 3·Δ S 0 H2 O — Δ S 0 Fe2 O3 — 3·Δ S 0 H2 = 2·27,15 + 3·188,7 – 89,96 — 3·131 = 137,44 Дж/(моль·K)
ΔG = Δ H – TΔS = 96,7 – 298 ·137,44 /1000 = 55,75 кДж/моль
При Т=298°К, ΔG > 0 – реакция не идет самопроизвольно, т.е. реакция будет протекать в обратном направлении.
ΔG = Δ H – TΔS = 0, тогда
T = — (ΔG – Δ H ) / ΔS = — (0-96,7)/0,137 = 705,83 K
При Т = 705,83 К реакция будет идти равновероятно как в прямом так и в обратном направлении.
Задача 2. Вычислите энергию Гиббса и определите возможность протекания реакции при температурах 1000 и 3000 К.
Уравнение реакции сгорания жидкого сероуглерода следующее:
CS 2 (ж) + 3O 2 = СО 2 + 2SO 2
Тепловой эффект реакции вычислим подставляя справочные данные стандартных энтальпий веществ в выражение:
Δ H р-ции = ΣH 0 кон – ΣH 0 исх кДж/моль
Δ H р-ции = 2·Δ H 0 SO2 + Δ H 0 CO2 — Δ H 0 CS2 — 3·Δ H 0 O2 = 2·(-296,9) + 3·(- 393,5) – 87 — 3·0 = -1075,1 кДж/моль
Т.е. при сгорании 1 моля сероуглерода выделяется 1075,1 кДж тепла
а при сгорании x молей сероуглерода выделяется 700 кДж тепла
Найдем х:
x = 700·1/1075,1 = 0,65 моль
Итак, если в результате реакции выделится 700 кДж тепла, то в реакцию вступят 0,65 моль CS 2
Задача 4. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
1. FeO (к) + CO (г) = Fe (к) + CО 2 (г); ΔH 1 = -18,20 кДж;
2. СO (г) + 1/2O 2 (г) = СO 2 (г) ΔН 2 = -283,0 кДж;
3. H 2 (г) + ½ O 2 (г) = H 2 O (г) ΔН 3 = -241,83 кДж.
Реакция восстановления оксида железа (II) водородом имеет следующий вид:
4. FeO (к) + H 2 (г) = Fe (к) + H 2 O (г)
Чтобы вычислить тепловой эффект реакции необходимо применить , т.е. реакцию 4. можно получить, если сложить реакции 1. и 2. и вычесть реакцию 1.:
Δ H р-ции = Δ H 1 + Δ H 3 – Δ H 2 = -18,2 – 241,3 + 283 = 23 кДж
Таким образом, тепловой эффект реакции восстановления оксида железа (II) водородом равен
Δ H р-ции = 23 кДж
Задача 5. Реакция горения бензола выражается термохимическим уравнением:
С 6 Н 6(ж) + 7½ О 2(г) = 6СО 2(г) + 3Н 2 О (г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными.
Тепловой эффект реакции равен:
Δ H р-ции = ΣH 0 кон – ΣH 0 исх кДж/моль
В нашем случае Δ H р-ции = – 3135,6 кДж, найдем теплоту образования жидкого бензола:
Δ H р-ции = 6·Δ H 0 С O2 + 3·Δ H 0 H2 O — Δ H 0 C6 H6 – 7,5·Δ H 0 O2
-Δ H 0 C6 H6 = Δ H р-ции — 3·(-241,84) + 6·(- 393,51) – 7,5·0 = — 3135,6 — 3·(-241,84) + 6·(- 393,51) – 7,5·0 = — 49,02 кДж/моль
Δ H 0 C6 H6 = 49,02 кДж/моль
Теплотворная способность жидкого бензола вычисляется по формуле:
Q Т = Δ H р-ции · 1000 / М
М(бензола) = 78 г/моль
Q Т = – 3135,6· 1000 / 78 = — 4,02·10 4 кДж/кг
Теплотворная способность жидкого бензола Q Т = — 4,02·10 4 кДж/кг
Задача 6. Реакция окисления этилового спирта выражается уравнением:
С 2 Н 5 ОН (ж) + 3,0 О 2(г) = 2СО 2(г) + 3Н 2 О (ж) .
Определить теплоту образования С 2 Н 5 ОН (ж) , зная ΔН х.р. = — 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования С 2 Н 5 ОН (ж) → С 2 Н 5 ОН (г) , если известна теплота образования С 2 Н 5 ОН (г) , равная –235,31 кДж·моль -1 .
Исходя из приведенных данных, запишем термохимическое уравнение :
С 2 Н 5 ОН (ж) + 3О 2(г) = 2СО 2(г) + 3Н 2 О (ж) + 1366,87 кДж
Тепловой эффект реакции равен:
Δ H р-ции = ΣH 0 кон – ΣH 0 исх кДж/моль
В нашем случае Δ H р-ции = – 1366,87 кДж.
Используя справочные данные теплот образования веществ , найдем теплоту образования С 2 Н 5 ОН (ж) :
Δ H р-ции = 2·Δ H 0 С O2 + 3·Δ H 0 H2 O — Δ H 0 C2 H5 OH(ж) – 3·Δ H 0 O2
– 1366,87 =2·(-393,51)+ 3·(-285,84)— Δ H 0 C2 H5 OH – 3·0
Δ H 0 C2 H5 OH(ж) = -277,36 кДж/моль
Δ H 0 C2 H5 OH(г) = Δ H 0 C2 H5 OH(ж) + Δ H 0 парообразования
Δ H 0 парообразования = Δ H 0 C2 H5 OH(г) — Δ H 0 C2 H5 OH(ж)
Δ H 0 парообразования = — 235,31 + 277,36 = 42,36 кДж/моль
Мы определили, что теплота образования С 2 Н 5 ОН (ж) равна
Δ H 0 C2 H5 OH(ж) = -277,36 кДж/моль
и мольная теплота парообразования С 2 Н 5 ОН (ж) → С 2 Н 5 ОН (г) равна
Δ H 0 парообразования = 42,36 кДж/моль
Задача 7. Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция:
СО 2 (г) +Н 2 (г) ↔ СО (г) +Н 2 О (ж) ?
Рассчитайте ΔG данной реакции. При каких температурах данная реакция становится самопроизвольной?
Рассчитаем ΔG данной реакции:
ΔG = Δ H – TΔS
Для этого сначала определим Δ H и ΔS реакции:
Δ H р-ции = ΣH 0 кон – ΣH 0 исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
Δ H р-ции = Δ H 0 H2 O(ж) + Δ H 0 CO — Δ H 0 CО2 — Δ H 0 Н2 = -110,5 + (-285,8) – (393,5) — 0 = -2,8 кДж/моль
Δ S р-ции =Σ S 0 кон – Σ S 0 исх Дж/(моль·K)
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
Δ S р-ции = Δ S 0 H2 O(ж) + Δ S 0 CO — Δ S 0 CО2 — Δ S 0 Н2 = 197,5 + 70,1 — 213,7 — 130,52 = -76,6 Дж/(моль·K)
Найдем энергию Гиббса при стандартных условиях
ΔG р-ции = Δ H – TΔS = -2,8 + 298 · 76,6 /1000 = 20 кДж/моль> 0,
следовательно, реакция самопроизвольно не идет .
Найдем при каких температурах данная реакция становится самопроизвольной .
В состоянии равновесия ΔG р-ции = 0 , тогда
T = Δ H / ΔS = -2,8/(-76,6·1000) = 36,6 К
Задача 8. Рассчитав на основании табличных данных ΔG и ΔS, определите тепловой эффект реакции:
2 NO (г) + Cl 2 (г) ↔ 2 NOCl (г).
При постоянных температуре и давлении, изменение энергии Гиббса
ΔG = Δ H – TΔS
На основании табличных данных рассчитаем ΔG и ΔS
ΔG 0 р-ции = Σ ΔG 0 прод — Σ ΔG 0 исх
ΔG р-ции = 2·ΔG 0 NOCl (г) — 2·ΔG 0 NO (г) — ΔG 0 Cl 2(г)
ΔG р-ции = 2· 66,37 — 2· 89,69 – 0 = — 40,64 кДж/моль
ΔG р-ции < 0 , значит реакция самопроизвольна.
Δ S р-ции =Σ S 0 кон – Σ S 0 исх Дж/(моль·K)
Δ S р-ции = 2·ΔS 0 NOCl (г) — 2·ΔS 0 NO (г) — ΔS 0 Cl 2(г)
Δ S р-ции = 2· 261,6 — 2· 210,62 – 223,0 = -121,04 Дж/(моль·K)
Найдем Δ H :
Δ H = ΔG + TΔS
Δ H = — 40,64 + 298 · (-121,04/1000) = — 76,7 кДж/моль
Тепловой эффект реакции Δ H = — 76,7 кДж/моль
Задача 9. С чем будет более интенсивно взаимодействовать газообразный хлористый водород (в расчете на 1 моль): с алюминием или с оловом? Ответ дайте, рассчитав ΔG 0 обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
Рассчитаем ΔG 0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с алюминием
2Al(т) + 6HCl (г) = 2AlCl 3 (т) + 3H 2
ΔG 0 р-ции = Σ ΔG 0 прод — Σ ΔG 0 исх кДж/моль
ΔG 0 р-ции1 = 2·ΔG 0 AlCl 3 (т) + 3·ΔG 0 H 2 — 2·ΔG 0 Al (т) — 6· ΔG 0 HCl (г)
ΔG 0 р-ции1 = 2· (-636,8) + 3·0— 2·0— 6· (-95,27) = -701,98 кДж/моль
В реакции принимает участие 2 моль Al(т), тогда ΔG р-ции1 1 моля Al(т) равно
ΔG 0 р-ции 1 = -701,98 / 2 = -350,99 кДж/моль
Рассчитаем ΔG 0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с оловом:
Sn(т) + 2HCl (г) = SnCl 2 (т) + H 2
ΔG 0 р-ции2 =ΔG 0 SnCl 2 (т) + ΔG 0 H 2 — ΔG 0 Sn (т) — 2· ΔG 0 HCl (г)
ΔG 0 р-ции 2 = -288,4 + 0- 0- 2·(-95,27) = -97,86 кДж/моль
Обе реакции имеют ΔG 0 <0 , поэтому они протекают самопроизвольно в прямом направлении, но более интенсивно взаимодействовать газообразный хлористый водород будет с алюминием, т.к
ΔG 0 р-ции 1 ˂ ΔG 0 р-ции 2
Задача 10. Не прибегая к вычислениям, определите, какие знаки (>0, <0, ≅0) имеют ΔG, ΔH и ΔS для протекающей в прямом направлении реакции:
4 НBr (г) + O 2(г) ↔ 2 H 2 O (г) + 2 Br 2 (г)
Как повлияет повышение температуры на направленность химической реакции?
При постоянных температуре и давлении изменение энергии Гиббса связано с энтальпией и энтропией выражением:
ΔG = Δ H – TΔS
– мера беспорядочности системы. Значение энтропии тем больше, чем больше беспорядок в системе (больше газообразных веществ). В данной реакции количество молей газов в правой части равно – 5, а в левой – 4, значит энтропия системы уменьшается ΔS ˂0.
По условию задачи реакция протекает в прямом направлении, следовательно ΔG˂0 .
В обычных условиях TΔS ˂˂ ΔH , поэтому в данном случае ΔH˂0 – реакция экзотермическая.
При повышении температуры может настать момент, когда значения TΔS и Δ H станут одинаковыми, тогда система придет в равновесие ΔG =0. Если температуру повысить значительно, то будет преобладать энтропийный фактор TΔS , тогда реакция самопроизвольно протекать уже не будет ΔG >0.
Для решения одной из основных задач химической термодинамики - установления принципиальной возможности самопроизвольного протекания процессов - необходимо иметь объективный количественный критерий. Выше было показано, что действующими силами в различных процессах (в том числе и химических) выступают две конкурирующие тенденции или два противоположных фактора:
1. Энергетический, или энтальпийный, обусловленный стремлением системы перейти в состояние с наименьшей энергией, например, при р=const понизить энтальпию (𝛥H< 0);
2. Структурный, или энтропийный, обусловленный стремлением системы перейти в состояние с максимальной степенью разупорядоченности, т.е. повысить энтропию (𝛥S>0).
Если в ходе реакции степень беспорядка не изменяется (𝛥S=0), то направление процесса определяется изменением энтальпии и процесс проходит самопроизвольно в направлении уменьшения энтальпии (𝛥H< 0).
Если процесс происходит без изменения энтальпии (𝛥H=0), то фактором, определяющим направление реакции, является энтропия и процесс пойдет самопроизвольно в сторону её увеличения (𝛥S >0).
Если одновременно изменяются и энтальпия, и энтропия, то направление самопроизвольного протекания процесса определяется суммарной движущей силой реакции. Самопроизвольно реакция протекает в том направлении, в котором общая суммарная движущая сила системы будет уменьшаться.
С учетом одновременного действия этих двух противоположных факторов, такой движущей силой (функцией состояния) для реакций, протекающих при постоянной температуре и давлении, является энергия Гиббса (G), называемая также изобарно-изотермическим потенциалом, или свободной энергией.
В качестве критерия для определения направления самопроизвольного протекания химических процессов (при р=const используется изменение энергии Гиббса 𝛥G или
𝛥G=G 2 - G 1 (1.27)
В зависимости от знака её изменения, возможны три случая.
1. 𝛥G < 0, реакция термодинамически возможна.
При постоянной температуре и давлении химические реакции протекают самопроизвольно только в направлении уменьшения энергии Гиббса в системе (𝛥G < 0).
Это положение связано с принципом минимума энергии, лежащим в основе второго закона термодинамики, одна из формулировок которого гласит:
«Теплота не может самостоятельно переходить от менее нагретого тела к более нагретому, самопроизвольно возможен лишь обратный процесс».
2. 𝛥G > 0, реакция термодинамически невозможна;
3. 𝛥G = 0, термодинамически возможны как прямая, так и обратная реакция.
Отсутствие изменения энергии Гиббса является термодинамическим условием установления химического равновесия в реакционной системе.
Энергия Гиббса связана с энтальпией, энтропией и температурой следующим образом:
Изменение энергии Гиббcа (𝛥G) при этом записывается в виде:
𝛥G = 𝛥Н – Т𝛥S (1.28)
Из уравнения 1.28 следует, что возможность самопроизвольного протекания химических реакций зависит от соотношения величины 𝛥Н и Т𝛥S. При этом возможны четыре основных случая:
1. Если 𝛥Н < 0, а 𝛥S > 0, то энергия Гиббcа всегда будет величиной отрицательной (𝛥G < 0). Такие реакции термодинамически возможны при любой температуре.
2. Если 𝛥Н > 0, а 𝛥S < 0, то всегда 𝛥G > 0. Такие реакции термодинамически невозможны при любых температурах.
3. Если 𝛥Н > 0 и 𝛥S > 0, то реакция возможна только при высоких температурах, когда | 𝛥Н | < | Т𝛥S |.
4. Если 𝛥Н <0 и 𝛥S <0, то реакция возможна при низких температурах, когда | 𝛥Н | > | Т𝛥S |.
Для проведения различных термодинамических расчетов, также как и в случае других термодинамических функций, вводят специальное понятие: стандартная энергия Гиббcа образования вещества (𝛥G° обр.298). Это - изменение энергии Гиббса в реакции образования одного моля соединения из соответствующих простых веществ, когда все участвующие вещества находятся в стандартном состоянии, а реакция проходит при стандартных условиях (измеряется обычно в кДж/моль). При этом:
Стандартная энергия Гиббса образования простых веществ условно принимается равной нулю.
В справочниках обычно приводятся значения стандартных энергий Гиббса образования вещества при 298 К. Зная величины 𝛥Н и 𝛥S, можно рассчитать значение 𝛥G при других температурах и, соответственно, предсказать возможность или невозможность самопроизвольного течения реакции.
Энергия Гиббcа является функцией состояния системы. Поэтому её изменение в ходе той или иной химической реакции зависит только от природы, физического или агрегатного состояния исходных веществ и продуктов реакции, их количества и не зависит от промежуточных стадий реакции или от того, каким путем данная реакционная система достигла конечного состояния, т.е.
При суммировании обязательно учитывается число молей (v) всех участвующих веществ.
Пример
1
. Вычислить
 реакции, на основании стандартных теплот
образования.
реакции, на основании стандартных теплот
образования.






