Vrste kemijskih reakcija ugljikovodika. Reakcije adicije. Kemijska svojstva toluena
Karakteristična kemijska svojstva ugljikovodika: alkani, alkeni, dieni, alkini, aromatski ugljikovodici
alkani
Alkani su ugljikovodici u čijim su molekulama atomi povezani jednostrukim vezama i koji odgovaraju općoj formuli $C_(n)H_(2n+2)$.
Homologne serije metana
kao što već znate, homolozi- to su tvari slične strukture i svojstava, a razlikuju se po jednoj ili više $CH_2$ skupina.
Zasićeni ugljikovodici čine homologni niz metana.
Izomerija i nomenklatura
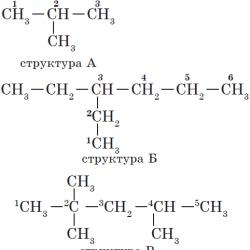
Alkane karakterizira takozvana strukturna izomerija. Strukturni izomeri se međusobno razlikuju po strukturi ugljikovog skeleta. Kao što već znate, najjednostavniji alkan, koji karakteriziraju strukturni izomeri, je butan:
Pogledajmo pobliže osnove IUPAC-ove nomenklature za alkane:
1. Odabir glavnog kruga.
Formiranje naziva ugljikovodika započinje definicijom glavnog lanca - najdužeg lanca ugljikovih atoma u molekuli, koji je, takoreći, njegova osnova.
2.
Atomima glavnog lanca dodijeljeni su brojevi. Numeriranje atoma glavnog lanca počinje od kraja kojemu je supstituent najbliži (strukture A, B). Ako se supstituenti nalaze na jednakoj udaljenosti od kraja lanca, onda numeriranje počinje od kraja na kojem ih je više (struktura B). Ako su različiti supstituenti smješteni na jednakoj udaljenosti od krajeva lanca, tada numeriranje počinje od kraja kojemu je stariji najbliži (struktura D). Seniornost supstituenata ugljikovodika određena je redoslijedom kojim se u abecedi pojavljuje slovo kojim počinje njihov naziv: metil (—$CH_3$), zatim propil ($—CH_2—CH_2—CH_3$), etil ($—CH_2 —CH_3$ ) itd.
Imajte na umu da se naziv supstituenta formira zamjenom sufiksa -an sufiksirati -il u nazivu odgovarajućeg alkana.
3. Tvorba imena.
Na početku naziva navedeni su brojevi - brojevi ugljikovih atoma na kojima se nalaze supstituenti. Ako postoji nekoliko supstituenata na danom atomu, tada se odgovarajući broj u nazivu ponavlja dva puta odvojen zarezom ($2,2-$). Nakon broja, broj supstituenata označen je crticom ( di- dva, tri- tri, tetra- četiri, penta- pet) i ime zamjenika ( metil, etil, propil). Zatim, bez razmaka ili crtica, naziv glavnog lanca. Glavni lanac naziva se ugljikovodik - član homologne serije metana ( metan, etan, propan itd.).

Nazivi tvari čije su strukturne formule navedene gore su sljedeći:
— struktura A: $2$ -metilpropan;
— struktura B: $3$ -etilheksan;
— struktura B: $2,2,4$ -trimetilpentan;
— struktura G: $2$ -metil$4$-etilheksan.
Fizikalna i kemijska svojstva alkana
Fizička svojstva. Prva četiri predstavnika homolognog niza metana su plinovi. Najjednostavniji od njih je metan, plin bez boje, okusa i mirisa (miris plina, nakon što ga osjetite, trebate nazvati $104$, određen je mirisom merkaptana - spojeva koji sadrže sumpor koji se posebno dodaju metanu koji se koristi u kućanskih i industrijskih plinskih uređaja kako bi ljudi koji se nalaze pored njih mirisom mogli otkriti curenje).
Ugljikovodici sastava od $S_5N_(12)$ do $S_(15)N_(32)$ su tekućine; teži ugljikovodici su čvrste tvari.
Vrelište i talište alkana postupno se povećavaju s povećanjem duljine ugljikovog lanca. Svi ugljikovodici su slabo topljivi u vodi; tekući ugljikovodici su uobičajena organska otapala.
Kemijska svojstva.
1. Supstitucijske reakcije. Najkarakterističnije reakcije za alkane su reakcije supstitucije slobodnih radikala, tijekom kojih dolazi do zamjene atoma vodika atomom halogena ili nekom skupinom.
Navedimo jednadžbe najkarakterističnijih reakcija.
Halogeniranje:
$CH_4+Cl_2→CH_3Cl+HCl$.
U slučaju viška halogena, kloriranje može ići dalje, sve do potpune zamjene svih atoma vodika klorom:
$CH_3Cl+Cl_2→HCl+(CH_2Cl_2)↙(\text"diklorometan (metilen klorid)")$,
$CH_2Cl_2+Cl_2→HCl+(CHSl_3)↙(\text"triklorometan(kloroform)")$,
$CHCl_3+Cl_2→HCl+(CCl_4)↙(\text"ugljik tetraklorid(ugljik tetraklorid)")$.
Dobivene tvari naširoko se koriste kao otapala i početni materijali u organskim sintezama.
2. Dehidrogenacija (eliminacija vodika). Kada alkani prolaze preko katalizatora ($Pt, Ni, Al_2O_3, Cr_2O_3$) na visokim temperaturama ($400-600°C$), molekula vodika se eliminira i nastaje alken:
$CH_3—CH_3→CH_2=CH_2+H_2$
3. Reakcije popraćene razaranjem ugljikovog lanca. Svi zasićeni ugljikovodici gori uz stvaranje ugljičnog dioksida i vode. Plinoviti ugljikovodici pomiješani sa zrakom u određenim omjerima mogu eksplodirati. Izgaranje zasićenih ugljikovodika je egzotermna reakcija slobodnih radikala, što je vrlo važno kada se kao gorivo koriste alkani:
$SN_4+2O_2→SO_2+2N_2O+880 kJ.$
Općenito, reakcija izgaranja alkana može se napisati na sljedeći način:
$C_(n)H_(2n+2)+((3n+1)/(2))O_2→nCO_2+(n+1)H_2O$
Toplinsko cijepanje ugljikovodika:
$C_(n)H_(2n+2)(→)↖(400-500°C)C_(n-k)H_(2(n-k)+2)+C_(k)H_(2k)$
Proces se odvija putem mehanizma slobodnih radikala. Povećanje temperature dovodi do homolitičkog cijepanja veze ugljik-ugljik i stvaranja slobodnih radikala:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Ovi radikali međusobno djeluju međusobno, izmjenjujući atom vodika, da bi formirali molekulu alkana i molekulu alkena:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Reakcije toplinske razgradnje temelj su industrijskog procesa krekiranja ugljikovodika. Ovaj proces je najvažnija faza prerade nafte.
Kada se metan zagrije na temperaturu od $1000°C$, počinje piroliza metana - razgradnja na jednostavne tvari:
$CH_4(→)↖(1000°C)C+2H_2$
Pri zagrijavanju na temperaturu od $1500°C$ moguće je stvaranje acetilena:
$2CH_4(→)↖(1500°C)CH=CH+3H_2$
4. Izomerizacija. Kada se linearni ugljikovodici zagrijavaju s katalizatorom izomerizacije (aluminijev klorid), nastaju tvari s razgranatim ugljikovim skeletom:
5. Aromatizacija. Alkani sa šest ili više atoma ugljika u lancu cikliziraju u prisutnosti katalizatora da bi formirali benzen i njegove derivate:

Koji je razlog zašto alkani podliježu reakcijama slobodnih radikala? Svi atomi ugljika u molekulama alkana su u stanju $sp^3$ hibridizacije. Molekule ovih tvari izgrađene su pomoću kovalentnih nepolarnih $C-C$ (ugljik-ugljik) veza i slabo polarnih $C-H$ (ugljik-vodik) veza. Ne sadrže područja s povećanom ili smanjenom gustoćom elektrona, niti lako polarizirajuće veze, tj. takve veze, gustoća elektrona u kojima se može pomaknuti pod utjecajem vanjskih čimbenika (elektrostatska polja iona). Posljedično, alkani neće reagirati s nabijenim česticama, jer veze u molekulama alkana se ne prekidaju heterolitičkim mehanizmom.
Alkeni
Nezasićeni uključuju ugljikovodike koji sadrže višestruke veze između ugljikovih atoma u svojim molekulama. Neograničeno su alkeni, alkadieni (polieni), alkini. Nezasićen karakter imaju i ciklički ugljikovodici koji sadrže dvostruku vezu u prstenu (cikloalkeni), kao i cikloalkani s malim brojem ugljikovih atoma u prstenu (tri ili četiri atoma). Svojstvo nezasićenosti povezano je sa sposobnošću ovih tvari da uđu u reakcije adicije, prvenstveno vodika, uz stvaranje zasićenih ili zasićenih ugljikovodika - alkana.
Alkeni su aciklički ugljikovodici koji u molekuli sadrže, osim jednostrukih veza, i jednu dvostruku vezu između ugljikovih atoma i odgovaraju općoj formuli $C_(n)H_(2n)$.
Njegovo drugo ime je olefini- alkeni su dobiveni analogno nezasićenim masnim kiselinama (oleinska, linolna), čiji ostaci ulaze u sastav tekućih masti - ulja (od lat. oleum- ulje).
Homologni niz etena
Nerazgranati alkeni tvore homologni niz etena (etilena):
$S_2N_4$ - eten, $S_3N_6$ - propen, $S_4N_8$ - buten, $S_5N_(10)$ - penten, $S_6N_(12)$ - heksen itd.
Izomerija i nomenklatura
Alkene, kao i alkane, karakterizira strukturna izomerija. Strukturni izomeri se međusobno razlikuju po strukturi ugljikovog skeleta. Najjednostavniji alken, karakteriziran strukturnim izomerima, je buten:

Posebna vrsta strukturne izomerije je izomerija položaja dvostruke veze:
$CH_3—(CH_2)↙(buten-1)—CH=CH_2$ $CH_3—(CH=CH)↙(buten-2)—CH_3$
Gotovo slobodna rotacija atoma ugljika moguća je oko jedne veze ugljik-ugljik, tako da molekule alkana mogu poprimiti najrazličitije oblike. Rotacija oko dvostruke veze je nemoguća, što dovodi do pojave druge vrste izomerije u alkenima - geometrijske, ili cis-trans izomerije.

Cis- izomeri se razlikuju od trans- izomeri prostornim rasporedom molekularnih fragmenata (u ovom slučaju metilnih skupina) u odnosu na ravninu $π$ veze, a time i svojim svojstvima.
Alkeni su izomerni cikloalkanima (interklasna izomerija), na primjer:

IUPAC-ova nomenklatura za alkene slična je onoj za alkane.
1. Odabir glavnog kruga.
Imenovanje ugljikovodika počinje identificiranjem glavnog lanca — najduljeg lanca ugljikovih atoma u molekuli. U slučaju alkena, glavni lanac mora sadržavati dvostruku vezu.
2. Numeriranje atoma glavnog lanca.
Numeriranje atoma glavnog lanca počinje od kraja kojemu je dvostruka veza najbliža. Na primjer, ispravan naziv veze je:

$5$-metilheksen-$2$, a ne $2$-metilheksen-$4$, kako bi se moglo očekivati.
Ako položaj dvostruke veze ne može odrediti početak numeriranja atoma u lancu, tada je određen položajem supstituenata, kao i kod zasićenih ugljikovodika.

3. Tvorba imena.
Imena alkena tvore se na isti način kao i imena alkana. Na kraju naziva navedite broj ugljikovog atoma na kojem počinje dvostruka veza i sufiks koji označava da spoj pripada klasi alkena - -en.
Na primjer:

Fizikalna i kemijska svojstva alkena
Fizička svojstva. Prva tri predstavnika homolognog niza alkena su plinovi; tvari sastava $S_5N_(10)$ - $S_(16)N_(32)$ - tekućine; Viši alkeni su čvrste tvari.
Vrelište i talište se prirodno povećavaju s povećanjem molekularne težine spojeva.
Kemijska svojstva.
Reakcije adicije. Podsjetimo se da je posebnost predstavnika nezasićenih ugljikovodika - alkena sposobnost ulaska u reakcije dodavanja. Većina ovih reakcija odvija se prema mehanizmu
1. Hidrogenacija alkena. Alkeni mogu dodati vodik u prisutnosti katalizatora hidrogenacije, metala - platine, paladija, nikla:
$CH_3—CH_2—CH=CH_2+H_2(→)↖(Pt)CH_3—CH_2—CH_2—CH_3$.
Ova reakcija se odvija pri atmosferskom i povišenom tlaku i ne zahtijeva visoku temperaturu, jer je egzotermna. Kad temperatura poraste, isti katalizatori mogu izazvati obrnutu reakciju — dehidrogenaciju.
2. Halogenizacija (adicija halogena). Interakcija alkena s bromnom vodom ili otopinom broma u organskom otapalu ($CCl_4$) dovodi do brzog obezbojenja ovih otopina kao rezultat dodavanja molekule halogena alkenu i stvaranja dihalogenih alkana:
$CH_2=CH_2+Br_2→CH_2Br—CH_2Br$.
3.
$CH_3-(CH)↙(propen)=CH_2+HBr→CH_3-(CHBr)↙(2-brompropen)-CH_3$
Ova reakcija se pokorava Markovnikovljevo pravilo:
Kada se halogenovodik doda alkenu, vodik se dodaje više hidrogeniranom ugljikovom atomu, tj. atom na kojem je više atoma vodika, a halogen manje hidrogeniranom.
Hidratacija alkena dovodi do stvaranja alkohola. Na primjer, dodavanje vode etenu je temelj jedne od industrijskih metoda za proizvodnju etilnog alkohola:
$(CH_2)↙(eten)=CH_2+H_2O(→)↖(t,H_3PO_4)CH_3-(CH_2OH)↙(etanol)$
Imajte na umu da primarni alkohol (s hidrokso skupinom na primarnom ugljiku) nastaje samo kada se eten hidratizira. Kad se propen ili drugi alkeni hidratiziraju, nastaju sekundarni alkoholi.

Ova reakcija također teče u skladu s Markovnikovljevim pravilom - vodikov kation se veže za više hidrogenirani ugljikov atom, a hidrokso skupina za manje hidrogenirani.
5. Polimerizacija. Poseban slučaj adicije je reakcija polimerizacije alkena:
$nCH_2(=)↙(eten)CH_2(→)↖(UV svjetlo, R)(...(-CH_2-CH_2-)↙(polietilen)...)_n$
Ova adicijska reakcija odvija se putem mehanizma slobodnih radikala.
6. Reakcija oksidacije.
Kao i svi organski spojevi, alkeni izgaraju u kisiku i tvore $SO_2$ i $N_2O$:
$SN_2=SN_2+3O_2→2SO_2+2N_2O$.
Općenito:
$C_(n)H_(2n)+(3n)/(2)O_2→nCO_2+nH_2O$
Za razliku od alkana, koji su otporni na oksidaciju u otopinama, alkeni se lako oksidiraju otopinama kalijevog permanganata. U neutralnim ili alkalnim otopinama alkeni se oksidiraju u diole (dihidrične alkohole), a hidroksilne skupine se dodaju onim atomima između kojih je prije oksidacije postojala dvostruka veza:

Alkadijeni (dienski ugljikovodici)
Alkadieni su aciklički ugljikovodici koji u molekuli, osim jednostrukih veza, sadrže i dvije dvostruke veze između ugljikovih atoma i odgovaraju općoj formuli $C_(n)H_(2n-2)$.
Ovisno o relativnom rasporedu dvostrukih veza, razlikuju se tri vrste diena:
- alkadijeni sa kumuliran raspored dvostrukih veza:
- alkadijeni sa konjugiran dvostruke veze;
$CH_2=CH—CH=CH_2$;
- alkadijeni sa izolirani dvostruke veze
$CH_2=CH—CH_2—CH=CH_2$.
Ove tri vrste alkadiena značajno se razlikuju jedna od druge u strukturi i svojstvima. Središnji atom ugljika (atom koji tvori dvije dvostruke veze) u alkadijenima s kumuliranim vezama nalazi se u stanju $sp$-hibridizacije. Formira dvije $σ$-veze koje leže na istoj liniji i usmjerene su u suprotnim smjerovima i dvije $π$-veze koje leže u okomitim ravninama. $π$-Veze nastaju zbog nehibridiziranih p-orbitala svakog atoma ugljika. Svojstva alkadiena s izoliranim dvostrukim vezama vrlo su specifična jer konjugirane $π$-veze značajno utječu jedna na drugu.
p-orbitale koje tvore konjugirane $π$-veze čine praktički jedan sustav (naziva se $π$-sustav), jer p-orbitale susjednih $π$-veza se djelomično preklapaju.
Izomerija i nomenklatura
Alkadijene karakterizira i strukturna izomerija i cis-, trans- izomerija.
Strukturna izomerija.
— izomerija ugljičnog skeleta:

— izomerija položaja višestrukih veza:
$(CH_2=CH—CH=CH_2)↙(butadien-1,3)$ $(CH_2=C=CH—CH_3)↙(butadien-1,2)$
cis-, trans- izomerija (prostorna i geometrijska)
Na primjer:
Alkadieni su izomerni spojevi klase alkina i cikloalkena.
Pri formiranju naziva alkadiena, naznačen je broj dvostrukih veza. Glavni lanac mora nužno sadržavati dvije višestruke veze.
Na primjer:

Fizikalna i kemijska svojstva alkadiena
Fizička svojstva.
Pod normalnim uvjetima, propandien-1,2, butadien-1,3 su plinovi, 2-metilbutadien-1,3 je hlapljiva tekućina. Alkadijeni s izoliranim dvostrukim vezama (najjednostavniji od njih je pentadien-1,4) su tekućine. Viši dieni su čvrste tvari.
Kemijska svojstva.
Kemijska svojstva alkadiena s izoliranim dvostrukim vezama malo se razlikuju od svojstava alkena. Alkadijeni s konjugiranim vezama imaju neke posebne značajke.
1. Reakcije adicije. Alkadijeni su sposobni za dodavanje vodika, halogena i halogenovodika.
Posebnost adicije alkadijenima s konjugiranim vezama je mogućnost dodavanja molekula kako na položaje 1 i 2, tako i na položaje 1 i 4.

Omjer produkata ovisi o uvjetima i načinu izvođenja odgovarajućih reakcija.
2.Reakcija polimerizacije. Najvažnije svojstvo diena je sposobnost polimerizacije pod utjecajem kationa ili slobodnih radikala. Polimerizacija ovih spojeva je osnova sintetičkih guma:
$nCH_2=(CH—CH=CH_2)↙(butadien-1,3)→((... —CH_2—CH=CH—CH_2— ...)_n)↙(\text"sintetski butadien kaučuk")$ .
Polimerizacija konjugiranih diena odvija se kao 1,4-adicija.
U ovom slučaju, dvostruka veza je središnja u jedinici, a elementarna jedinica, zauzvrat, može preuzeti obje cis-, dakle trans- konfiguracija

alkini
Alkini su aciklički ugljikovodici koji u molekuli sadrže, osim jednostrukih veza, i jednu trostruku vezu između ugljikovih atoma i odgovaraju općoj formuli $C_(n)H_(2n-2)$.
Homologni niz etina
Ravnolančani alkini tvore homologni niz etina (acetilena):
$S_2N_2$ - etin, $S_3N_4$ - propin, $S_4N_6$ - butin, $S_5N_8$ - pentin, $S_6N_(10)$ - heksin itd.
Izomerija i nomenklatura
Alkine, kao i alkene, karakterizira strukturna izomerija: izomerija ugljikovog skeleta i izomerija položaja višestruke veze. Najjednostavniji alkin, kojeg karakteriziraju strukturni izomeri položaja višestruke veze klase alkina, je butin:
$SN_3—(SN_2)↙(butine-1)—S≡SN$ $SN_3—(S≡S)↙(butine-2)—SN_3$
Moguća je izomerija ugljikovog skeleta u alkinima, počevši od pentina:

Budući da trostruka veza pretpostavlja linearnu strukturu ugljikovog lanca, geometrijski ( cis-, trans-) izomerija je nemoguća za alkine.
Prisutnost trostruke veze u molekulama ugljikovodika ove klase odražava se sufiksom -u, a njegov položaj u lancu je broj ugljikovog atoma.
Na primjer:

Spojevi nekih drugih klasa su izomerni alkinima. Dakle, kemijska formula $C_6H_(10)$ ima heksin (alkin), heksadien (alkadien) i cikloheksen (cikloalken):

Fizikalna i kemijska svojstva alkina
Fizička svojstva. Vrelište i talište alkina, kao i alkena, prirodno se povećavaju s povećanjem molekularne težine spojeva.
Alkini imaju specifičan miris. U vodi su topljiviji od alkana i alkena.
Kemijska svojstva.
Reakcije adicije. Alkini su nezasićeni spojevi i podliježu reakcijama adicije. Uglavnom reakcije elektrofilna adicija.
1. Halogenizacija (adicija molekule halogena). Alkin je sposoban vezati dvije molekule halogena (klor, brom):
$CH≡CH+Br_2→(CHBr=CHBr)↙(1,2-dibromoetan),$
$CHBr=CHBr+Br_2→(CHBr_2-CHBr_2)↙(1,1,2,2-tetrabromoethane)$
2. Hidrohalogenacija (adicija halogenovodika). Reakcija adicije halogenovodika, koja se odvija preko elektrofilnog mehanizma, također se odvija u dva stupnja, a u oba stupnja je zadovoljeno Markovnikovljevo pravilo:
$CH_3-C≡CH+Br→(CH_3-CBr=CH_2)↙(2-brompropen),$
$CH_3-CBr=CH_2+HBr→(CH_3-CHBr_2-CH_3)↙(2,2-dibrompropan)$
3. Hidratacija (dodavanje vode). Od velikog značaja za industrijsku sintezu ketona i aldehida je reakcija adicije vode (hidratacija) koja se naziva Reakcija Kucherova:
4. Hidrogenacija alkina. Alkini dodaju vodik u prisutnosti metalnih katalizatora ($Pt, Pd, Ni$):
$R-C≡C-R+H_2(→)↖(Pt)R-CH=CH-R,$
$R-CH=CH-R+H_2(→)↖(Pt)R-CH_2-CH_2-R$
Budući da trostruka veza sadrži dvije reaktivne $π$ veze, alkani dodaju vodik postupno:
1) trimerizacija.
Kada se etin prijeđe preko aktivnog ugljena, nastaje smjesa produkata od kojih je jedan benzen:

2) dimerizacija.
Osim trimerizacije acetilena moguća je i njegova dimerizacija. Pod utjecajem monovalentnih bakrenih soli nastaje vinil acetilen:
$2HC≡CH→(HC≡C-CH=CH_2)↙(\text"buten-1-u-3(vinilacetilen)")$
Ova tvar se koristi za proizvodnju kloroprena:
$HC≡C-CH=CH_2+HCl(→)↖(CaCl)H_2C=(CCl-CH)↙(kloropren)=CH_2$
čijom se polimerizacijom dobiva kloropren kaučuk:
$nH_2C=CCl-CH=CH_2→(...-H_2C-CCl=CH-CH_2-...)_n$
Oksidacija alkina.
Etin (acetilen) gori u kisiku, oslobađajući vrlo veliku količinu topline:
$2C_2H_2+5O_2→4CO_2+2H_2O+2600kJ$ Na ovoj reakciji temelji se djelovanje baklje kisik-acetilen, čiji plamen ima vrlo visoku temperaturu (preko $3000°C$), što mu omogućuje upotrebu za rezanje i zavarivanje metala.
U zraku acetilen gori zadimljenim plamenom, jer sadržaj ugljika u njegovoj molekuli veći je nego u molekulama etana i etena.
Alkini, poput alkena, obezbojavaju zakiseljene otopine kalijevog permanganata; U tom slučaju, višestruka veza je uništena.
Ionski (pravilo V.V. Markovnikova) i radikalski mehanizmi reakcija u organskoj kemiji
Vrste kemijskih reakcija u organskoj kemiji
Reakcije organskih tvari mogu se formalno podijeliti u četiri glavne vrste: supstitucija, adicija, eliminacija (eliminacija) i preraspodjela (izomerizacija). Očito je da se cijela raznolikost reakcija organskih spojeva ne može svesti na predloženu klasifikaciju (na primjer, reakcije izgaranja). Međutim, takva klasifikacija pomoći će uspostaviti analogije s reakcijama koje se javljaju između anorganskih tvari, koje su vam već poznate iz tečaja anorganske kemije.
Tipično, glavni organski spoj uključen u reakciju naziva se supstrat, a druga komponenta reakcije uobičajeno se smatra reaktantom.
Supstitucijske reakcije
Reakcije koje rezultiraju zamjenom jednog atoma ili skupine atoma u izvornoj molekuli (supstratu) drugim atomima ili skupinama atoma nazivaju se supstitucijskim reakcijama.
Reakcije supstitucije uključuju zasićene i aromatske spojeve kao što su alkani, cikloalkani ili areni.
Navedimo primjere takvih reakcija.
Pod utjecajem svjetlosti, atomi vodika u molekuli metana mogu se zamijeniti atomima halogena, na primjer, atomima klora:
$CH_4+Cl_2→CH_3Cl+HCl$
Drugi primjer zamjene vodika halogenom je pretvorba benzena u bromobenzen:

Jednadžba za ovu reakciju može se napisati drugačije:

U ovom obliku zapisa, reagensi, katalizator i reakcijski uvjeti napisani su iznad strelice, a anorganski produkti reakcije napisani su ispod nje.
Reakcije adicije
Reakcije u kojima se dvije ili više molekula tvari koje reagiraju spoje u jednu nazivaju se reakcijama adicije.
Nezasićeni spojevi kao što su alkeni ili alkini podliježu reakcijama adicije.
Ovisno o tome koja molekula djeluje kao reagens, razlikuju se hidrogenacija (ili redukcija), halogenacija, hidrohalogenacija, hidratacija i druge reakcije adicije. Svaki od njih zahtijeva određene uvjete.
1. Hidrogeniranje— reakcija adicije molekule vodika preko višestruke veze:
$CH_3(-CH=)↙(\text"propen")CH_2+H_2(→)↖(Pt)CH_3(-CH_2-)↙(\text"propan")-CH_3$
2.Hidrohalogeniranje— reakcija adicije vodikovog halida (hidrokloriranje):
$(CH_2=)↙(\text"eten")CH_2+HCl→CH_3(-CH_2-)↙(\text"kloroetan")-Cl$
3.Halogeniranje- reakcija adicije halogena:
$(CH_2=)↙(\text"eten")CH_2+Cl_2→(CH_2Cl-CH_2Cl)↙(\text"1.2-dikloroetan")$
4. Polimerizacija- posebna vrsta adicijske reakcije u kojoj se molekule tvari male molekulske mase međusobno spajaju i tvore molekule tvari vrlo velike molekulske mase - makromolekule.
Reakcije polimerizacije su procesi spajanja velikog broja molekula tvari niske molekulske mase (monomera) u velike molekule (makromolekule) polimera.
Primjer reakcije polimerizacije je proizvodnja polietilena iz etilena (etena) pod utjecajem ultraljubičastog zračenja i radikalnog inicijatora polimerizacije $R:$
$(nCH_2=)↙(\text"eten")CH_2(→)↖(\text"UV svjetlo, R")((...-CH_2-CH_2-...)_n)↙(\text" polietilen ")$
Kovalentna veza najkarakterističnija za organske spojeve nastaje preklapanjem atomskih orbitala i stvaranjem zajedničkih elektronskih parova. Kao rezultat toga, formira se orbitala zajednička za dva atoma, u kojoj se nalazi zajednički elektronski par. Kad se veza prekine, sudbina ovih zajedničkih elektrona može biti drugačija.
Vrste reaktivnih čestica u organskoj kemiji
Orbitala s nesparenim elektronom koji pripada jednom atomu može se preklapati s orbitalom drugog atoma koji također sadrži nespareni elektron. U tom slučaju nastaje kovalentna veza duž mehanizam razmjene:
$H + H→H:H,$ ili $H-H$
Mehanizam razmjene Stvaranje kovalentne veze ostvaruje se ako zajednički elektronski par nastane od nesparenih elektrona koji pripadaju različitim atomima.
Proces suprotan stvaranju kovalentne veze mehanizmom izmjene je cijepanje veze, pri čemu svaki atom gubi po jedan elektron. Kao rezultat toga nastaju dvije nenabijene čestice koje imaju nesparene elektrone:
Takve se čestice nazivaju slobodni radikali.
Slobodni radikali- atomi ili skupine atoma koji imaju nesparene elektrone.
Reakcije koje se odvijaju pod utjecajem i uz sudjelovanje slobodnih radikala nazivaju se reakcijama slobodnih radikala.
U tečaju anorganske kemije to su reakcije vodika s kisikom, halogeni i reakcije izgaranja. Imajte na umu da reakcije ove vrste karakterizira velika brzina i oslobađanje velike količine topline.
Kovalentna veza može nastati i donor-akceptorskim mehanizmom. Jedna od orbitala atoma (ili aniona) koji sadrži usamljeni elektronski par preklapa se s praznom orbitalom drugog atoma (ili kationa) koji ima nezauzetu orbitalu, te se formira kovalentna veza, na primjer:
$H^(+)+(:O-H^(-))↙(\text"akceptor")→(H-O-H)↙(\text"donator")$
Prekidanje kovalentne veze rezultira stvaranjem pozitivno i negativno nabijenih vrsta; budući da u ovom slučaju oba elektrona iz zajedničkog elektronskog para ostaju s jednim od atoma, drugi atom ima nepopunjenu orbitalu:
$R:|R=R:^(-)+R^(+)$
Razmotrimo elektrolitičku disocijaciju kiselina:
$H:|Cl=H^(+)+Cl^(-)$
Lako se može pretpostaviti da će čestica koja ima usamljeni elektronski par $R:^(-)$, tj. negativno nabijeni ion, biti privučena pozitivno nabijenim atomima ili atomima na kojima postoji barem djelomičan ili efektivni pozitivni naboj. Čestice s usamljenim parovima elektrona nazivaju se nukleofilni agensi (jezgra- jezgra, pozitivno nabijeni dio atoma), tj. "prijatelji" jezgre, pozitivan naboj.
Nukleofili ($Nu$)- anioni ili molekule koje imaju usamljeni par elektrona koji su u interakciji s dijelovima molekula koji imaju efektivni pozitivni naboj.
Primjeri nukleofila: $Cl^(-)$ (kloridni ion), $OH^(-)$ (hidroksidni anion), $CH_3O^(-)$ (metoksidni anion), $CH_3COO^(-)$ (acetatni anion ).
Čestice koje imaju nepopunjenu orbitalu, naprotiv, težit će je ispuniti i stoga će biti privučene dijelovima molekula koji imaju povećanu gustoću elektrona, negativan naboj i usamljeni elektronski par. Oni su elektrofili, “prijatelji” elektrona, negativnog naboja ili čestice s povećanom gustoćom elektrona.
elektrofili- kationi ili molekule koje imaju nepopunjenu elektronsku orbitalu, nastojeći je ispuniti elektronima, jer to dovodi do povoljnije elektronske konfiguracije atoma.
Primjeri elektrofila: $NO_2$ (nitro skupina), -$COOH$ (karboksilna), -$CN$ (nitrilna skupina), -$SON$ (aldehidna skupina).
Nije svaka čestica s nepopunjenom orbitalom elektrofil. Na primjer, kationi alkalnih metala imaju konfiguraciju inertnih plinova i nemaju tendenciju stjecanja elektrona, budući da imaju nizak afinitet prema elektronima. Iz ovoga možemo zaključiti da, unatoč prisutnosti nepopunjene orbitale, takve čestice neće biti elektrofili.
Osnovni mehanizmi reakcije
Identificirali smo tri glavne vrste reagirajućih vrsta - slobodni radikali, elektrofili, nukleofili - i tri odgovarajuće vrste reakcijskih mehanizama:
- slobodni radikali;
- elektrofilni;
- nukleofilni.
Osim klasifikacije reakcija prema tipu čestica koje reagiraju, u organskoj kemiji postoje četiri vrste reakcija koje se temelje na principu promjene sastava molekula: adicija, supstitucija, odvajanje ili eliminacija (od lat. eliminaue- ukloniti, odcijepiti) i preuređivanja. Budući da se adicija i supstitucija mogu dogoditi pod utjecajem sve tri vrste reaktivnih vrsta, može se razlikovati nekoliko osnovnih reakcijskih mehanizama.
1.Zamjena slobodnih radikala:
$(CH_4)↙(\text"metan")+Br_2(→)↖(\text"UV svjetlo")(CH_3Br)↙(\text"brommetan")+HBr$
2. Dodatak slobodnih radikala:
$nCH_2=CH_2(→)↖(\text"UV svjetlo,R")(...-CH_2-CH_2-...)_n$
3. Elektrofilna supstitucija:

4. Elektrofilna veza:
$CH_3-(CH=)↙(\text"propen")CH_2+HBr(→)↖(\text"otopina")(CH_3-CHBr-CH_3)↙(\text"2-bromopropan")$
$CH_3(-C≡)↙(\text"propyne")CH+Cl_2(→)↖(\text"otopina")(CH_3-CCl=CHCl)↙(\text"1,2-diklorpropen")$
5. Nukleofilna adicija:

Osim toga, razmotrit ćemo reakcije eliminacije koje se odvijaju pod utjecajem nukleofilnih čestica - baza.
6. Eliminacija:
$SH_3-CHBr-CH_3+NaOH(→)↖(\text"alkoholna otopina")CH_3-CH=CH_2+NaBr+H_2O$
Pravilo V.V. Markovnikova
Posebnost alkena (nezasićenih ugljikovodika) je njihova sposobnost podvrgavanja reakcijama adicije. Većina ovih reakcija odvija se prema mehanizmu elektrofilna adicija.
Hidrohalogenacija (adicija halogenog vodika):
$SH_3(-CH-)↙(\text"propen")CH_2+HBr→CH_3(-CHBr-CH_3)↙(\text"2-brompropan")$
Ova reakcija se pokorava Pravilo V.V. Markovnikova: Kada se halogenovodik doda alkenu, vodik se dodaje više hidrogeniranom ugljikovom atomu, tj. atom na kojem je više atoma vodika, a halogen manje hidrogeniranom.
) veze drugog kemijskog spoja. Povezivanje se može izvesti ili povezivanjem ugljik-ugljik, i komunikacijom heteroatom ugljika. Reakcije adicije označene su engleskim slovima "Oglas".
Opći pogled na reakcije adicije veze ugljik-ugljik:
Opći pogled na reakcije adicije veze ugljik-kisik:
Tipično se naziva reagens kojem se događa dodavanje supstrat, i drugi ( "X-Y") - napadajući reagens.
Primjer adicijske reakcije je bromiranje etilena:

Reakcije adicije često su reverzibilne kada su uparene s reakcijama eliminacije, pa treba imati na umu da je mehanizam za takvu "uparenu" reakciju adicije-eliminacije općenit.
Ovisno o prirodi napadajuće čestice i mehanizmu reakcije, razlikuju se nukleofilna, elektrofilna, radikalska ili sinkrona adicija.
Nukleofilne adicijske reakcije
U reakcijama nukleofilne adicije čestica koja napada je nukleofil, odnosno negativno nabijena čestica ili čestica sa slobodnim elektronskim parom.
Opći prikaz reakcija nukleofilne adicije:
Označene su nukleofilne adicijske reakcije "Oglas N".
Reakcije adicije nukleofilne veze C=C su dosta rijetki, najrašireniji i praktični značaj ima komunikacijsko povezivanje C=O :
Među reakcijama nukleofilne adicije, gornji bimolekularni mehanizam u dva koraka je najčešći Oglas N 2: Prvo, nukleofil se polako spaja duž višestruke veze kako bi formirao karbanion, koji u drugoj fazi brzo napada elektrofilna vrsta.
Reakcije elektrofilne adicije
U reakcijama elektrofilne adicije čestica koja napada je elektrofil, odnosno pozitivno nabijena čestica, najčešće proton H+, ili čestica s nedostatkom elektrona.
Opći prikaz reakcija elektrofilne adicije:
Označene su elektrofilne adicijske reakcije "Oglas E".
Reakcije elektrofilne adicije raširene su među reakcijama nezasićenih ugljikovodika: alkena, alkina i diena.
Primjer takvih reakcija je hidratacija alkena:
Elektrofilno vezivanje heteroatom ugljika je također prilično česta, a najčešće je takva veza C=O:



Među reakcijama elektrofilne adicije, gornji bimolekularni mehanizam u dva koraka je najčešći. Oglas E 2: Prvo, elektrofil se polako pridružuje višestrukoj vezi kako bi se formirao karbokation, koji u drugoj fazi prolazi nukleofilni napad.
Reakcije radikalske adicije
U reakcijama adicije radikala, napadačka čestica su slobodni radikali.
Označene su reakcije radikalske adicije "Oglas R".
Reakcije radikalske adicije obično se javljaju umjesto reakcija elektrofilne adicije u prisutnosti izvora slobodnih radikala:

Sinkrone reakcije spajanja
U nekim slučajevima dolazi do spajanja višestrukom vezom uz istovremeni napad na oba atoma, što onemogućuje određivanje prioriteta napada. Ovaj mehanizam se zove sinkrona veza. Sinkrone adicijske reakcije dovode do stvaranja cikličkih produkata, zbog čega se često nazivaju cikloadicija.
Bilješke
| Kemijske reakcije u organskoj kemiji | |
|---|---|
| Supstitucijske reakcije | Reakcije nukleofilne supstitucije Reakcije elektrofilne supstitucije Reakcije radikalne supstitucije |
| Reakcije adicije | Nukleofilne adicijske reakcije Elektrofilne adicijske reakcije Reakcije radikalne adicije Reakcije sinkrone adicije |
| Reakcije eliminacije | Reakcije heterolitičke eliminacije. Reakcije pericikličke eliminacije. Reakcije eliminacije radikala |
| Reakcije pregrupiranja | Nukleofilne preraspodjele Elektrofilne preraspodjele Radikalne preraspodjele |
| Reakcije oksidacije i redukcije | Reakcije oksidacije Reakcije redukcije |
| ostalo | Imenovane reakcije u organskoj kemiji |
Zaklada Wikimedia. 2010.
Pogledajte što su "adicijske reakcije" u drugim rječnicima:
polimer proizveden reakcijom adicije- — EN adicijski polimer Polimer nastao lančanom adicijom nezasićenih monomernih molekula, poput olefina, jedne s drugom bez stvaranja nusproizvoda, poput vode;… … Vodič za tehničke prevoditelje
- (engleski adiciona elektrofilna reakcija) adicijska reakcija u kojoj napad u početnoj fazi vrši elektrofilna čestica koja je pozitivno nabijena ili ima manjak elektrona. U završnoj fazi, rezultirajuća... ... Wikipedia
- (engleski adiciona nukleofilna reakcija) adicijske reakcije u kojima napad u početnoj fazi vrši nukleofilna čestica koja je negativno nabijena ili ima slobodni elektronski par. U završnoj fazi, rezultirajuća... ... Wikipedia
- (engleski adiciona radikalna reakcija) adicijska reakcija u kojoj napad vrše slobodni radikali, čestice koje sadrže jedan ili više nesparenih elektrona. U isto vrijeme, radikali mogu napadati i druge radikale i... ... Wikipediju
Reakcije adicije u kojima su oba atoma višestruke veze napadnuta istovremeno. Drugi naziv za ovu vrstu reakcije je reakcija cikloadicije, budući da su krajnji produkt takvih reakcija ciklički supstrati. Postoje dvije... ... Wikipedije
- (eng. nucleophilic substitution reaction) supstitucijske reakcije u kojima napad provodi nukleofilni reagens koji nosi usamljeni elektronski par. Odlazeća skupina u reakcijama nukleofilne supstitucije naziva se nukleofuga. Sve... Wikipedia
Ugljikovodici
Predavanje br.13
Enol koji nastaje tijekom hidratacije alkina ne može se izolirati, budući da je tautomerna ravnoteža uvijek jako pomaknuta prema keto obliku.
Preraspodjela enola u keto oblik događa se zbog velike polarnosti O-H veze, što dovodi do lakog odvajanja protona hidroksilne skupine.
Proton se tada može vezati ili natrag na kisik enolatnog aniona ili na ugljik. Ako se veže za atom ugljika, nastaje manje kiseli spoj u kojem proton ne pokazuje izraženu tendenciju disocijacije. Tako se keto oblik nakuplja u reakcijskoj smjesi.
Postoji samo jedan slučaj kada se u Kucherovoj reakciji formira aldehid - hidratacija samog acetilena. Sve druge reakcije proizvode ketone.
Hidratacija propina rezultira acetonom, a ne propionaldehidom.
Nukleofilne adicijske reakcije. Alkini mogu dodati nukleofilne reagense u prisutnosti katalizatora. Kao rezultat toga nastaju vinilni derivati različitih klasa. Te se reakcije nazivaju reakcijama vinilacije.
Gore su prikazane neke reakcije nukleofilne adicije na alkine. Često se koriste za pripremu spojeva koji služe kao monomeri u sintezi BMC. Na primjer, reakcija acetilena s n-butanol dovodi do butil vinil etera, čijom polimerizacijom nastaje vinilin (Shostakovsky balzam) vrijedan je lijek.
Oksidacija. Kao i svi organski spojevi koji sadrže više ugljik-ugljik veza, alkini se lako oksidiraju različitim oksidirajućim sredstvima, kao što je kalijev permanganat ili kalijev dikromat. Reakcija se odvija potpunim cijepanjem trostruke veze i stvaranjem karboksilnih kiselina (alkini s terminalnom trostrukom vezom tvore karboksilnu kiselinu i ugljikov dioksid).
Ove reakcije mogu se koristiti za određivanje strukture alkina.
Neka oksidacijska sredstva, kao što je selenijev dioksid, omogućuju selektivnu oksidaciju alkina, tijekom koje se cijepaju samo p-veze. Pri tome se disupstituirani alkini pretvaraju u a-diketone, a monosupstituirani alkini u a-keto kiseline.
Polimerizacija alkina. U nizu alkina, reakcije od najvećeg interesa su di-, trimerizacija i ciklotri- i ciklotetramerizacija.
Linearni di- i trimeri acetilena, koji su od velike industrijske važnosti, mogu se dobiti u prisutnosti monovalentnih bakrenih soli.
Vinilacetilen je polazni spoj za sintezu kloroprena (2-klorobutadien-1,3), čijom polimerizacijom nastaje kloropren kaučuk.
Ciklotrimerizaciju acetilena koja dovodi do benzena otkrio je 1866. M. Berthelot, a modificirao N.D. Zelinsky i B.A. Kazanskog (1922).
Ciklotetramerizaciju je otkrio W. Reppe (1949).
; u tom slučaju dolazi do kidanja jedne p-veze i stvaranja jedne ili dvije s-veze. Za označavanje pridruživanja reakcije koristite simbol Ad (od engleskog dodatka - pristupanje); Za cikloadicije se takav simbol ne koristi.
Ovisno o prirodi supstrat razlikovati pristupe reakcije izoliranim ili spojenim višestruke veze, npr.: C=C, C=C, C=C-C=C, C=O, C=N, C=N.Postoje homolitičke otopine. (Ad R) i heterolitički. pristupanje. Potonji ovisno o optužbi napadača reagens podijeljen na rajone elektrof. (Ad E) i nukleof. (Ad N)prilozi. Ponašanje reagens ovisi o vrsti supstrat i uvjeti za obavljanje r-cije (r-rezident, prisutnost katalizator, učinak UV zračenja itd.). Mn. reagensi pod različitim uvjetima mogu pokazivati različite vrste reakcija sposobnosti, npr. halogeni može djelovati kao radikal, elektrof. pa čak i nukleof. agenti.
Naib. pristupi proučavani reakcije Po višestruke veze ugljik-ugljik. Ti se procesi odvijaju prema stupnjevitom (etapnom) ili sinkronom (koordiniranom) mehanizmu. Kod stupnjevitog mehanizma, prva faza je napad nukleofila, elektrofila ili slobodnog. radikalno, drugo - rekombinacija rezultirajući srednji s pozitivnim, negativnim ili neutralna čestica, na primjer:
Elektrof. odnosno nukleof. čestice ne moraju biti ioni; mogu biti dio (skupina) koji privlači ili donira elektron molekule. Ad N reakcije moguće su samo s C=C vezama aktiviranim supstituentima koji privlače elektrone; Za implementaciju Ad E potrebne su ili nesupstituirane C=C veze ili aktivirane supstituentima koji doniraju elektron. Za otopinu Ad R, priroda supstituenta na C=C vezi nije od velike važnosti.
Stereochem. rezultat postupnog dodavanja ovisi o mehanizmu reakcije i prirodi spojeva koji reagiraju. Da, elektrof. pridruživanje olefini može nastaviti kao sin-pričvršćivanje - čestice Y i W napadaju molekula s jedne strane aviona dvostruka veza ili kao anti-pričvršćivanje - čestice napadaju s različitih strana ravnine; u nekim slučajevima, reakcije su nestereospecifične. Nucleof. pristupanje uz sudjelovanje karbanioni odvija se u pravilu nestereospecifično. Po učlanjenju reakcije Po trostruke veze sin adicija dovodi do cis izomera, antiadicija dovodi do trans izomera.
U slučaju sinkronog mehanizma, napad na oba atom C se provodi istovremeno i reakcija se odvija kao dipolarna adicija (vidi Cikloadicija), dok adicija reakcije dvostruko ili trostruka veza idi kao sin-pridruži se (vidi, na primjer, Reppeove reakcije).
P ponovne veze reakcije konjugatom dvostruke veze, odvijajući se postupnim mehanizmom, dovode do stvaranja 1,2- i 1,4-adicijskih proizvoda:
Sinkroni 1.4-priključak na dieni trag curi. put:

Posebna vrsta adicijske reakcije je konjugirana adicija. Tijek takvih reakcija popraćen je vezivanjem otopine (ili posebno dodane reagens) u završnoj fazi procesa. Na primjer, konjugirani elektrof. pristupanje halogeni Do alkeni u CH 3 COOH dovodi, zajedno s 1,2-dihalogenidima, do b-acetoksialkil halogenida:
Primjeri konjugiranog nukleofa. pristupi - Michaelova reakcija i interakcija aktiviran alkeni s cijanidnim anionom u otopinama protona SH:

U slučaju pridruživanja reakcije Po višestruke veze ugljik-hetero-atom, u koji će se staviti. naboj je lokaliziran na atom C (C=O, C=N, C=N i C=S veze), nukleofili se uvijek vežu za atom C, a elektrofili na heteroatom. U max. nukleofilni dodaci su proučavani do te mjere reakcije na karbonilnoj skupini:

P ponovne veze reakcija Po atom C može biti jedna od faza supstitucije u aromatskim. red, na primjer: