Длины волн спектральных линий водорода. Абсолютный минимум. Как квантовая теория объясняет наш мир
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем - систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы Не + , Li 2+), а также теоретически вычислить постоянную Ридберга.
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение (208.1) m e v 2 /r=Zе 2 /(4 0 r 2), предложенное Резерфордом, и уравнение (210.1), получим выражение для радиуса n-й стационарной орбиты:
где n=1, 2, 3, ... . Из выражения (212.1) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода (Z=1) радиус первой орбиты электрона при n=1, называемый первым боровским радиусом (а), равен

что соответствует расчетам на основании кинетической теории газов. Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально. Такой величиной является энергия, излучаемая и поглощаемая атомами водорода.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (m e v 2 /2) и потенциальной энергии в электростатическом поле ядра (-Zе 2 /(4 0 r)):

(учли, что m e v 2 /2 = 1 / 2 Ze2(4 0 r) (см.
(208.1)). Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:

где знак минус означает, что электрон находится в связанном состоянии.
Из формулы (212.3) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения п. Целое число n в выражении (212.3), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n=1 является основным (нормальным) состоянием; состояния с /г> 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными.
Придавая n различные целочисленные значения, получим для атома водорода

(Z=1), согласно формуле (212.3), возможные уровни энергии, схематически представленные на рис. 294. Энергия атома водорода с увеличением n возрастает (уменьшается ее отрицательная величина) и энергетические уровни сближаются к границе, соответствующей значению n = . Атом водорода обладает, таким образом, минимальной энергией (Е 1 = - 13,55 эВ) при n = 1 и максимальной (E 1 =0) при n= (при удалении электрона из атома). Следовательно, значение E =0 соответствует ионизации атома (отрыву от него электрона).
Согласно второму постулату Бора (см. (210.2)), при переходе атома водорода (Z=1) из стационарного состояния n с большей энергией в стационарное состояние m с меньшей энергией испускается квант
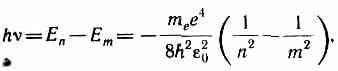
откуда частота излучения

R=m e e 4 /(8h 3 2 0 ).
Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода (см. §209). Это совпадение убедительно доказывает правильность полученной Бором формулы
(212.3) для энергетических уровней водородоподобной системы.
Подставляя, например, в формулу
(212.4) m=1 и n=2, 3, 4, ..., получим группу линий, образующих серию Лаймана (см. § 209) и соответствующих переходам электронов с возбужденных уровней (n=2, 3, 4, ...) на основной (m=1). Аналогично, при подстановке m=2, 3, 4, 5,
6 и соответствующих им значений n получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри (часть из них схематически представлена на рис. 294), описанные в § 209. Следовательно, по теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из возбужденных состояний, расположенных выше данного.
Спектр поглощения атома водорода является линейчатым, но содержит только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n = 1), то при сообщении атомам извне определенной энергии могут наблюдаться лишь переходы
атомов из основного состояния в возбужденные (возникает серия Лаймана).
Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой - основывается на квантовых постулатах). Она рассмотрела спектры атома водорода и водородоподобных систем и вычислила частоты спектральных линий, однако не смогла объяснить их интенсивности и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра атома гелия - одного из простейших атомов, непосредственно следующего за атомом водорода.
Контрольные вопросы
Почему ядерная модель атома оказалась несостоятельной?
Почему из различных серий спектральных линий атома водорода первой была изучена серия Бальмера?
Какой смысл имеют числа m и n в обобщенной формуле Бальмера?
Чему равна частота излучения атома водорода, соответствующая коротковолновой границе серии Брэкета?
Разъясните смысл постулатов Бора. Как с их помощью объясняется линейчатый спектр атома? На каких участках кривой рис. 293 наблюдаются упругие и на каких - неупругие столкновения электронов с атомами?
Какие основные вводы можно сделать на основании опытов Франка и Герца? Пользуясь моделью Бора, укажите спектральные линии, которые могут возникнуть при переходе атома водорода в состояния с n=3 и n=4.
Нанесите на шкалу длин волн три линии каждой из первых двух спектральных серий атома водорода.
Почему спектр поглощения атома водорода содержит только серию Лаймана? Покажите, что формулу (212.3) можно записать в виде E n =-13,55/n 2 , где E выражается в электрон-вольтах.
Задачи
27.1. Определить максимальную и минимальную энергии фотона в ультрафиолетовой серии спектра атома водорода (серии Лаймана).
27.2. Определить длину волны, соответствующую границе серии Бальмера.
27.3. Используя теорию Бора, определить орбитальный магнитный момент электрона, движущегося по второй орбите атома водорода.
27.4. Используя теорию Бора, определить изменение орбитального механического момента электрона при переходе его из возбужденного состояния (n=2) в основное с испусканием фотона с длиной волны =1,212 10 -7 м. [L = h=1,05 10 -3 4 Дж с]
27.5. Определить потенциал ионизации атома водорода.
27.6. Основываясь на том, что энергия ионизации атома водорода E i =13,6 эВ, определить второй потенциал возбуждения этого атома.
27.7 . Основываясь на том, что энергия ионизации атома водорода £",= 13,6 эВ, определить в электрон-вольтах энергию фотона, соответствующую самой длинноволновой линии серии Лаймана.
* И. Ридберг (1854-1919) - шведский ученый, специалист в области спектроскопии.
Исследования спектров излучения разреженных газов (т. е. спектров излучения отдельных атомов) показали, что каждому газу присущ вполне определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома - атома водорода.
Швейцарский ученый И. Бальмер (1825-1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра:
где R"= 1,10 10 7 м -1 - постоянная Ридберга . Так как v = c/, то формула
(209.1) может быть переписана для частот:

где R=R"с=3,29 10 15 с -1 также постоянная Ридберга.
Из выражений (209.1) и (209.2) вытекает, что спектральные линии, отличающиеся различными значениями n , образуют группу или серию линий, называемую серией Бальмера. С увеличением n линии серии сближаются; значение n = определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.
В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана:

В инфракрасной области спектра были также обнаружены: серия Пашена
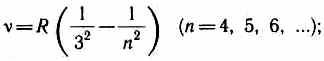
серия Брэкета
серия Пфунда

серия Хэмфри

Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:

где m имеет в каждой данной серии постоянное значение, m= 1, 2, 3, 4, 5, 6 (определяет серию), n принимает целочисленные значения начиная с m+1 (определяет отдельные линии этой серии).
Исследование более сложных спектров - спектров паров щелочных металлов (например, Li, Na, К) - показало, что они представляются набором незакономерно расположенных линий. Ридбергу удалось разделить их на три серии, каждая из которых располагается подобно линиям бальмеровской серии.
Приведенные выше сериальные формулы подобраны эмпирически и долгое время не имели теоретического обоснования, хотя и были подтверждены экспериментально с очень большой точностью. Приведенный выше вид сериальных формул, удивительная повторяемость в них целых чисел, универсальность постоянной Ридберга свидетельствуют о глубоком физическом смысле найденных закономерностей, вскрыть который в рамках классической физики оказалось невозможным.
§210. Постулаты Бора
Первая попытка построить качественно новую - квантовую - теорию атома была предпринята в 1913 г. датским физиком Нильсом Бором (1885-1962). Он поставил перед собой цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
m e vr n = nh (n = 1, 2, 3, ...), (210.1)
где m e - масса электрона, v - его скорость по n-й орбите радиуса r n , h=h/(2). Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
h =E n -E m , (210.2)
равной разности энергий соответствующих стационарных состояний (E n и E m - соответственно энергии стационарных состояний атома до и после излучения (поглощения)). При E m < E n происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при E m >E n - его поглощение (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных частот v = = (E n -E m )/h квантовых переходов и определяет линейчатый спектр атома.
Его спектральные серии наиболее хорошо изучены. Они хорошо подчиняются формуле Ридберга :
1 λ = R (1 n ′ 2 − 1 n 2) {\displaystyle {\frac {1}{\lambda }}=R\left({\frac {1}{{n"}^{2}}}-{\frac {1}{n^{2}}}\right)} ,где R = 109 677 см −1 - постоянная Ридберга для водорода, n′ - основной уровень серии.
Спектральные линии, возникающие при переходах на основной энергетический уровень, называются резонансными , все остальные - субординатными .
Физика спектральных серий
Атом водорода состоит из электрона, вращающегося вокруг ядра. Электромагнитная сила между электроном и протоном ядра вызывает наличие набора квантовых состояний электрона, каждое из которых имеет свою энергию. Эти состояния изображаются на Боровской модели как отдельные орбиты электрона. Каждой орбите или состоянию соответствует целое число n .
Спектральное излучение происходит, когда электрон переходит из более высокого энергетического состояния в более низкое. Состояние с более низкой энергией обозначается как n′ , а с более высокой n . Энергия излучённого фотона соответствует разнице двух состояний. Так как энергия каждого состояния всегда одинакова, разница между ними тоже всегда одинакова и переход всегда будет излучать фотон с постоянной энергией.
Спектральные линии сгруппированы в серии по n′ . Линии названы последовательно от самой низкочастотной греческими буквами. Например, линия 2 → 1 называется линией Лаймана-альфа (Ly-α), а 7 → 3 Пашена-дельта(Pa-δ).
У водорода существуют линии, не попадающие в эти серии, как, например, 21 сантиметровая линия. Эти линии соответствуют более редким процессам в атоме, таким как сверхтонкие переходы. Тонкая структура также влечёт единые спектральные линии, появляющиеся в виде двух и более тесно сгруппированных тонких линий, из-за релятивистских эффектов.
Серия Лаймана
Открыта Т. Лайманом в 1906 году. Все линии серии находятся в ультрафиолетовом диапазоне. Серия соответствует формуле Ридберга при n′ = 1 и n = 2, 3, 4, … ; линия L α = 1216 Å является резонансной линией водорода. Граница серии - 911,8 Å .
Серия Бальмера
Открыта И. Я. Бальмером в 1885 году. Первые четыре линии серии находятся в видимом диапазоне и были известны задолго до Бальмера, который предложил эмпирическую формулу для их длин волн и на её основе предсказал существование других линий этой серии в ультрафиолетовой области. Серия соответствует формуле Ридберга при n′ = 2 и n = 3, 4, 5, … ; линия H α = 6565 Å , граница серии - 3647 Å .
Серия Пашена
Серия Брэккета
Открыта Ф. С. Брэккетом в 1922 году. Все линии серии находятся в ближнем инфракрасном диапазоне. Серия соответствует формуле Ридберга при n′ = 4 и n = 5, 6, 7, … ; линия B α = 40 522 Å . Граница серии - 14 588 Å .
Серия Пфунда
Открыта А. Г. Пфундом в 1924 году. Линии серии находятся в ближнем (часть в среднем) инфракрасном диапазоне. Серия соответствует формуле Ридберга при n′ = 5 и n = 6, 7, 8, … ; линия Pf α = 74 598 Å . Граница серии - 22 794 Å .
Спектральные линии водорода
Первая попытка объяснить линейчатый спектр водорода в видимом диапазоне была предпринята в 1885 году школьным учителем и математиком Иоганном Бальмером (1825–1898). Бальмер заметил, что частоты f этих линий в видимой части спектра можно описать формулой
f ~(1/2 2)-(1/n 2).
Символ ~ означает пропорциональность, то есть указывает на наличие постоянного множителя, о котором говорится ниже. В этом уравнении n - целое число больше 2, то есть 3, 4, 5 и т. д.
Эти линии в видимой части спектра называются бальмеровской серией. Позднее были открыты линии в ультрафиолетовой и инфракрасной частях спектра. Их назвали сериями Лаймана и Пашена соответственно в честь их первооткрывателей - американского физика и спектроскописта Теодора Лаймана (1874–1954) и немецкого физика Луиса Карла Генриха Фридриха Пашена (1865–1947). В 1888 году шведский физик и спектроскопист Йоханнес Ридберг (1854–1919) опубликовал формулу, которая описывала все спектральные линии, видимые в излучении водородной дуговой лампы и в спектрах поглощения солнечного и звёздного света. Формула Ридберга для частоты спектральных линий водорода имеет вид
f =R H [(1/n 1 2)-(1/n 2 2)],
где n 1 - целые числа, начиная с 1, а n 2 - другие целые числа, которые должны быть больше n 1 . Значение n 1 =1 даёт лаймановскую серию, n 1 =2 - бальмеровскую, n 1 =3 - серию Пашена.
Константа R H называется постоянной Ридберга для атома водорода. Её значение составляет R H =109677,6 см -1 и выражено числом волн (см -1). При использовании этого значения в формуле Ридберга частоты спектральных линий, определяемые целыми числами n 1 и n 2 , выражаются волновыми числами. Для перевода результата в герцы надо умножить полученное значение на скорость света, то есть на 3 10 10 см /сек . Чтобы найти длину волны спектральной линии, надо взять величину, обратную частоте, выраженной числом волн, то есть разделить единицу на частоту, выраженную числом волн. Например, если n 1 =2, а n 2 =3, то
f =R H [(1/2 2)-(1/3 2)] = R H [(1/4)-(1/9)] = 1,52 10 4 см -1
представляет собой частоту, выраженную числом волн. Обратная величина для этого числа составляет 6,56 10 -5 см = 656 10 -9 м = = 656 нм . Таким образом, длина волны составляет 656 нм - это красная линия в серии Бальмера, изображённой на рис. 9.2.
При обсуждении рис. 8.7 уже говорилось о дискретности оптических переходов между квантовыми энергетическими уровнями для частицы в ящике. На рис. 8.7 показаны переходы между состояниями частицы в ящике, при которых n =1 превращается в n =2 и n =1 превращается в n =3. В связи с этим не должен стать большим сюрпризом тот факт, что оптические переходы в атоме водорода могут соответствовать дискретному набору частот, которые зависят от целых чисел. Однако в 1888 году, когда была получена формула Ридберга, оставалось ещё 12 лет до появления идеи квантования энергетических уровней, с помощью котороторых связаны посредством целых чисел по формуле Ридберга, можно понять как оптические переходы между дискретными энергетическими уровнями, связанные с атомом водорода.
Рис. 9.3. Схемы некоторых энергетических уровней, порождающих серии Лаймана и Бальмера линий эмиссии водорода. Стрелки, направленные вниз, показывают, как свет испускается водородом, например, в дуговой лампе. При поглощении, дающем тёмные линии на рис. 9.2, стрелки были бы направлены вверх. Интервалы между уровнями показаны условно, а не в масштабе
Некоторые энергетические уровни, благодаря которым возникают серии Лаймана и Бальмера, изображены на рис. 9.3. Здесь стрелки, направленные вниз, соответствуют эмиссионным линиям, которые наблюдаются у водородной дуговой лампы. Атом водорода, который первоначально находится на более высоком энергетическом уровне, со временем переходит на более низкий уровень. Энергия при этом сохраняется за счёт испускания фотона. Для сохранения энергии фотон должен нести энергию, равную разности между первоначальным, более высоким энергетическим уровнем и конечным уровнем с более низкой энергией. Наименьшее возможное значение n 1 в формуле Ридберга равно 1, а n 2 должно быть больше n 1 . Стрелка, помеченная 2–1, соответствует излучению при переходе с уровня n =2 на уровень n =1.
Следующая по величине энергия излучения в лаймановской серии получается при переходе с уровня n =3 на уровень n =1. В формуле Ридберга следующее возможное значение для n 1 равно 2, а n 2 должно быть больше n 1 . Поэтому наименьшая энергия линии излучения в серии Бальмера отмечена как 3–2. Когда атом водорода, находящийся на уровне n =3, переходит на уровень n =2, сохранение энергии обеспечивается испусканием фотона с длиной волны 656 нм . Когда свет падает на атомы водорода, происходит поглощение, которое можно было бы изобразить на той же диаграмме стрелками, направленными вверх.






