Относительная атомная масса химических элементов
Занятие 4. Химические элементы. Знаки химических элементов. Относительная атомная масса.
Химический элемент - совокупность атомов одного вида.
Почему одинаковые атомы были названы именно так? Слово «элемент» (лат. elementum) использовалось еще в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»).
ХИМИЧЕСКИЙ ЯЗЫК
Человечество использует много разных языков. Кроме естественных языков (японского, английского, русского – всего более 2,5 тысяч), существуют еще и искусственные языки, например, эсперанто. Среди искусственных языков выделяются языки различных наук. Так, в химии используется свой, химический язык. Химический язык – система условных обозначений и понятий, предназначенная для краткой, ёмкой и наглядной записи и передачи химической информации. Сообщение, написанное на большинстве естественных языков, делится на предложения, предложения – на слова, а слова – на буквы.
Мы с вами будем говорить особым, химическим языком. В нем, как и в нашем родном, русском, мы выучим вначале буквы — химические символы, затем научимся писать на их основе слова — формулы и далее, с помощью последних, — предложения — уравнения химических реакций:
Болгарские просветители Кирилл и Мефодий являются авторами славянской письменности-алфавита. А вот отцом химической письменности является шведский ученый Й. Я. Берцелиус, который предложил в качестве букв — символов химических элементов использовать начальные буквы их латинских названий, или, если с этой буквы начинаются названия нескольких элементов, то — добавлять к начальной букве еще одну из последующих букв названия.
Химические знаки (символы химические) - буквенные обозначения химических элементов. Состоят из первой или из первой и одной из следующих букв латинского названия элемента,напр., углерод - С (Carboeum), кальций - Ca (Calcium), кадмий - Cd…
Символ химического элемента – это условное обозначение химического элемента.
Историческая справка: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца ( ☉ , золото), Луны (☽ , серебро), Юпитера (♃ , олово),Венеры (♀, медь), Сатурна (♄ , свинец), Меркурия (☿ , ртуть),Марса (♁ , железо).
Металлы, открытые в XV—XVIII веках, — висмут, цинк,кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака водыÑ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V —прямой и перевёрнутой.
Попытки упорядочить старинные химические знаки продолжались до конца XVIIIвека. В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др.
Химические знаки
Дальтона получили некоторое распространение в Великобритании и в Западной
Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский
химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления
химических знаков сохранили свою силу до настоящего времени. В России первое
печатное сообщение о химических знаках Берцелиуса сделал в 1824московский врач
И. Я. Зацепин.
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Историческая справка: Английский ученый Джон Дальтон (1766–1844) на своих лекциях демонстрировал студентам выточенные из дерева модели атомов, показывая, как они могут соединяться, образуя различные вещества. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это раскрашенные в разные цвета деревянные кубики, которые изобрел мистер Дальтон».
Конечно, Дальтон прославился не своими «кубиками» и даже не тем, что в двенадцатилетнем возрасте стал школьным учителем. С именем Дальтона связано возникновение современной атомистической теории. Впервые в истории науки он задумался о возможности измерения масс атомов и предложил для этого конкретные способы. Понятно, что непосредственно взвесить атомы невозможно. Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10 –22 г. Поэтому массу атомов выражают в относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта. Фактически это и есть «соотношение весов» по Дальтону, т.е. относительная атомная масса. Массы атомов очень малы.
Абсолютные массы некоторых атомов:
m(C) =1,99268 ∙ 10 -23 г
m(H) =1,67375 ∙ 10 -24 г
m(O) =2,656812 ∙ 10 -23 г
В настоящее время в физике и химии принята единая система измерения. Введена атомная единица массы (а.е.м.)
m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10 -24 г.
Ar(H) = m(атома)/ m (а.е.м.) = 1,67375 ∙ 10 -24 г/1,66057 ∙ 10 -24 г = 1,0079 а.е.м.
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина.
Относительная атомная масса
- это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная атомная масса безразмерная величина!!!
Например , относительная атомная масса атома кислорода равна 15,994. Считать самим значения относительной атомной массы не всегда обязательно. Можно воспользоваться значениями, приведенными в периодической системы химических элементов Д. И. Менделеева. Записать это следует так:
Ar(O) = 16 .
Всегда используем округлённое значение.
Исключение представляет относительная атомная масса атома хлора: Ar(Cl) = 35,5.
Связь между абсолютной и относительной массами атома представлена формулой:
Распространённость элементов в природе. Основную массу космического вещества составляют Н и Не (99,9%).
Из 107 химических элементов только 89 обнаружены в природе, остальные, а именно технеций (атомный номер 43), прометий (атомный номер 61), астат (атомный номер 85), франций (атомный номер 87) и трансурановые элементы, получены искусственно посредством ядерных реакций (ничтожные количества Te, Pm, Np, Fr образуются при спонтанном делении урана и присутствуют в урановых рудах). В доступной части Земли наиболее распространены 10 элементов с атомными номерами в интервале от 8 до 26. В земной коре они содержатся в следующих относительных количествах:
Перечисленные 10 элементов составляют 99,92% массы земной коры.
Элемент |
Атомный номер |
|
47,00 |
||
29,50 |
||
8,05 |
||
4,65 |
||
В этой статье мы рассмотрим разные возможности выражения массы химических элементов.
Между собой атомы различаются: массой, размером и строением.
М асса и размеры атомов.
Сегодняшняя наука имеет возможность определить массу и размер атома. Самым маленьким является атом He (гелия) , приблизительно его размер равен 0,00000000098м. (98 * 10 -10). А самый легкий атом — это атом H (водорода) и его масса равна 0,0000000000000000000000000016735кг. (1,6735 * 10 −27).
Большинство атомов химических элементов размерами обычно намного больше атома гелия.
А самый большой атом является атом Fr (франций) и его размер равен приблизительно 0, 00000000686м. Что на 7 раз больше атома He (гелий) .
Еще больше атомы различных химических элементов больше отличается по массе, масса атома обозначается буквой m a и выражается в СИ.
А томная единица массы
При формировании атомно — молекулярных учениях в 19в. люди еще не представляли о точных размеров и масс атомов, поэтому ученые стали применять их относительные значения. Относительные значения рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Ученые химики предположили, что они пропорциональны массам атомов. Джон Дальтон принял единицу сравнения самого легкого атома — H (водорода)
В качестве сравнения используется 1\12 чать массы углерода а.e.м (атомная единица массы). Международное обозначение — u (unit — единица).
Атомная единица массы - это 1/12 часть массы атома углерода и она равна 1,66·10 −27 кг.
О тносительная атомная масса.
Сравнивая у различных элементов средние массы с а.e.м (u) , можно получить значения относительных атомных масс хим. элементов. Относительная атомная масса — это физическая величина, показывающая во сколько раз масса атома химического элемента больше 1\12 части атома углерода.
Обозначениe: A r Формула.
Из материалов урока вы узнаете, что атомы одних химических элементов отличаются от атомов других химических элементов массой. Учитель расскажет, как химики измеряли массу атомов, которые настолько мало, что их не увидишь даже с помощью электронного микроскопа.
Тема: Первоначальные химические представления
Урок: Относительная атомная масса химических элементов
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода. В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Известно, что массовая доля магния в оксиде магния равна 60%, а массовая доля кислорода – 40%. Идя по пути рассуждений Дальтона, можно сказать, что масса атома магния больше массы атома кислорода в 1,5 раза (60/40=1,5):
Ученый заметил, что масса атома водорода самая маленькая, т.к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Значительно позже работ Берцелиуса массы атомов химических элементов стали сравнивать с 1/12 массы атома углерода (Рис. 2).
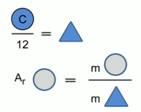
Рис. 1. Модель расчета относительной атомной массы химического элемента
Относительная атомная масса химического элемента показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода.
Относительная атомная масс обозначается А r , она не имеет единиц измерения, так как показывает отношение масс атомов.
Например: А r (S) = 32, т.е. атом серы в 32 раза тяжелее 1/12 массы атома углерода.
Абсолютная масса 1/12 атома углерода является эталонной единицей, значение которой вычислено с высокой точностью и составляет 1,66 *10 -24 г или 1,66 *10 -27 кг. Эта эталонная масса называется атомной единицей массы (а.е.м.).
Значения относительных атомных масс химических элементов запоминать не надо, они приведены в любом учебнике или справочнике по химии, а также в периодической таблице Д.И. Менделеева.
При расчетах значения относительных атомных масс принято округлять до целых.
Исключение составляет относительная атомная масса хлора – для хлора используют значение 35,5.
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с.24-25)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§10)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§8,9)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
с.24-25 №№ 1-7 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.






